14例副肿瘤性周围神经病临床特征分析
2022-09-07潘佳丽杨晓艳魏芷桦刘洪波郑州大学第一附属医院神经内科河南郑州450052
刘 举,潘佳丽,杨晓艳,魏芷桦,陈 敏,刘洪波 (郑州大学第一附属医院神经内科,河南 郑州 450052)
副肿瘤性神经综合征(paraneoplastic neurological syndrome,PNS)是一种恶性肿瘤相关的免疫介导的神经系统疾病[1]。经典PNS包括脑脊髓炎、边缘性脑炎、亚急性小脑变性、感觉神经病、慢性肠梗阻、Lambert-Eaton肌无力综合征等[2]。其中,感觉神经病为副肿瘤性周围神经病(paraneoplastic peripheral neuropathy,PPN)最常见的类型[3]。PPN诊断需要合理排除感染、代谢、中毒、退行性、转移性、医源性、自身免疫性疾病等其他非副肿瘤性原因,而上述大多数疾病比PNS更为常见。最近的一项流行病学研究显示约300例恶性肿瘤患者中才有1例出现PNS[4]。因而,在对PPN诊断过程中易出现一些漏诊、误诊、过度诊断等情况,导致治疗不当。此外,由于不断发现新的PNS抗体以及不断明确抗体肿瘤关联程度,促使PNS诊断标准得以更新。本文基于2021年最新的PNS诊断标准,回顾性分析PPN患者的临床资料,探讨其临床特征以指导临床诊疗。
1 资料与方法
1.1 研究对象纳入郑州大学第一附属医院2015年1月至2021年6月收治的PPN患者。入组标准:1)符合2021年PNS诊断标准(表1)[2];2)以周围神经病变为主要表现。排除标准:1)其他临床表型PNS患者;2)感染、代谢、中毒等其他病因所致周围神经病变;3)临床资料记录不完整者。2021年诊断标准基于PNS-Care评分系统,提出了3个诊断水平(确诊、很可能和可能PNS),综合考虑了高或中风险临床表型、高或中风险抗体和恶性肿瘤3个层面[2]。

表1 PNS诊断标准
1.2 研究方法详细记录纳入患者性别、发病年龄、临床表现、PNS抗体、合并肿瘤、肌电图、脑脊液、风湿免疫等检查结果。
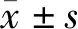
2 结果
2.1 诊断分层共纳入14例PPN患者, 5例为高风险临床表型(3分),9例为中风险表型(2分),均存在高风险抗体(3分),8例合并恶性肿瘤(4分)。因而,8例诊断为确诊PNS(2例10分,6例9分),3例诊断为很可能的PNS(6分),3例诊断为可能的PNS(5分)。见表2。
2.2 一般情况男9例,女5例,发病年龄37~71(55.9±11.3)岁,发病至确诊时间1~24(7.0±8.0)个月,病程4~76(41.4±20.8)个月。见表2。
2.3 主要临床症状及表型5例为感觉神经病,9例为感觉运动神经病,均亚急性或慢性起病。9例表现为四肢麻木无力,3例表现为四肢麻木,2例表现为双下肢麻木,5例出现躯干或肢体疼痛,2例出现言语不清、吞咽困难、声音嘶哑等延髓麻痹症状,1例伴便秘、尿频自主神经症状。见表2。
2.4 血清PNS抗体筛查5例抗Hu抗体阳性,1例抗Hu、GD1a及GM2抗体多重阳性,1例抗Hu、CV2(CRMP5)抗体双阳性,1例抗Hu、SOX1抗体双阳性,3例抗Amphiphsin抗体阳性,2例抗Yo(PCA1)阳性,1例抗CV2(CRMP5)阳性。见表2。
2.5 合并肿瘤情况活检证实,病例1、2、3、4、7等5例于周围神经病诊治过程中发现小细胞肺癌(small cell lung cancer,SCLC),病例6因下腹部包块查出SCLC并腹腔转移,同时伴有肢体麻木无力,病例5于3 a前发现B淋巴母细胞淋巴瘤,2 a前行造血干细胞移植术;病例8于2 a前发现乳腺癌,并行手术治疗。余6例中,5例随访时间27~71个月,未发现肿瘤,1例失访。见表2。
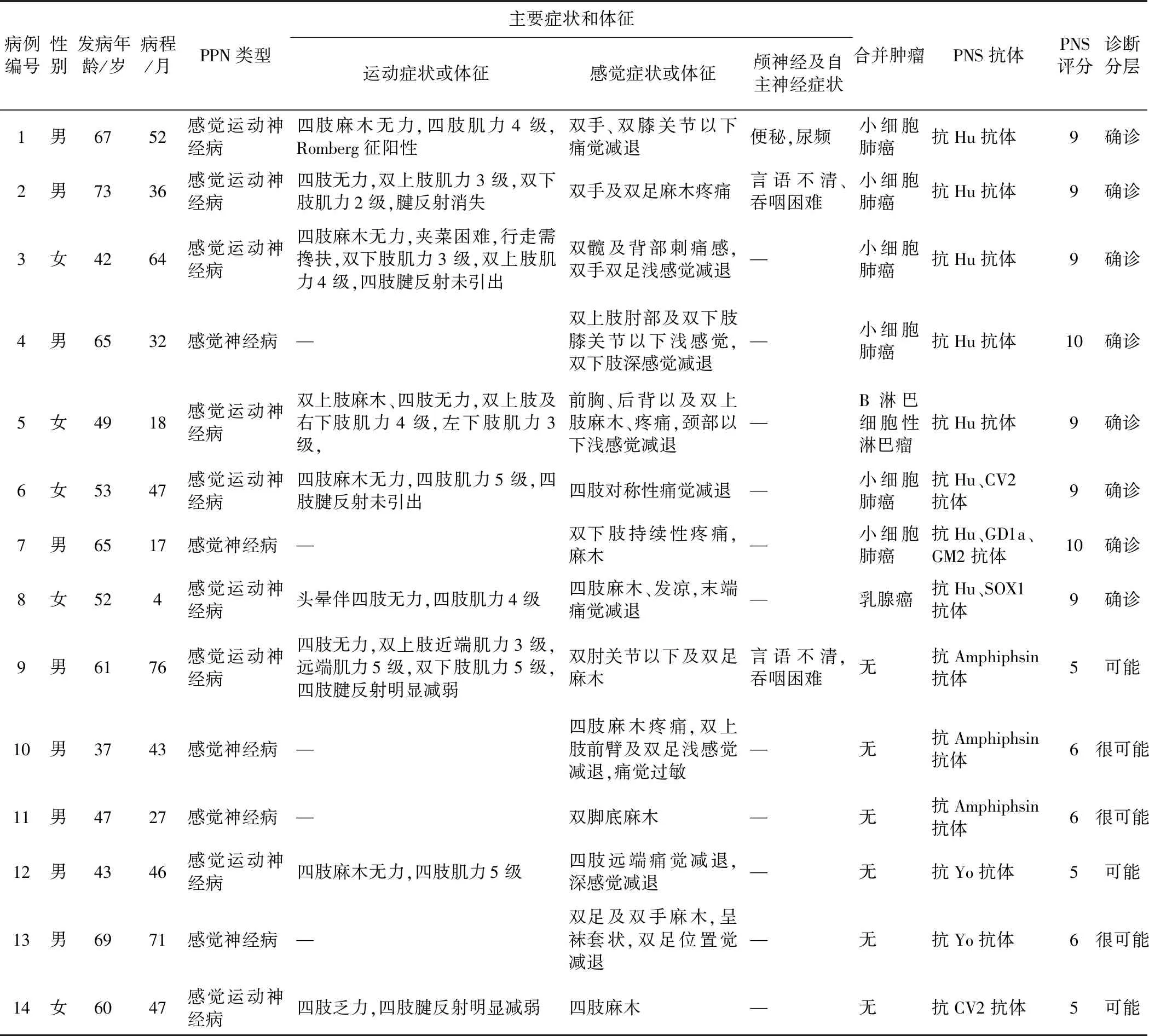
表2 14例PPN患者的临床特征
2.6 神经电生理学检查情况肌电图示:5例为感觉神经病变,9例为感觉运动神经病变;8例以轴突损害为主,6例以脱髓鞘病变为主。
2.7 实验室检查及脑脊液检查情况脑脊液白细胞数为(4.3±4.6)×106个/L,蛋白量为(627.8±204.1)mg/L,病例8脑脊液OB阳性(Ⅱ型)。病例1神经元特异性烯醇化酶32.8 μg/L,抗核抗体(ANA)1:320;病例4 ANA 1:100;病例5 ANA 1:320,抗Ro52抗体强阳性,抗中性粒细胞细胞质抗体弱阳性;其余患者肿瘤标志物、结缔组织病全套、免疫固定电泳、糖化血红蛋白、甲状腺功能等检查均未见明显异常。
2.8 治疗和预后8例明确合并肿瘤者:6例接受化疗,1例免疫抑制治疗,1例激素冲击治疗,其中病例1、2、3、4、6、7接受了化疗,病例5给予免疫抑制治疗,病例8给予激素冲击治疗,且均给予营养神经及对症治疗。经治疗后,病例1、2分别于发病4 a和2 a后死于SCLC,病例3失访,病例5经营养神经对症治疗及病例6经化疗后肢体麻木无力症状明显缓解,病例4经化疗后症状无缓解,目前需推车才能行走,病例7肢体麻木无力加重,且出现了脑转移。6例未明确合并肿瘤者:均给予营养神经及对症支持治疗,病例10失访,病例11、12、13基本恢复正常或症状明显缓解,病例9因球麻痹症状,营养不良,病情逐渐加重死亡,病例14肢体麻木无力症状无缓解,且出现小脑萎缩和痴呆表现。14例患者中,2例失访,3例死亡,4例无缓解或加重,5例缓解。
3 讨论
既往研究[4]表明,PNS发病率为0.89/10万人年,有逐年上升趋势,而PNS的患病率为4.37 / 10万,其中8%的PNS患者为PPN,次于边缘性脑炎(31%)、小脑变性(28%)和脑脊髓炎(20%)。本研究纳入患者依据2021年最新的PNS诊断标准诊断[2]。2004年国际专家小组曾确定了一套PNS诊断标准,并广泛应用于临床和研究[5]。随着PNS的研究进展,既往诊断标准部分已经过时,比如典型或不典型综合征不合并肿瘤时特征性抗体阳性即可确诊,而2021年诊断标准中确诊PNS(评分≥8)包括同时存在高或中风险表型、高或中风险抗体以及恶性肿瘤[2]。新标准使PNS诊断更加确定,为临床及基础研究提供更为可靠资料。
本研究纳入PPN患者男性居多,中老年占绝大多数,最近的一项研究表明PNS中位年龄为68(26~90)岁[4],两者基本一致。也有文献[6]报道抗Hu抗体阳性PNS患者中75%为男性。本研究中感觉神经病约占1/3,感觉运动神经病约占2/3,亚急性或慢性起病,可伴有颅神经和自主神经症状。感觉神经病为PNS经典副肿瘤综合征或高风险表型,而感觉运动神经病类型为非经典综合征或中风险表型[2, 5]。PPN以感觉神经病最为常见,是指由背根神经节感觉神经元受累引起的一种表型,可伴有运动症状[7]。本研究中所有患者均存在感觉神经损害,多数以轴突损害为主。感觉神经病的诊断(不管病因如何)也需遵循一定标准[8]。有研究[9-10]表明,感觉神经病肌电图表现是感觉神经动作电位的严重和弥漫性改变、轴突损害为主或混合型轴突和脱髓鞘损害。此外,本研究中患者脑脊液常规基本正常,脑脊液蛋白量轻度增高,可呈现蛋白细胞分离现象,容易误诊为急性格林-巴利综合症或慢性炎症性脱髓鞘性多发性神经病,若疗效不佳,需进行PNS抗体筛查。
本研究中抗Hu抗体阳性者最多,其次是抗Amphiphysin抗体、抗Yo抗体、抗CV2阳性。既往研究[6, 11-12]表明,感觉神经病最常见的是抗Hu抗体,其次是抗CV2和抗amphiphysin抗体。抗Hu抗体被称为抗神经核抗体1型(ANNA-1),于1985年首次被描述,以2例患者的姓氏的首字母命名,2004年由Graus等[5]归类为PNS特征性抗体。抗Hu抗体阳性者以SCLC患者居多(>85%)[6]。本研究中8例恶性肿瘤患者均抗Hu抗体阳性,6例患SCLC,1例患乳腺癌,1例患淋巴瘤。抗Hu抗体的致病机制目前仍不清楚,通常被认为不直接致病,T细胞介导的细胞免疫才是PNS致病机制[13]。
不同于抗Hu抗体,既往研究[9]表明抗CV2抗体可导致轴突和脱髓鞘混合型损害的感觉运动神经病,并且约50%抗CV2抗体阳性者可出现小脑性共济失调等表现。与之一致,病例14除了感觉运动神经病之外,还伴有进展性小脑性共济失调及认知功能减退。此外,有研究[14]报道,抗Yo抗体见于感觉神经病,抗Amphiphysin抗体可导致感觉运动神经病[15],然而,本研究结果显示抗Yo、Amphiphysin抗体可导致感觉神经病或感觉运动神经病,需扩大样本量总结。抗amphiphysin、Yo、 CV2抗体阳性者随访2 a以上均未发现肿瘤,需继续随访。
此外,3例患者出现多重抗神经元抗体阳性。病例7血清抗Hu抗体阳性,同时抗GD1a、GM2抗体阳性,脑脊液蛋白轻度增高,病程4月,表现为双下肢持续性麻木疼痛,存在SCLC,临床表型为高风险临床综合征,综合考虑为确诊PNS。神经节苷脂抗体在PNS发病机制中的作用尚不明确,需进一步阐明[16]。另外,1例抗Hu、CV2抗体阳性,1例抗Hu、SOX1抗体阳性。既往研究[17-18]表明联合检测血清肿瘤标志物或非血清淀粉样蛋白A联合肿瘤标志物检测能显著提高肺癌辅助诊断的敏感性和阳性率,同样,以上3例多重抗体阳性患者均合并恶性肿瘤(SCLC或乳腺癌),提示多种抗体并存对肿瘤的预警监测、早期发现意义重大,涉及的病理机制也更加复杂。
纳入患者8例合并恶性肿瘤,以SCLC为主,其余6例随访2 a以上均未发现肿瘤。有研究[4]表明PNS最常见的原发性肿瘤是SCLC(17%)和乳腺癌(16%),其次是淋巴瘤(12%)。本研究结果提示PPN中合并SCLC比例较PNS要更高一些。PNS的症状通常出现在发现恶性肿瘤之前。恶性肿瘤是最新诊断标准确诊PNS的必要条件,不合并恶性肿瘤者仅诊断为可能或很可能,非确诊PPN有助于肿瘤早期诊断和治疗,是降低死亡率和复发率的关键所在。
在治疗方面,有研究[19]报道,感觉神经病的治疗窗口期不超过2~3个月。一些研究[20]尝试了免疫调节或免疫抑制剂治疗,包括大剂量激素冲击治疗、血浆置换、环磷酰胺、利妥昔单抗等。其中一些研究表明轻微改善或稳定,但总体而言,无肯定结论,只提供Ⅳ类证据[21]。一项大样本抗hu抗体阳性患者的回顾性研究[6]表明,肿瘤早期治疗是唯一与神经功能稳定显著相关的因素。此外,神经病理性疼痛等对症治疗不可忽视[22]。
总之,由于恶性肿瘤和周围神经病变均比较常见,两者可能在很多患者偶然并存,PNS抗体非PNS充分条件,在临床实践或科研中,需要采用更为严格的2021年PNS诊断标准。本研究中PPN患者表现为感觉神经病或感觉运动神经病,以抗Hu抗体阳性者和SCLC最多见,可采用免疫抑制剂治疗,早期治疗原发肿瘤,少数可缓解症状,但总体预后不佳。
