环状RNA hsa_circ_0009244对食管鳞癌细胞生物学行为的影响
2022-09-07姜国忠郑州大学第一附属医院病理科河南郑州450052郑州大学第五附属医院病理科河南郑州450052
张 岚,朱 迪,2,姜国忠 (.郑州大学第一附属医院病理科,河南 郑州 450052;2. 郑州大学第五附属医院病理科,河南 郑州 450052)
我国是食管癌发病率最高的国家之一,食管鳞癌约占总确诊病例的90%[1-2]。食管鳞癌作为高侵袭性恶性肿瘤,其疾病进展迅速,患者预后较差,5 a总体生存率较低,Ⅳ期患者的中位生存期不足1 a,大多数食管鳞癌患者早期不易发现,初次确诊时已处于中晚期阶段[3-5]。近年来,虽然在食管鳞癌的诊断和治疗方面取得了突破性进展,但其患者的生存率并没有显著提高[5-6]。因此,更好了解食管鳞癌发生的分子机制,识别新的生物标志物和治疗靶点,对于提高食管鳞癌的早期诊断和治疗水平显得尤为重要。
人类基因组研究项目的结果已经证实,有超过70%的人类基因组可转录为RNA,但大多数是非编码RNA,环状RNA(circular RNA,circRNA)作为一类新的内源性非编码RNA,是通过反向剪接方式产生的共价闭合环状结构,缺乏5’帽结构和3’多聚腺苷酸尾,具有结构稳定性和进化保守性等特点,对多种疾病的发生发展过程均有影响[7-8]。研究[9]发现,微小RNA(micro RNA,miR)是一类长约22个寡核苷酸的非编码小RNA,通过转录后调控机制参与靶基因的调控,而circRNA可作为miR分子海绵以发挥其调控作用。研究[10-15]证实circRNA在多种肿瘤的发生、发展中起着重要作用,具有作为肿瘤标志物的可能性。同样,对circRNA全方位、多层面的研究将有助于我们对食管鳞癌的深入了解,并对食管鳞癌的早期诊断及其靶向治疗提供新思路。
课题组前期已对所提取的73对食管鳞癌肿瘤组织及其癌旁正常组织的总RNA测序结果进行分析,发现circRNA的表达在食管鳞癌组织中存在显著差异性,hsa_circ_0009244(circ-9244)便是其中之一[5]。因此,本研究通过对食管鳞癌肿瘤组织及癌旁正常组织中circ-9244的表达水平进行分析,发现circ-9244在食管鳞癌组织中呈高表达水平,且与食管鳞癌患者预后不良有关,并进一步探讨下调circ-9244的表达水平对食管鳞癌细胞增殖、迁移及侵袭的影响。
1 材料与方法
1.1 细胞、临床标本及主要试剂
1.1.1 细胞 食管鳞癌细胞系及正常食管上皮细胞Het-1A均购自上海中科院细胞库。
1.1.2 临床标本 来自安阳市肿瘤医院食管鳞癌患者的手术切除标本,标本均在术中快速液氮冻存。本研究中入组的所有患者均签署了知情同意书,并在术前没有进行任何放疗、化疗和靶向治疗。
1.1.3 主要试剂 胎牛血清购自以色列BI公司;DMEM高糖培养基购自美国 Hyclone公司;质量分数0.25% EDTA胰蛋白酶消化液购自北京索莱宝科技有限公司;Lipofectamine®2000购自美国Invitrogen公司;T4-DNA连接酶及EcoRI-HF/AgeI-HF内切酶均购自中国NEB公司;PLKO.1-TRC克隆载体购自广州吉赛生物科技有限公司;实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction ,qRT-PCR)试剂盒购自南京诺唯赞生物科技有限公司;无内毒素质粒小提试剂盒购自天根生化科技(北京)有限公司、MTS试剂购自北京普瑞金科技有限公司;Transwell小室及Matrigel基质胶均购自美国Corning公司;实验用引物均有北京擎科生物技术有限公司郑州分公司合成。
1.2 方法
1.2.1 质粒构建 根据Circular RNA Interactome网站(https://circinteractome.nia.nih.gov/)设计circ-9244的siRNA序列,并依据addgene网站(https://www.addgene.org/protocols/plko/)中PLKO.1-TRC克隆载体的要求设计目的基因circ-9244的短发夹RNA(short hairpin RNA ,shRNA)序列(表1)。其shRNA设计原则如下:正向引物:5’CCGG--21 bp sense--CTCGAG--21 bp antisense--TTTTTG 3’;反向引物:5’AATTCAAAAA--21 bp sense--CTCGAG--21 bp antisense 3’;各取5 μL正反引物(20 μm),退火形成发夹结构;用AgeI-HF和EcoRI-HF对PLKO.1-TRC克隆载体进行37 ℃过夜双酶切;用T4-DNA 连接酶将线性化载体和 shRNA 目的片段按照1:10比例16 ℃过夜连接;按 1:10 比例将连接产物转移至DH5α感受态细胞中进行转化并置于37 ℃细菌培养箱中过夜孵育;挑取单菌落进行菌液鉴定并送至北京擎科生物技术有限公司进行测序;根据测序结果,对构建成功的PLKO.1-circ-9244-shRNA质粒进行提取和保存。

表1 circ-9244-shRNA序列
1.2.2 细胞培养 从液氮罐中取出冻存的细胞株KYSE410、KYSE520,37 ℃水浴锅中迅速解冻后将细胞悬液转移到15 mL离心管中,加入3 mL完全培养基,巴氏管轻吹混匀后1 000 r/min离心3 min;弃上清并加入3 mL完全培养基,巴氏管轻吹混匀后均匀铺至细胞培养皿中,放于37 ℃、体积分数5% CO2培养箱中进行细胞培养。运用牛鲍计数板对细胞进行计数和铺板,12孔板细胞密度以每孔细胞数1×105个为宜,37 ℃、体积分数5% CO2培养箱中过夜培养;次日按照转染试剂与待转染质粒2:1比例进行细胞转染;48 h后进行后续实验。
1.2.3 qRT-PCR检测circ-9244表达水平及shRNA下敲效果 分别对食管鳞癌细胞、正常食管上皮细胞、转染48 h的空载组和实验组细胞进行RNA提取并逆转录为cDNA,并将cDNA原液用双蒸水稀释到100 ng/μL。选取上游引物circ-9244-F:AGGCTCAACGAGGAACTCAA、下游引物circ-9244-R:GTCCTGGCTCCATCCAAT;上游引物GAPDH-F:ACCCAGAAGACTGTGGATGG、下游引物GAPDH-R:TTCAGCTCAGGGATGACCTT。根据说明书配置qRT-PCR反应体系,设定反应条件,每个指标做3个复孔。最后进行数据分析,筛选出下敲效率较高的PLKO.1-circ-9244-shRNA 质粒。
1.2.4 MTS实验 按照实验分组对转染48 h的细胞进行计数,空载组为仅转染空载质粒48 h且不涉及 circ-9244 表达量改变的细胞组,实验组为转染下敲质粒48 h且与circ-9244表达量改变相关的细胞组。按照每孔5 000个细胞、100 μL培养基的标准,每个指标设置6个复孔,共测6个时间点:0、12、24、36、48和60 h,计算各个实验组所需细胞悬液量和需补加的完全培养基的量依次铺于96孔板中,37 ℃、体积分数5% CO2细胞培养箱孵育6~8 h。然后按照完全培养基与MTS试剂10:1的比例配制反应体系,避光轻吹混匀,弃去0 h组中旧培养基,并依次取110 μL的MTS溶液加到各个孔中,细胞培养箱中孵育1~2 h后,轻拍混匀,酶标仪上测492 nm处的光密度(optical deasity,OD)值,作为0 h数据;每隔12 h测下一个时间点的OD值,直至6个时间点测完为止,将数据保存并对实验结果进行统计分析。
1.2.5 划痕实验 按照实验分组对转染48 h的细胞进行计数(分组同上),以每孔1×105个细胞的标准铺于12孔板中,每个指标做3个复孔,37 ℃、体积分数5% CO2细胞培养箱中过夜培养。在12孔板中央均匀划线,并清洗脱落的细胞,在显微镜下拍照保存,作为0 h划痕结果。每隔24 h进行拍照,依次拍摄24、48 h划痕结果,并对数据进行整理与分析。
1.2.6 Transwell实验 首先对Transwell小室(含matrigel胶)进行水化处理并按照实验分组对转染48 h、进行饥饿处理的细胞进行计数,空载组为转染空载质粒48 h、进行饥饿处理12 h且不涉及circ-9244表达量改变的细胞组,实验组为转染下敲质粒48 h、进行饥饿处理12 h并与circ-9244表达量改变相关的细胞组;以每小室5×104个细胞的标准接种于各个Transwell小室中,并在下室加入600 μL含体积分数20%胎牛血清的完全培养基,每个指标各做3个复孔,37 ℃、体积分数5% CO2细胞培养箱中培养48 h。甲醇固定30 min,并用质量分数0.2%结晶紫室温染色0.5~1 h。显微镜下拍照保存,并对结果进行统计分析。
2 结果
2.1 circ-9244在不同食管组织中的表达及其与食管鳞癌患者预后的关系随机选取前期研究的55对食管鳞癌组织分析circ-9244表达水平,发现与癌旁正常组织相比,其表达水平在肿瘤组织中升高约3.8倍(t=2.862,P=0.005);并根据circ-9244相对表达量分组进行食管鳞癌患者预后分析发现,与circ-9244低表达组比较,circ-9244高表达组患者预后较差(P=0.038)。见图1、2。

图1 circ-9244在不同食管组织中表达比较
2.2 circ-9244不同食管细胞中的表达circ-9244在KYSE270、KYSE410及KYSE520细胞中表达相对较高。见图3。
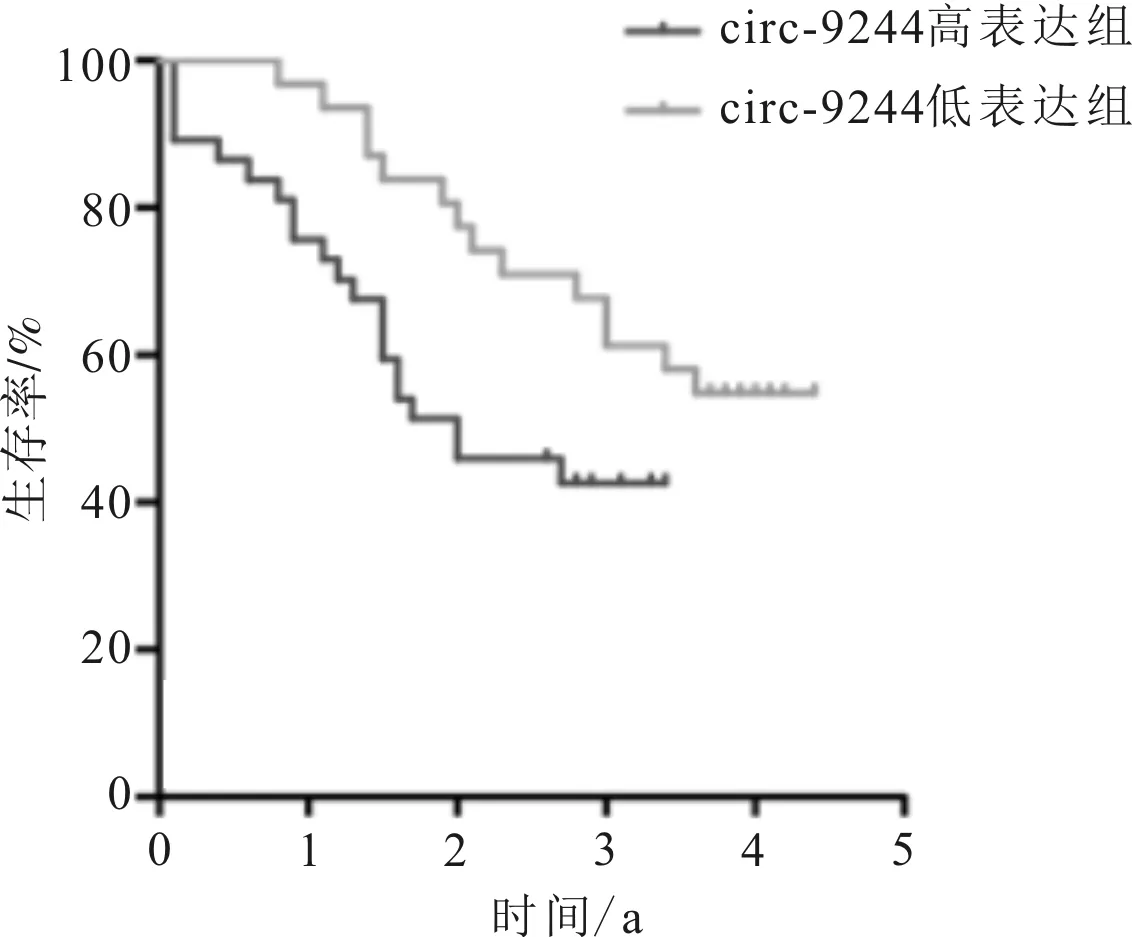
图2 不同circ-9244表达食管鳞癌患者生存曲线比较
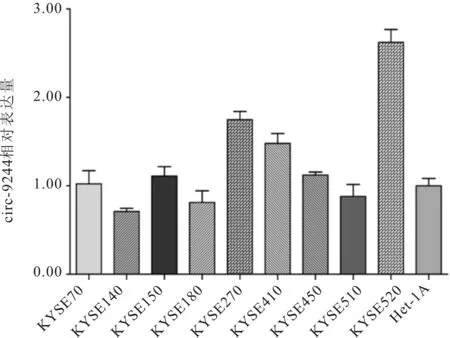
图3 circ-9244在不同食管细胞中的表达
2.3 PLKO.1-circ-9244-shRNA质粒下敲效率的鉴定选取circ-9244相对高表达的KYSE410和KYSE520细胞,分别转染PLKO.1-NC-shRNA质粒(空载组)和PLKO.1-circ-9244-shRNA质粒(实验组),以筛选具有较高下敲效率的质粒进行后续实验,结果发现,与空载组比较,实验组PLKO.1-circ-9244-shRNA2质粒可明显下调circ-9244的表达水平(KYSE410细胞:t=3.013,P=0.010; KYSE520细胞:t=5.959,P=0.004)。见图4。
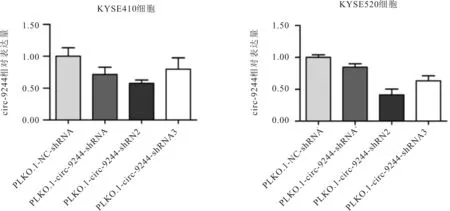
图4 不同PLKO.1-circ-9244-shRNA质粒下敲效果的验证
2.4 MTS实验结果选取下敲效率高的PLKO.1-circ-9244-shRNA2质粒转染上述circ-9244高表达KYSE410和KYSE520细胞,48 h后运用MTS法检测细胞的增殖效率,结果表明,与空载组比较,实验组食管鳞癌细胞增殖效率、划痕愈合率及穿膜细胞数明显低于空载组,差异均有统计学意义(KYSE410细胞:t=12.345,P<0.001;KYSE520细胞:t=7.941,P<0.001)。见图5。
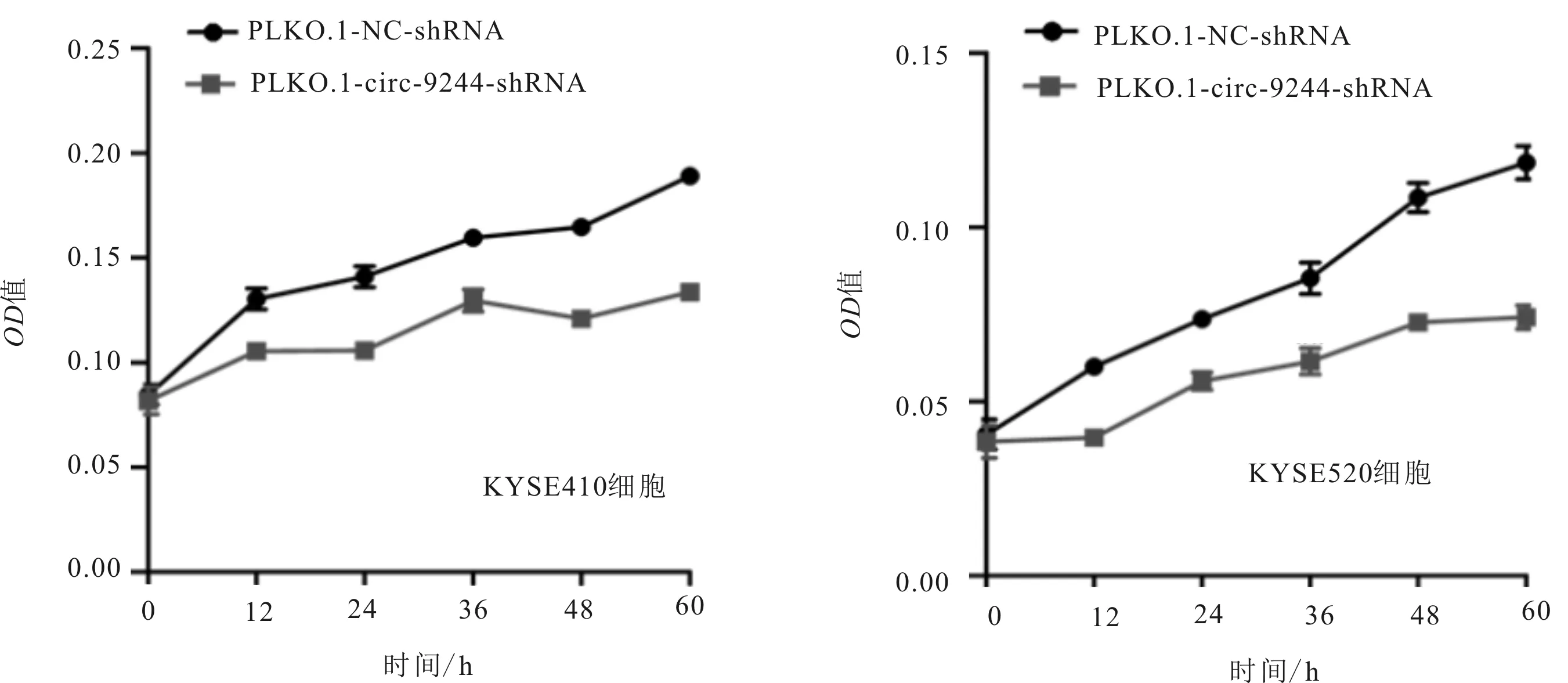
图5 下调circ-9244表达对食管鳞癌细胞增殖的影响
2.5 划痕实验结果选取PLKO.1-circ-9244-shRNA2质粒转染KYSE410和KYSE520细胞进行细胞划痕实验,结果表明,与空载组比较,实验组敲低circ-9244表达后食管鳞癌细胞划痕愈合率明显低于空载组,差异均有统计学意义(KYSE410细胞:t=10.910,P<0.001;KYSE520细胞:t=8.499,P<0.001)。见图6。
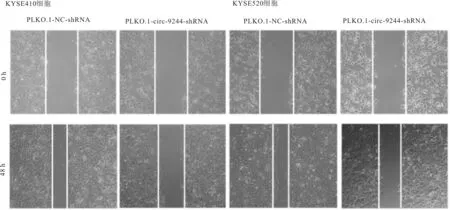
图6 下调circ-9244表达对食管鳞癌细胞迁移能力的影响
2.6 Transwell实验结果选取高下敲效率的PLKO.1-circ-9244-shRNA2质粒,转染至circ-9244高表达KYSE410和KYSE52 细胞,48 h Transwell结果表明,与空载组比较,实验组食管鳞癌穿膜细胞数明显低于空载组,差异均有统计学意义(KYSE410细胞:t=11.040,P<0.001;KYSE520细胞:t=10.720,P<0.001)。见图7。
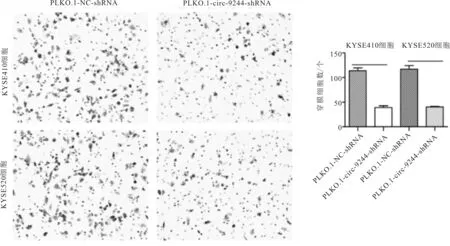
图7 下调circ-9244对食管鳞癌细胞侵袭能力的影响
3 讨论
食管癌是具有高度侵袭性、高发病率和高致死率的消化道恶性肿瘤之一,食管鳞癌作为食管癌常见组织类型,大多数 食管鳞癌 患者都伴有晚期疾病,5 a生存率常低于20%,病死率较高[16],这对人类的生命健康构成了严重的威胁。且该肿瘤早期不易发现,其浸润和转移是导致治疗失败和患者死亡的主要原因[17-18]。因此,早发现、早治疗对提高食管鳞癌患者的生命质量显得尤为重要。
CircRNA作为长链非编码RNA的一个亚类,是通过反向剪接方式形成的一类新型核糖核酸分子,具有共价闭合的环状结构,可以抵抗核酸外切酶的降解作用,是近年来研究的热点。且近10 a的研究[19-20]已经表明circRNA以其独特的生物学属性和多样的生物学功能对包括恶性肿瘤在内的多种疾病的发生、发展均具有重要的调节功能。如circRNA可以通过miR的 “海绵”吸附作用、亲本基因的转录调节作用及竞争性结合RNA结合蛋白等作用发挥生物学功能[21-22],且某些circRNA可以通过m6A甲基化修饰来促进翻译[23]。
本研究前期对食管鳞癌肿瘤组织与癌旁配对组织中circRNA的表达谱进行分析,发现具有差异表达的circ-9244[16]。Circ-9244的宿主基因SDF4,又名 Cab45,通过选择性剪接可以形成三种不同的亚型,属于钙离子结合蛋白超家族中的一员[24-26],且相关研究发现Cab45 在Panc1胰腺癌细胞、结肠癌LIM1215细胞、宫颈癌HeLa细胞和食管癌细胞中表达均上调,并促进上述肿瘤细胞的增殖和迁移[27]。因此,我们猜想是否可以通过干扰circ-9244在食管鳞癌中的生物合成过程来降低其在食管鳞癌中的表达水平,从而达到抑制食管鳞癌恶性行为的进展。
本研究以前期实验为基础,进一步分析发现circ-9244在食管鳞癌肿瘤组织中呈高表达水平,且与患者预后不良有关。通过构建circ-9244下敲质粒并成功转染至食管鳞癌细胞中,根据MTS实验、划痕实验及Transwell实验分别观察空载组和实验组细胞增殖、迁移和侵袭的数量,结果均表明下调circ-9244的表达水平可显著抑制食管鳞癌细胞的生物学行为。由此推测抑制circ-9244的表达可以减弱食管鳞癌细胞的增殖、迁移及侵袭能力,从而阻止食管鳞癌的恶性进展。因此,circ-9244或可成为下一个食管鳞癌潜在的生物标志物和治疗靶点。
