紫玉兰‘红元宝’Ml3GT1基因的克隆及表达分析
2022-09-07王卓为戴梦怡程少禹王小德王亚玲申亚梅
王卓为, 戴梦怡, 程少禹, 王小德, 王亚玲, 申亚梅, 张 超*
( 1. 浙江省园林植物种质创新与利用重点实验室/南方园林植物种质创新与利用国家林业和草原局重点实验室/浙江农林大学 风景园林与建筑学院, 杭州 311300; 2. 西安植物园, 西安 710061 )
花色是观赏植物重要的品质性状之一,花青素苷(anthocyanin)是由花青素苷元(anthocyanidin)和糖组成的糖苷,是影响花色的一类重要色素物质(戴思兰和洪艳,2016)。目前,关于花青素的生物合成途径的研究已经比较深入。图1显示花青素生物合成通路上的3条主链产生矢车菊素(cyanidin)、天竺葵素(pelargonidin)以及飞燕草素(delphinidin),矢车菊素甲基化生成芍药色素(peonidin),矮牵牛色素(petunidin)和锦葵色素(malvidin)则由飞燕草素不同程度的甲基化而来,共同构成了自然界中6种主要花色素(朱丽娟等,2012)。对花青素苷元进行糖基化修饰,可形成稳定的花青素苷并对呈色具有重要作用(招雪晴等,2017)。
在植物花色形成过程中,UDP-类黄酮3-O-葡萄糖基转移酶(UDP-flavonoid 3-O-glucosyltransferase,3GT)通常作用于花青素苷合成途径的最后一步,能够催化UDP-葡萄糖中的糖分子转移到花色素的C3羟基位点上,将花青素转化生成该通路上第一个稳定的花青素苷(Sui et al., 2011)。花青素在自然条件下性质不稳定,易通过糖苷键与糖形成花青素苷(Nakatsuka et al., 2008),构成花青素苷的单糖主要有葡萄糖、鼠李糖、半乳糖、木糖和阿拉伯糖(庄维兵等,2018)。从化学的角度来看,糖的结合增加了花青素苷的稳定性和水溶性,花青素最常在C3位发生O-糖基化,其次是C5位的糖基化,糖基化使花青素很容易从细胞质的生产部位转移到液泡(Nakatsuka et al., 2008),从而使颜色稍微向红色转变(Tanaka et al., 2008)。由此可见,糖基化对花色的形成起到关键作用。
第一个被发现可以催化花青素C3羟基糖基化的酶是玉米() Bronze-1 (X13500),由于花青素的积累较少,突变体呈现出苍白的色粒(Dooner & Nelson, 1977;Larson & Coe, 1977)。迄今为止,3基因已经在矮牵牛()(Jonsson et al., 1984)、三花龙胆()(Tanaka et al., 1996)、荷兰鸢尾()(Yoshihara et al., 2005)、小苍兰()(Sui et al., 2011)、滇牡丹()(王毅等,2017)、葡萄风信子()(杜灵娟等,2017)等观赏植物中克隆得到。在大多数植物中,3的表达常常与花青素的积累正相关,如3和,然而在有的植物中,如3,其表达并不呈现正相关的趋势(Ban et al., 2009;Sui et al., 2011;Hu et al., 2016; Qian et al., 2021)。3在蝴蝶兰()红色形成中起着重要作用,抑制3的表达导致花青素含量的显著下降(Chen et al., 2011)。舒庆艳等(2018)利用VIGS技术沉默紫斑牡丹()3基因,3G型糖苷和3G5G型糖苷都有不同程度的降低。由此可见,3基因在植物花色形成中具有重要作用。
紫玉兰‘红元宝’(‘Hongyuanbao’)为木兰科(Magnoliaceae)木兰属()的多年生落叶灌木,是紫玉兰()的栽培品种,该品种花色深于紫玉兰。课题组前期研究显示,紫玉兰和紫玉兰‘红元宝’花被片中均含有4种在C3位芸香糖苷修饰的花青素苷,即矢车菊素3-O-芸香糖苷-5-O-葡萄糖苷(Cy3Ru5G)、矢车菊素3-O-芸香糖苷(Cy3Ru)、芍药素3-O-芸香糖苷-5-O-葡萄糖苷(Pn3Ru5G)、芍药素3-O-芸香糖苷(Pn3Ru) (Wang et al., 2019)。花青素的C3位芸香糖苷化修饰分两步完成,首先在3GT作用下C3位发生O-葡萄糖基化,随后鼠李糖转移酶(3-O-rhamnosyltransferase,3RT)才可以转移O-鼠李糖苷与O-葡萄糖苷相连形成芸香糖苷基团(Yamazaki et al., 2002)。由此推测紫玉兰‘红元宝’花色形成过程中,3基因对4种花青素苷的合成具有重要作用。为进一步揭示其功能,本研究基于转录组数据,筛选出3基因,并对其进行克隆和表达分析,研究结果为木兰属植物花色形成机理研究提供重要依据。
1 材料与方法
1.1 试验材料
紫玉兰‘红元宝’十年生实生苗种植于浙江农林大学平山试验基地(119°42′54.67″ E、30°15′50.09″ N),选择生长健壮且无病虫害的植株,于2019年4月采取花蕾期(bud period)(S1)、露色期(dew color period)(S2)、初开期(initial flowering period)(S3)、半开期(half-flowering period)(S4)、盛开期(fully-flowering period)(S5)5个时期的最外轮花瓣(图2),锡纸包裹,液氮速冻固样。由于紫玉兰‘红元宝’为花叶同放,同时采集根、茎、老叶、嫩叶等组织部位的样品,保存于-80 ℃冰箱,用于RNA提取和荧光定量分析。

CHS. 查尔酮合成酶; FLS. 黄酮醇合成酶; CHI. 查尔酮异构酶; F3H. 黄烷酮3-羟基化酶; F3′H. 类黄酮-3′-羟基化酶; F3′5′H. 类黄酮-3′,5′-羟基化酶; DFR. 二氢黄酮醇还原酶; ANS. 花青素合成酶; UF3GT. UDP-类黄酮3-O-葡萄糖基转移酶; LAR. 无色花青素还原酶; ANR. 花青素还原酶。CHS. Chalcone synthase; FLS. Flavonol synthase; CHI. Chalcone isomerase; F3H. Flavanone 3-hydroxylase; F3′H. Flavonoid-3′-hydroxylase; F3′5′H. Flavonoid-3′,5′-hydroxylase; DFR. Dihydroflavonol reductase; ANS. Anthocyanin synthase; UF3GT. UDP-flavonoid 3-O-glucosyltransferase; LAR. Leucoanthocyanin reductase; ANR. Anthocyanin reductase.图 1 花青素生物合成途径Fig. 1 The biosynthetic pathway of anthocyanin(Petroni & Tonelli, 2011; Liu et al., 2018)

图 2 不同开花阶段的紫玉兰‘红元宝’Fig. 2 Flowering stages of Magnolia liliflora ‘Hongyuanbao’
1.2 总RNA的提取、检测与cDNA的合成
使用诺禾致源UltraClean Polysaccharide and phenol Plant RNA Purification Kit (DNA free)RNA提取试剂盒(NHUC002S),提取紫玉兰‘红元宝’S1~S5时期花瓣和根、茎、老叶、嫩叶等组织部位的总RNA。使用PrimeScriptRT Master Mix (Perfect Real Time) (TaKaRa code: RR036A)进行反转录反应。反转录后得到的cDNA保存在-20 ℃冰箱备用。
1.3 Ml3GT1基因克隆
利用本课题组前期构建的紫玉兰‘红元宝’花瓣转录组数据库(结果未发表),以anthocyanidin/ flavonoid 3-O-glucosyltransferase为检索词,对注释到Nr(non-redundant protein database)数据库的基因注释进行筛选,对得到的序列CL3388.Contig1进一步通过NCBI的BLAST功能(https://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行blast比对。在开放阅读框(open reading frame, ORF)框的两侧使用Prime Prime 5.0软件设计引物(表1),引物由杭州有康生物技术有限公司合成。将紫玉兰‘红元宝’花发育的S1~S5共5个时期的cDNA等量混匀,稀释10倍作为模板,进行RT-PCR扩增。20 μL PCR反应体系如下:上下游引物(10 μmol·L)各1 μL,cDNA模板1 μL,Premix Taq 10 μL,ddHO 7 μL。反应程序:95 ℃预变性5 min后运行35个循环(95 ℃变性 30 s,59.6 ℃ 30 s,72 ℃ 2 min);72 ℃ 10 min,10 ℃ 5 min。PCR反应结束后,通过1%(w/v)琼脂糖凝胶电泳分离目的片段。切胶后,使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa code: No.9762)试剂盒按照使用说明书进行胶回收。回收后,取适量的回收产物连接至pMD18-T Vector(TaKaRa code: No.6011)。连接产物转化大肠杆菌DH5α Competent Cells(TaKaRa code: No. 9057),蓝白斑筛选后挑单克隆进行菌落PCR鉴定,条带正确的送至杭州有康生物技术有限公司进行DNA测序。

表 1 紫玉兰‘红元宝’Ml3GT1基因克隆及实时荧光定量引物Table 1 Primers for cloning and real-time quantitative PCR of Ml3GT1 in Magnolia liliflora ‘Hongyuanbao’
1.4 Ml3GT1基因的生物信息学分析
使用SnapGene 4.1.8软件去除载体序列,获得目的基因序列;使用DANMAN 7.0软件将核苷酸序列翻译成蛋白质序列;利用NCBI提供的ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)分析序列的编码区;利用CDD蛋白保守结构域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白的保守域;利用ProtParam (https://web.expasy.org/protparam/)在线软件对紫玉兰‘红元宝’Ml3GT1蛋白序列的分子量、等电点、不稳定系数、脂肪指数和亲疏水性等理化性质进行预测;利用protscale 在线网站分析该蛋白质的亲/疏水性(https://web.expasy.org/protscale/);利用SOPMA 在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测Ml3GT1蛋白序列的二级结构;利用SWISS-MODEL在线网站(swissmodel.expasy.org)预测Ml3GT1蛋白的三级结构;使用DNAMAN 7.0软件进行多序列比对,并使用MEGA 6.0软件构建系统发育进化树,系统发育进化树的构建在序列比对后,采用邻接法建树(neighbor-joining,NJ),bootstrap重复1 000次获得分支可信度。
1.5 Ml3GT1在花开放的不同时期与组织的表达分析
使用Light Cycler 480 Ⅱ (Roche)实时定量PCR仪进行基因表达相对定量分析。反应体系:模板2 μL,上下游引物各0.8 μL,荧光染料BCG Qpcr Master Mix(2×) 10 μL和6.4 μL ddHO。通过两步法进行qRT-PCR,扩增程序为95 ℃预变性30 s后运行40个循环(95 ℃ 5 s,60 ℃ 30 s),然后再运行(95 ℃ 5 s,60 ℃ 1 min,95 ℃ 15 s)。对反转录得到的cDNA分别进行5倍数梯度稀释,以为内参基因(王宁杭等,2019),每个样品设置3个生物学重复。采用2计算目的基因的相对表达量。使用SigmaPlot 14.0软件进行数据分析和绘图。
2 结果与分析
2.1 Ml3GT1基因克隆及序列分析
紫玉兰‘红元宝’的RT-PCR结果显示,扩增产物长1 863 bp(图3),将测序得到的序列通与转录组序列CL3388.Contig1进行比对,核苷酸序列相似性为99.84%。利用NCBI的ORF finder分析发现其最长开放阅读框1 374 bp,编码457个氨基酸,推导的氨基酸序列与转录组序列相似性为100%。将该基因命名为31,在GenBank登录号为MW454862。

M. DL2000 DNA Marker; 1. Ml3GT1。图 3 紫玉兰‘红元宝’Ml3GT1基因克隆Fig. 3 Gene cloning of Ml3GT1 from Magnolia liliflora ‘Hongyuanbao’
通过NCBI的CDD蛋白保守结构域数据库,对紫玉兰‘红元宝’Ml3GT1蛋白保守区进行预测,结果表明,Ml3GT1具备尿嘧啶二磷酸-糖基转移酶结构域(PLN02670),UDP-葡萄糖醛酸基/葡萄糖基转移酶保守域(UDPGT),表明Ml3GT1属于糖基转移酶超家族,具有GT1_Gtf-like结构域,表明其属于植物界中最大的家族1糖基转移酶(GT1s)。按照蛋白质的三维折叠模式,糖基转移酶可以大致划分为GT-A、GT-B和GT-C三大类(Coutinho et al., 2003),预测结果显示,Ml3GT1为GT-B类的糖基转移酶。
利用NCBI的在线Blastp功能,将Ml3GT1的氨基酸序列与其他植物的氨基酸序列进行在线比对,结果表明,Ml3GT1与沉水樟()3GT的相似性最高,达60.35%,与荷花()、杨梅()、海枣()、美洲葡萄()、蓖麻()等物种3GT的相似性较高,为49.00%~54.27%。
使用DNAMAN 7.0软件将Ml3GT1推导的氨基酸序列与其他物种已发表的3GT氨基酸序列进行多序列比对。图4结果显示,Ml3GT1与拟南芥、苹果、玉米、矮牵牛、葡萄、三花龙胆3GT蛋白的相似性分别为46.20%、44.20%、41.60%、38.40%、47.20%、41.80%,且Ml3GT1与其他3GT蛋白类似,其C端具备典型的由44个氨基酸组成的保守序列,即植物次生产物糖基转移酶信号序列(PSPG box),表明Ml3GT1具备植物糖基转移酶特征,可能参与次生代谢产物的糖基化修饰。Ml3GT1的PSPG基序为WAPQTMVLGHVALGAFV THCGWNSVMESITAGVPMICRPFFGDQ,已有的研究表明,糖供体特异性部分由PSPG盒中的最后氨基酸残基确定,当为Q时使用葡萄糖作为糖供体,当为H时则使用半乳糖(Kubo et al., 2004),Ml3GT1的PSPG基序最后一个残基为Q,表明Ml3GT可能属于UDP-类黄酮糖基转移酶,使用UDP-葡萄糖作为糖供体。

黑色阴影和其他阴影框分别表示相同和相似的氨基酸,下划线表示PSPG保守基序。Black shaded and other shaded boxes show identical and similar amino acids, respectively, and the underline indicates the PSPG conservative motif.图 4 推导的Ml3GT1氨基酸序列与其他物种3GT氨基酸序列比对Fig. 4 Multiple alignment of deduced Ml3GT1 amino acid sequences and 3GT amino acid sequences from other plants
2.2 Ml3GT1基因的生物信息学分析
通过ProtParam在线软件分析Ml3GT1氨基酸的理化性质,结果表明:Ml3GT1编码457个氨基酸,分子式为CHNOS,相对分子质量为49.37 kDa,理论等电点(pI)为6.04,小于7,说明其为酸性蛋白;其中带负电荷氨基酸残基(Asp + Glu)数为50,带正电荷氨基酸残基(Arg + Lys)数为45,丙氨酸含量最多,占10.9%, 酪氨酸含量最少, 占0.9%; 该蛋白不稳定系数为40.71,不稳定系数大于40,表明其为不稳定蛋白;总平均亲水性的负值表示亲水性,正值表示疏水性,且正值越大表示疏水性越强,Ml3GT1总平均亲水性为0.090,说明该蛋白是疏水性蛋白。
通过SOPMA在线网站对紫玉兰‘红元宝’3GT1蛋白的二级结构预测 (图5), 结构表明Ml3GT1蛋白中α-螺旋(39.39%)和无规则卷曲(38.29%)含量最多,而延伸链和β-转角含量分别为16.85%和5.47%。将Ml3GT1序列提交到SWISS-MODEL在线网站预测编码蛋白质的三维结构,3D预测结果显示(图6),QMEAN分值在-4~0之间,越接近于0,表明待测蛋白与模板蛋白的匹配度越好,可信度越高,Ml3GT1的QMEAN分值为-0.88,表明Ml3GT1与模板蛋白UDP-葡萄糖类黄酮3-O糖基转移酶(2c1x.1.A )匹配度较好,相似性较高,达52.67%,推测其可能为类黄酮3-O糖基转移酶;GMQE可信度评分为0.83,介于0~1之间,且较接近1,说明以上述蛋白模板构建的模型质量较好;Ml3GT1具备GT-B家族典型的Rossmann折叠结构域,表明其为GT-B家族成员,这也与CDD的预测结果一致。

蓝线. α-螺旋; 紫线. 无规则卷曲; 红线. 延伸链; 绿线. β-转角。Blue line. α-helix; Purple line. Random coil; Red line. Extended strand; Green line. β-turn.图 5 Ml3GT1蛋白二级结构预测结果Fig. 5 Results of Ml3GT1 protein secondary structure prediction
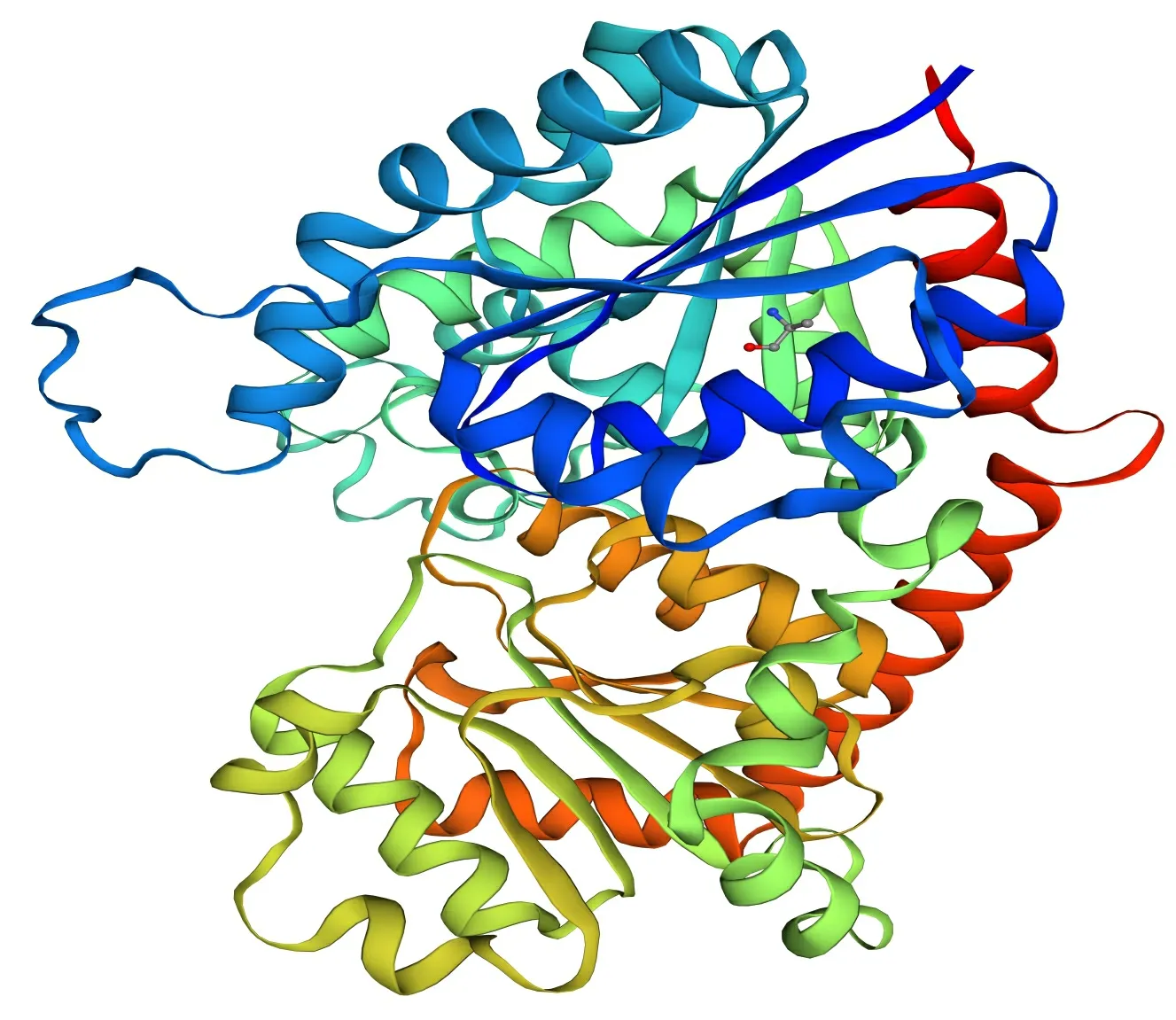
图 6 Ml3GT1蛋白三级结构预测结果Fig. 6 Results of Ml3GT1 protein tertiary structure prediction
2.3 Ml3GT1氨基酸序列系统发育分析
将紫玉兰‘红元宝’Ml3GT1与其他植物中已报道的参与类黄酮途径的糖基转移酶共同构建系统发育进化树,图7结果显示,GTs分为5GTs、7GTs、3GTs进化分支,Ml3GT1与小苍兰Fh3GT1亲缘关系较近聚为一支,属于3GTs进化大支,该分支还有葡萄Vv3GT、草莓Fa3GT、矮牵牛Ph3GT、番薯Ib3GT,且与其他类黄酮糖基转移酶5GTs、7GTs的亲缘关系较远,表明其可能与Fh3GT1功能类似,属于3GT糖基转移酶家族成员,参与类黄酮3-O的糖基化。

图 7 Ml3GT1蛋白与其他植物的GT蛋白的系统进化树Fig. 7 Molecular phylogenetic tree of Ml3GT1 protein and GT proteins from other plants
2.4 Ml3GT1基因在花开放的不同时期与不同组织中的表达分析
以紫玉兰‘红元宝’花开放不同时期(S1~S5)以及老叶、嫩叶、根、茎等组织部位的cDNA为模板,探究31基因在紫玉兰‘红元宝’中的表达模式(图8)。结果表明,随着花的开放进程,31基因的表达量呈现先降低后升高的趋势,其表达量在盛花期(S5)达到峰值。各组织部位的荧光定量结果显示,31基因具有组织特异性,在花中的表达量最高,在老叶和嫩叶中有少量表达,而在根和茎中几乎不表达,且其在花朵开放的各个时期中的表达量均高于其他组织部位。

图 8 Ml3GT1在紫玉兰‘红元宝’花开放的不同时期以及组织部位的表达分析Fig. 8 Expression analysis of Ml3GT1 in different flowering periods and tissue parts of Magnolia liliflora ‘Hongyuanbao’
3 讨论与结论
本文克隆得到紫玉兰‘红元宝’31基因,生物信息分析发现Ml3GT1序列具有植物次生产物糖基转移酶信号序列——PSPG box,推测其可能参与次生代谢产物的糖基化修饰。GTs根据其催化位点的不同,可分为3-O-糖基转移酶(3GTs)、5-O-糖基转移酶(5GTs)、7-O-糖基转移酶(7GTs)(王应丽等,2014)。系统发育树聚类结果显示Ml3GT1和小苍兰Fh3GT1亲缘关系较近,聚为一支,进一步表明其可能和Fh3GT1功能类似,具有参与类黄酮3-O的糖基化修饰的功能(Sun et al., 2016)。
有研究结果表明,3具有花器官组织特异表达模式(王毅等,2017)。滇牡丹(王毅等,2017)和葡萄风信子(杜灵娟等,2017)中3基因在花青素苷大量积累的组织中高表达,而在少量积累和无花青素苷的组织中,3表达量极低甚至不表达。与前人研究结果一致,在本研究中,31基因在花中大量表达, 而在其他营养器官组织中几乎不表达或者表达量很低,表明31可能参与花青素苷的生物合成。
3参与小苍兰和葡萄风信子花瓣中花青素苷的生物合成, 其表达量往往与花瓣中花青素苷的积累呈正相关(Sui et al., 2011;梁沛雯等,2019)。但是31基因表达模式与小苍兰和葡萄风信子不同,其表达量随着花的开放呈现先下降后上升的趋势,这可能与不同植物花瓣中花青素苷的糖苷类型不同有关。葡萄风信子花瓣中花青素苷糖苷类型均为葡萄糖苷(梁沛雯等,2019),因此葡萄风信子花青素苷的积累与3基因表达量紧密相关。在紫玉兰‘红元宝’花瓣中,4种花青素苷C3位均发生芸香糖基化修饰,其中Pn3Ru含量最高(约占总花青素苷含量的71%)(Wang et al., 2019)。由于花青素的C3位芸香糖苷化修饰依次由3GT和3RT催化完成(Yamazaki et al., 2002),紫玉兰‘红元宝’芸香糖苷型花青素苷的合成不仅受3基因的调控,同时还与3基因的表达有关。由此表明31参与调控紫玉兰‘红元宝’的花青素苷的生物合成,但是该基因不是紫玉兰‘红元宝’花青素苷生物合成的限速酶基因。
