草地早熟禾光敏色素作用因子基因PpPIFs的鉴定与表达分析
2022-09-06王雨藤赵婷刘怡璇张凌馨牛奎举
王雨藤,赵婷,刘怡璇,张凌馨,牛奎举
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中⁃美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
随着全球气温上升,世界范围内的干旱区面积不断扩大,同时,工农业用水需求增加、可利用水资源污染加剧,使得可用于草坪灌溉的水资源短缺问题日益严重[1-2]。因此,干旱胁迫已成为影响草坪草生长、降低草坪质量的重要因素,限制着草坪的推广与应用。干旱胁迫下,草坪草的形态结构和生理过程均会受到影响。在漫长的进化过程中,植物自身形成了一套复杂的调控网络来应答干旱胁迫,该过程涉及多个基因、信号传导与代谢通路[1-3]。随着现代分子生物学和生物信息学技术的发展,草坪草响应干旱胁迫的机理研究已从最初的植物形态结构、细胞生理代谢适应逐渐发展到转录水平、翻译水平及大分子物质网络互作调控等分子机制[4]。转录组学分析发现,吲哚-3-甘油磷酸合成酶、蛋白磷酸酶、已糖激酶、钙结合蛋白、叶绿素a/b 结合蛋白等基因可作为草地早熟禾(Poa pratensis)响应逆境胁迫的候选基因[5];脂氧化物、脯氨酸生物合成、以及钙信号等与生命进程相关的基因在匍匐翦股颖(Agrostis stolonifera)响应干旱胁迫过程中发挥着重要的作用[6]。近年来,已通过转录组学鉴定了草坪草响应干旱胁迫的候选基因,但有关这些基因在干旱应答中的功能及抗旱草坪草新品种培育中的应用有待进一步的研究。
光敏色素互作因子(phytochrome⁃interacting fac⁃tors,PIFs)属于bHLH(basic helix-loop-helix)转录因子家族,能直接与光敏色素相互作用[7-8]。拟南芥(Arabidopsis thaliana)中 共 发 现 了8 个PIFs 成 员(PIF1-PIF8)。所有PIFs 蛋白的N-端还具有一个保守的APB 结构域(Active phyB-binding domain),它能与光敏色素B(Phytochrome B,PhyB)特异性互作。另外,在PIF1与PIF3中还发现了一个类似APB的 结构域-APA 结构域(Active phyA-binding do⁃main),它能够与光敏色素A(Phytochrome A,PhyA)特异性互作[8-9]。经同源比对分析,在单子叶植物水稻(Oryza sativa)和玉米(Zea mays)基因组均鉴定出了6 个PIFs[10-11]。现已证明PIFs 可参与ABA、GA、BRs、茉莉酸(Jasmonic acid,JA)、生长素(Auxin)、乙烯(Ethylene)等多种植物激素的生物合成和信号途径,从而协同调控植物的生长发育[12-13]。PIFs 在植物抗逆性的调控中也发挥着至关重要的作用。在低温条件下,拟南芥PIF3的突变体表现出明显的抗冻性,而PIF3过表达植株表现出明显的低温敏感表型[14]。低温能够促使EBF1 和EBF2 蛋白降解,从而使PIF3蛋白更加稳定。同时,PIF3能够直接结合在CBFs 的启动子区,抑制CBFs 及其下游低温响应基因表达[14]。
PIFs 作为不同激素信号途径的集结者,在植物生长发育和抗逆性调控中起着至关重要的作用。但在非模式作物,尤其是在草坪草上报道较少。草地早熟禾是世界上广泛应用的草坪草,本课题组前期研究发现PIF1和PIF3基因可能是5⁃ALA 介导草地早熟禾干旱应答的重要转录调控因子。因此,本研究以草地早熟禾转录组数据库为基础,通过生物信息学手段鉴定了4 个草地早熟禾PpPIFs基因,并对他们在干旱胁迫下不同组织部位的表达进行了分析,旨在挖掘草地早熟禾优异的基因资源,为草坪草生物育种奠定基础。
1 材料和方法
1.1 草地早熟禾幼苗培养及干旱胁迫处理
采用砂培法种植草地早熟禾品种巴润,种子由北京克劳沃公司提供。前期将洗干净的沙子灭菌后置于育苗钵中,种子撒于表面,在生长室中培养,培养条件为:白天/黑夜时间为14 h/10 h,温度为25 ℃/15 ℃,湿度为55%,光照强度为6 000 lx。播种后20 d,用霍格兰德营养液培养,持续培养4 周。选择长势相似的幼苗进行处理,分为对照组和处理组,其中对照组继续浇霍格兰德营养液培养,处理组在霍格兰德营养液中溶入20% PEG6000 溶液后浇灌培养植株,模拟干旱胁迫。于胁迫后0、2、8、24、48、96 h 取样,取其叶片迅速放入液氮中冷冻,保存于-80 ℃。不同组织样品的采集选用生长了3 个月的草地早熟禾植株,此时已有根茎芽、分蘖芽的产生,取植株的叶片、根系、根茎芽、分蘖枝和分蘖节,迅速放入液氮中冷冻,保存于-80 ℃冰箱。
1.2 PpPIFs转录因子家族基因鉴定及序列分析
以6 个水稻OsPILs 和8 个拟南芥AtPIFs 蛋白序列作为鉴定草地早熟禾PpPIFs基因的请求序列,本课题组的所有转录组数据作为本地数据库,利用bioedit软件中的tblastn 功能在本地数据库中进行检索,经过NCBI 网站搜索比对,得到候选序列。在线网站Ex⁃PASy 预 测PpPIFs的 等 电 点 及 分 子 质 量,PSORT 预测PpPIFs的亚细胞定位,通过MEME 网站(http://meme-suite. org/tools/meme)对PpPIFs的保守结构域进行分析。利用MEGA 7.0 软件,构建拟南芥、水稻和草地早熟禾的系统进化树。
1.3 荧光定量PCR(qRT - PCR)
RNA 提取使用天根公司植物RNA 提取试剂盒,RNA 反转录使用Takara 公司的Prime Script RT re⁃agent Kit with gDNA Eraser(Perfect Real Time)试 剂盒,第1 步去除基因组DNA 反应,第2 步为反转录合成cDNA,反转录产物稀释20 倍作为模板。使用NCBI 在线网站Prime⁃BLAST(https://www. ncbi.nlm. nih. gov/tools/primer⁃blast/)进行引物设计(表1)。利用擎科生物的荧光定量试剂盒2×TSINGKE Master qPCR Mix(SYBR Green I)进 行qRT⁃PCR 分析,20 μL 反应体系如下:模板5 μL,引物2 μL(10 μM上游引物和下游引物各1 μL),ddH2O 3 μL,2×Super⁃Real PreMix Plus 10 μL。荧光定量PCR 的条件为:95 ℃预变性1 min,40 个循环的PCR 扩增,包括95 ℃变性10 s,58 ℃退火30 s。内参基因选择本实验筛选出的干旱胁迫下草地早熟禾叶片内表达稳定的PpACT[15],每个样品设3 次生物学重复,基因的相对表达量使用2-ΔΔCT法计算。
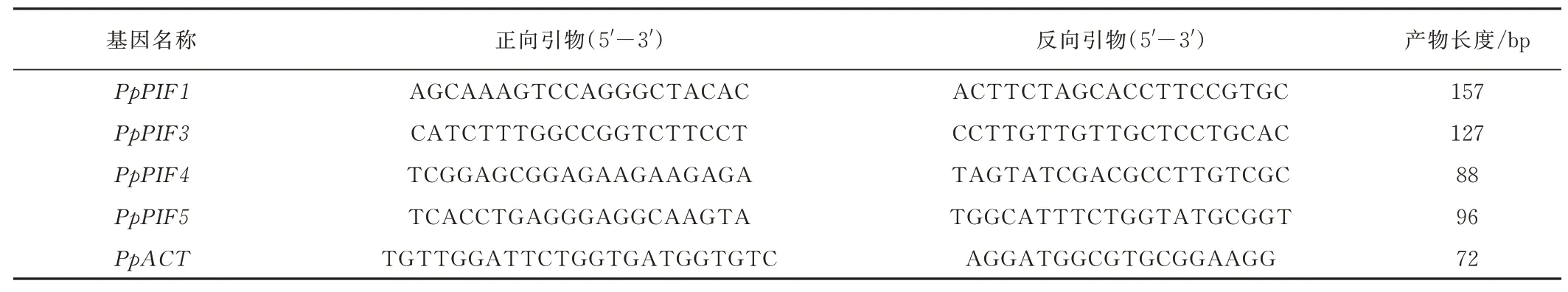
表1 定量PCR 引物Table 1 Primers used for qRT-PCR
1.4 数据分析
利用SPSS 23.0 软件对数据进行T检验,使用GraphPad 作图。
2 结果与分析
2.1 基于转录组数据库PpPIFs的鉴定
整合本课题组所有早熟禾转录组数据库及其他研究者共享的数据库,以6 个水稻OsPILs 和8 个拟南芥AtPIFs 蛋白序列作为鉴定PpPIFs的请求序列,共从草地早熟禾转录组数据库中鉴定出4 个含完整ORF 序列的PpPIFs,NCBI 数据库中比对后将其分别鉴 定 为PpPIF1、PpPIF3、PpPIF4和PpPIF5(表2)。等电点在4.91~5.01,分子质量在80 563.63~138 668.61,亚细胞定位都在细胞核中。
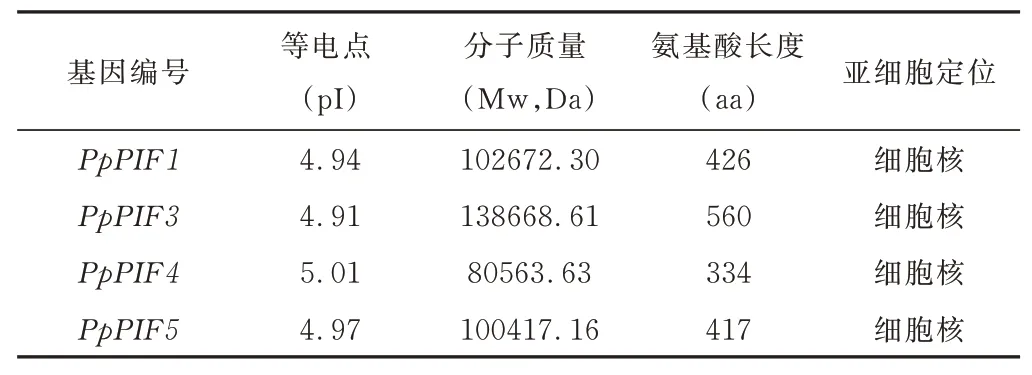
表2 草地早熟禾PpPIFs的基本信息Table 2 Information ofPpPIFsfamily genes inPoa pratensis
2.2 PpPIFs序列分析
为评价草地早熟禾、水稻、玉米及拟南芥中PIFs/PILs 蛋白的系统进化关系,采用邻接法构建PpPIFs、OsPILs、ZmPIFs 和AtPIFs 蛋白序列系统进化树(图1)。草地早熟禾PpPIFs 家族成员可分为3 个亚家族(Clade I、II、III),其中PpPIF3 属于Clade I;PpPIF1 属于Clade II;PpPIF4 和PpPIF5 属 于Clade III。此 外,植物PIFs 家族蛋白表现出极大的多样性,PpPIFs 与单子叶植物水稻OsPILs 和玉米ZmPIFs 具有较高的同源性,而双子叶植物拟南芥AtPIF2、AtPIF3 和At⁃PIF6 独 立于PpPIFs、ZmPIFs 和OsPILs,单独分 布 于Clade IV。
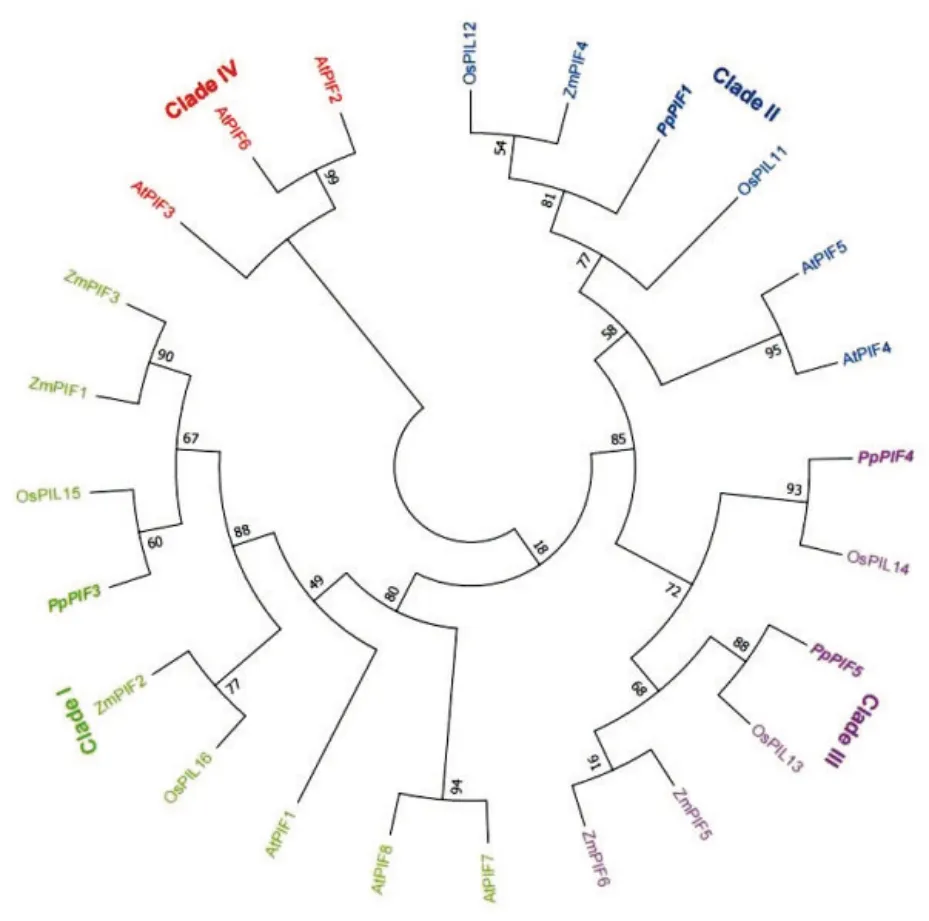
图1 草地早熟禾、水稻、玉米和拟南芥PIFs 蛋白系统进化树Fig.1 Phylogenetic tree of PIF proteins inPoa pratensis,Oryza sativa,Zea mays,Arabidopsis thaliana
用MEME 在线软件分析MaPIF 家族成员保守基序,设置返回motif 参数为5,结果见图2。所有PpPIFs成员中均含有高度保守的motif 1、motif 2、motif3 和motif5。对比发现,motif1 是bHLH 保守结构域,说明这4 个PpPIFs是bHLH 类转录因子家族中的PIF转录因子。此外,PpPIF1 和PpPIF3 中含有代表APA 结构域的motif 4,PpPIF4 和PpPIF5 都有着相同的motif数量和类型。
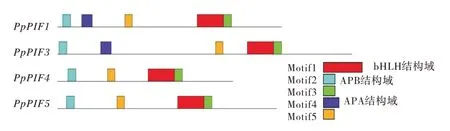
图2 PpPIFs家族蛋白保守基序(motif)分布图Fig.2 Protein motif distribution map ofPpPIFsfamily
2.3 干旱胁迫下PpPIFs的表达分析
采用qRT-PCR 技术对20% PEG6000 模拟干旱处理下草地早熟禾叶片中PpPIFs基因进行表达分析。结果表明,PpPIFs对干旱胁迫的响应均比较快,处理2 h 或8 h 其表达水平均发生显著的上调表达。其中,PpPIF1的表达水平受到干旱胁迫的影响最大,干旱处理8 h 时,其表达水平上调了约12 倍。PpPIF4和Pp⁃PIF5分别只在8 h 和2 h 被显著地诱导表达,而Pp⁃PIF1和PpPIF3在干旱胁迫处理96 h 后仍被显著地上调表达(图3)。
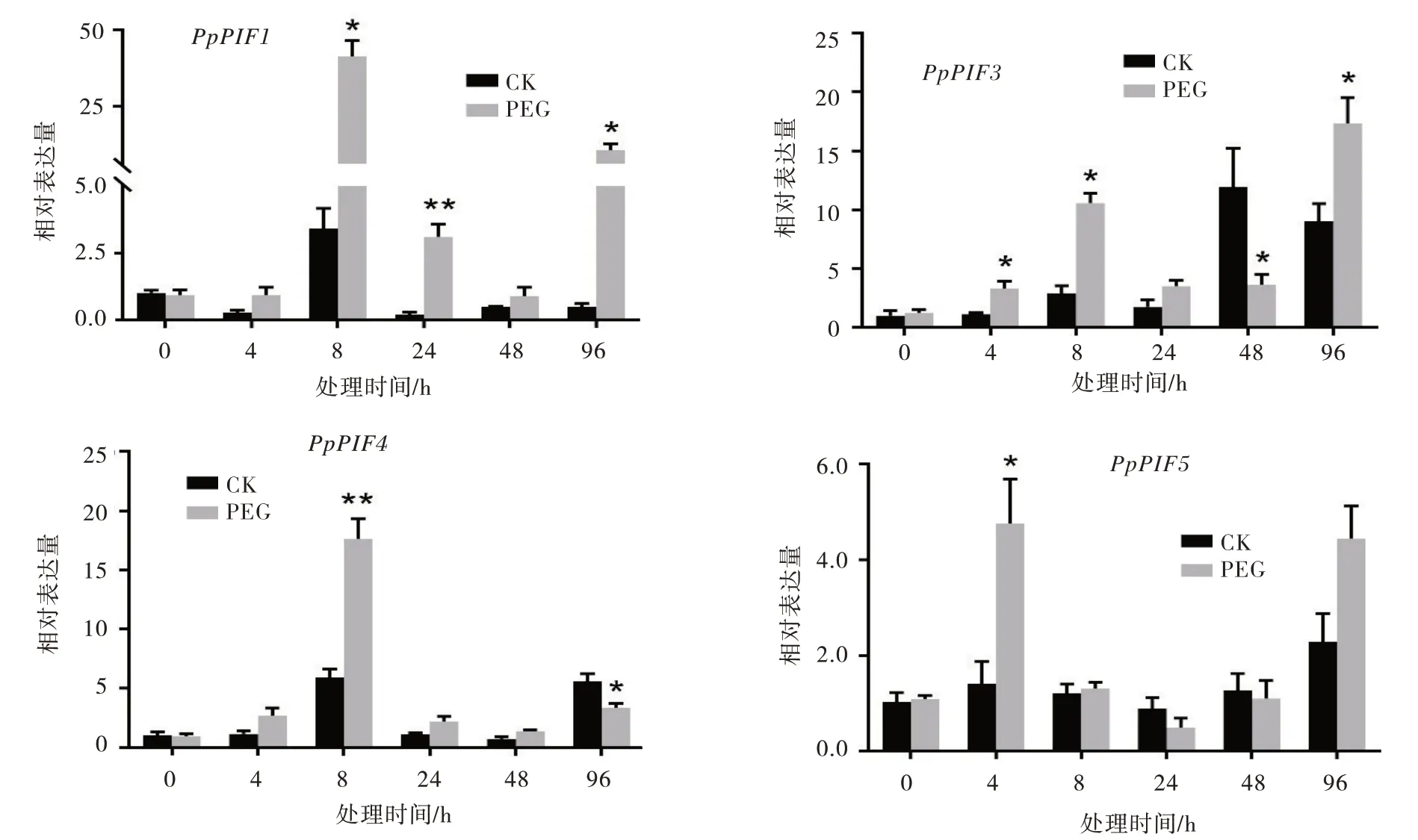
图3 草地早熟禾叶片PpPIFs基因响应干旱胁迫的表达模式分析Fig.3 Expression patterns ofPpPIFgene in the leaves ofPoa pratensisresponding to drought stress
2.4 在不同组织中PpPIFs的表达分析
草地早熟禾不同部位PpPIFs基因相对表达量差 别 较 大,新 分 蘖 枝PpPIF1、PpPIF3和PpPIF4的相对表达均显著高于叶片,其中PpPIF1和PpPIF3表 达 量 分 别 提 高 了17 和8 倍,PpPIF4和PpPIF5在根茎和分蘖节中的相对表达量显著低于叶片。4个基因在根系中的相对表达量均显著低于叶片。与叶片相比,叶鞘PpPIF3和PpPIF5的相对表达量显著提高,而PpPIF1的相对表达量显著降低(图4)。
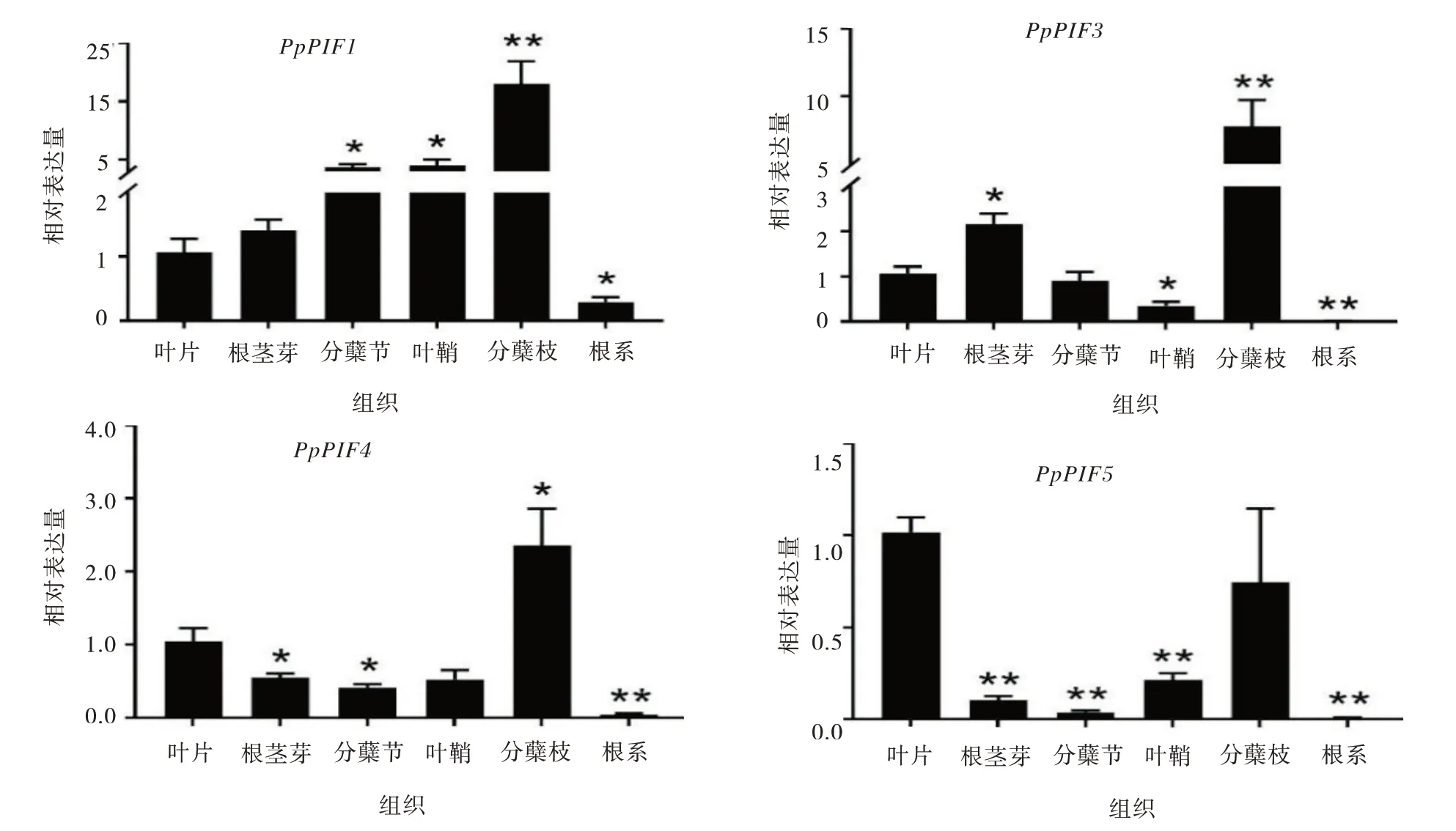
图4 草地早熟禾PpPIFs 基因在不同组织中的表达模式分析Fig.4 Expression patterns ofPpPIFgenes in the different tissues ofPoa pratensis
3 讨论
PIFs 属于b HLH 转录因子家族的一个亚家族,也称作PILs(phytochrome in⁃teracting factor⁃like),能够与具有生物活性型的光敏色素相互作用。研究表明,大部分PIFs 蛋白质在N 端具有保守的APB 结构域,APB 结构域是PIFs 与具有生物活性光敏色素相结合的不可或缺的元件。同时,PIF1 和PIF3 还包含一个单独的结构域APA[8-9]。PIFs 转录因子家族基因广泛存在植物体内,近年来的研究鉴定出了很多农作物及园艺植物中的PIFs 成员,如模式植物拟南芥中有8 个PIFs 成员[8];禾本科植物水稻和玉米中均有6个PIFs 成员[10,16];茄科植物番茄(Lycopersicon esculen⁃tum)中 有8 个PIFs 成 员[17],马 铃 薯(Solanum tu⁃berosum)中 有7 个PIFs 成 员[18];芭 蕉 科 植 物 香 蕉(Musa nana)中有7 个PIFs 成员[19];葫芦藓科植物小立碗藓(Physcomitrella patens)中有4 个PIFs 成员[20]。本研究在草坪植物草地早熟禾中共鉴定出了4 个PIFs成员,其成员数少于禾本植物水稻和玉米,原因可能是由于草地早熟禾全基因数据尚未获得,转录组数据中部分PIFs 成员信息缺失。
草地早熟禾4 个PpPIFs 蛋白序列均具有保守结构域HLH 和APB,说明PpPIFs 家族成员在进化过程中在功能上具有高度保守性,而PpPIF1 和PpPIF3 还具有结构域APA,表明这两个成员在进化功能上更为丰富。这与在其他植物上的研究一致[8,18-19]。从进化树的结果来看,PpPIFs 被大致分为3 个亚家族,其中PpPIF1 和PpPIF1 与 水 稻OsPIL13 和OsPIL14 在 同一族;PpPIF1 与水稻OsPIL11 和拟南芥AtPIF4 在同一族;PpPIF3 与玉米ZmPIF1、ZmPIF3 和拟南芥At⁃PIF1 在同一族。现已证实AtPIF1、AtPIF4、ZmPIF1和ZmPIF3参与调控植物的生长发育和抗逆性[8,21-22],其中AtPIF4能够与多种激素信号转导途径相互作用调控细 胞 的伸长生 长[8,13]。因 此,PpPIF1和PpPIF3可能参与调控草地早熟禾生长发育及抗逆性。
现已证明PIFs 可参与脱落酸(Abscisic acid,ABA)、赤霉素(Gibberellic acid,GA)、油菜素内脂(Brassinosteroids,BRs)和生长素等多种植物激素的生物合成和信号途径,从而协同调控植物的生长发育[23-24]。拟南芥中DELLAs 蛋白GAI 和RGA 能够与PIF3 和PIF4 蛋白互作,从而抑制PIF3 和PIF4 介导的细胞伸长生长[25]。BRs 是植物暗形态建成的促进激素,在黑暗条件下促进下胚轴伸长生长,负调控光形态发生,PIF4 与BRs 信号途径基因BES1/BZR1特异性结合形成异源二聚体,以此激活下游靶基因的表达,促进细胞的伸长[26]。在植物不同组织中的表达说明,PIFs 作为感知光信号的基因,在植物叶片中的表达量较高[18,27]。本研究发现,根系中PpPIFs的表达均显著低于叶片,但值得注意的是,其中PpPIF1、Pp⁃PIF3和PpPIF4在新分蘖枝中的表达显著高于叶片,其中PpPIF1和PpPIF3表达量分别提高了17 和8 倍,说明PpPIF1和PpPIF3可能参与了草地早熟禾分蘖芽的伸长生长过程。目前未有研究直接证明PIFs 可调控禾本科植物分蘖过程,但是,PIFs 可与BRs 信号途径基因BZR1相互作用,而BZR1已被证实可调控水稻分蘖过程[28]。因此,笔者推测PpPIF1和PpPIF3可能会与BZR1相互作用进而调控草地早熟禾的分蘖过程,但其功能需要进一步的研究来证实。
PIFs 在植物抗逆性的调控中也发挥着至关重要的作用。低温能够促使EBF1和EBF2蛋白降解,从而使PIF3蛋白更加稳定。同时,PIF3能够直接结合在CBFs 的启动子区,抑制CBFs 及其下游低温响应基因 表 达[29]。 此 外,拟 南 芥 中 转 录 激 活 子HMR(HEMERA)可直接与PIF4相互作用,激活热响应生长相关基因YUC8、IAA19和IAA29,促进温度依赖型PIF4积累[30]。除对温度胁迫有响应外,PIFs 还参与植物对干旱、盐害等胁迫的应答过程。在干旱和高盐处理下,异源表达玉米ZmPIF3的转基因水稻植株生长状况较野生型更好,具有较高的光合效率和细胞膜稳定性[21],异源表达ZmPIF1可通过调控气孔关闭来提高抗旱性,增加转基因水稻的产量[22]。本研究发现,在干旱胁迫下,草地早熟禾PpPIFs均有不同程度的响应,但PpPIF1和PpPIF3在干旱胁迫处理96 h 后仍被显著地上调表达,说明PpPIF1和PpPIF3也可能参与了草地早熟禾干旱胁迫应答调控。
4 结论
在草地早熟禾转录组数据库中共鉴定出4 个Pp⁃PIFs基因,分属于3 个不同的亚家族,但均具有保守结构域HLH 和APB,其中PpPIF1和PpPIF3还具有结构域APA。此外,PpPIF1和PpPIF3在分蘖枝中表达量较高,且在干旱胁迫后的叶片中被显著上调表达,因此,PpPIF1和PpPIF3可能参与草地早熟禾分蘖芽的伸长生长和干旱胁迫应答调控。
