去泛素化酶JOSD2促进肝癌细胞的存活和转移
2022-09-06韩祯祯刘禹辰
韩祯祯, 刘禹辰, 王 建*
(1)安徽医科大学基础医学院生物化学与分子生物学教研室, 合肥 230032;2)军事医学研究院生命组学研究所, 北京 102206)
肝癌是全世界癌症相关死亡的主要原因之一,近几十年,许多国家的肝癌发病率呈增加态势。据2020年世界卫生组织统计,2020年全球肝癌新发病例是全部癌症的第7位,死亡病例占第4位[1]。我国是肝癌的高发国家,肝癌的发病率占全国癌症的第5位,且中国男性肝癌的新发病例约占全球总数的1/2,肝癌的死亡率占我国癌症死亡率的第2位。因此,肝癌致病机制的研究和治疗新技术的开发对于降低肝癌患者的死亡率至关重要。原发性肝癌主要分为肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)和HCC-ICC混合型3种不同病理学类型,其中肝细胞癌是最常见的原发性肝癌,约占总体肝癌病人的85%~90%,是肝癌诊断比例最高,死亡人数最多的类型。2018年中国肝癌新发病例和死亡病例几乎占全球1/2,70%的患者在确诊时已经处于中晚期。因此,肝癌是人民健康的重大风险因素,迫切需要研究其发病机制和开发新的诊治技术。
去泛素化酶(deubiquitinase, DUB)通过去除泛素修饰来调控许多细胞蛋白质的稳定性、相互作用或定位[2]。迄今为止,发现的去泛素化酶主要包括7个家族:泛素特异性蛋白酶(ubiquitin-specific proteases, USPs),卵巢肿瘤相关蛋白酶(ovarian tumor proteases, OTUs),泛素羧基末端水解酶(ubiquitin C-terminal hydrolases, UCHs),含有Machado-Josephin结构域蛋白酶(MJDs),MINDY(MIU-containing novel DUB)蛋白酶家族,ZUP1(zinc finger containing ubiquitin peptidase 1)蛋白酶家族和锌依赖的JAB1/MPN/MOV34蛋白酶家族 (JAMMs,也称为MPN+)[3]。其中,MJD家族作为去泛素化酶家族中最小的家族,含有4个蛋白质,分别为Ataxin-3 (ATXN3)、Ataxin-3 样蛋白质 (ATXN3L)、Josephin-1 (JOSD1)和Josephin-2 (JOSD2)[4, 5]。JOSD2作为MJD家族中只含有Josephin结构域的蛋白质,已经被证实在非小细胞肺癌中作为促癌因子,通过葡萄糖的分解代谢来调控癌症的发生[6]。另有研究报道,JOSD2作为促癌分子能通过调控YAP(yes-associated protein)/TAZ(transcriptional co-activator with PDZ-binding motif)来调控胆管癌的发生[7]。但目前它在肝细胞癌中的作用尚不明确,本文在TCGA-LIHC(TCGA-liver hepatocellular carcinoma)RNA-seq的生物信息分析中发现,JOSD2是该DUB家族唯一在肝细胞癌肿瘤样本表达量显著高于癌旁(P<0.0001),且与总生存期显著相关的基因(P<0.05),细胞学结果显示,过表达JOSD2能促进肝细胞癌细胞的存活、迁移和侵袭(P<0.01)。本研究提示,JOSD2可能作为促癌因子调控肝细胞癌。
1 材料与方法
1.1 材料
人肝癌细胞系HepG2和MHCC-97H细胞系由本实验室传代培养;大肠杆菌感受态细胞DH5α、质粒pCMV-Myc由本实验室保存,引物由北京六合华大基因科技有限公司合成,限制性核酸内切酶EcoR I、XhoI、NotI和T4 DNA连接酶(New England Biolabs),HRP标记Myc标签抗体(Sigma),2×PCR预混液(Molecular Cloning Laboratories),DMEM培养基(北京沃比森科技有限公司),血清(Biological Industries),转染试剂PEI(Polyscisences)、质粒提取试剂盒、凝胶回收试剂盒(Promega)、Cell Counting Kit-8(Dojindo)、Transwell小室(FALCON)。
1.2 肝细胞癌数据来源及肝细胞癌预后相关去泛素化酶筛选
利用工具Kaplan-Meier Plotter(http://kmplot.com/)TCGA-LIHC mRNA的RNA-seq数据对去泛素化酶进行分析[8],计算总生存期(overall survival,OS;样本数n=364)和无复发生存期(recurrence-free survival, RFS;样本数n=316),得到去泛素化酶表达量与病人生存的相关性的P值(log rankP)和风险率(hazard ratio),卡值设定标准为Kaplan-Meier Plotter自动最佳卡值(auto select best cutoff)。本文进一步从TCGA下载LIHC RNA-seq FPKM数据集,共计377例病人的样本和对应的临床信息。计算对应去泛素化酶在肿瘤和癌旁样本的FPKM(fragments per kilobase million)表达量差异。OS或RFS风险率大于1且FPKM表达显著上调(倍数变化1.5倍,P<0.05)为筛选标准,共筛选得到与肝细胞癌预后相关的去泛素化酶17个。为了进一步确定JOSD2在肝细胞癌病例生存分析中的结果,本文使用了感染乙肝中国肝癌病人数据集(Chinese HCC patients with HBV infection, CHCC-HBV)中包含159例样本的临床和转录组数据,对JOSD2进行了生存分析,临床信息及表达数据见附表(supplementary table S1)。OS、RFS曲线由Kaplan-Meier Plotter网页工具绘制。
1.3 去泛素化酶JOSD2在不同组织及肿瘤样本中的表达分析
根据HPA(Human Protein Atlas, https://www.proteinatlas.org/)数据库给出的表达谱数据[9],查询JOSD2,获得均一化的人体各组织的mRNA表达水平数据。根据1.2中下载的TCGA RNA-seq FPKM数据,对应样本的临床信息,将样本按照美国癌症联合委员会(the American Joint Committee on Cancer, AJCC)癌症分期系统分别得到其在肿瘤不同分期、有无远处转移、区域淋巴结类型中的表达量,并计算统计学差异,统计方法为Student’st检验。为确定TCGA数据库得出的结论具有普遍性,本文通过2个有完整临床信息(包括AJCC分期)的GEO(Gene Expression Omnibus)数据,对JOSD2在肿瘤和癌旁中的表达量进行了进一步分析。GSE76427是包含115个肝细胞癌肿瘤样本和52个癌旁样本的RNA表达芯片数据,使用数据提供的RNA表达芯片数据经过RSN均一化后的表达量进行分析;GSE36376是包含240个肝细胞癌肿瘤样本和193个癌旁样本的RNA表达芯片数据,使用数据提供的RNA表达芯片数据经过分位数均一化后的表达量进行分析。箱线图由R包ggplot2绘制。
1.4 JOSD2表达差异病人的差异基因筛选
根据Kaplan-Meier Plotter对去泛素化酶的自动最佳卡值(FPKM=10,高表达样本224例,低表达样本140例),将TCGA下载的RNA-seq样本数据分为高表达和低表达组,筛选差异基因。将RNA-seq数据以转录本为单位进行差异分析,统计方法为双样本异方差双尾t检验,之后采用Benjamini & Hochberg(False Discovery Rate, FDR)假设检验矫正,取FPKM倍数变化2倍以上,FDR<0.05为卡值标准,通过R语言包ggplot2绘制火山图。基因转录本通过基因ID转换为基因名进行GO和通路富集分析。GO和通路富集分析使用R包Clusterprofiler,分别获得上调和下调基因的显著富集条目和通路,再通过选择适当的条目绘制条形图,生物学过程按假设检验校正后的P<0.05选取富集条目,KEGG通路按P<0.05选取富集通路,差异基因列表和富集条目总列表见附表(supplementary Table S2-4),条形图由R语言包ggplot2绘制。
1.5 细胞培养和细胞转染
人肝癌细胞系HepG2和MHCC-97H接种到六孔板培养,待密度长到70%~80% 进行转染。转染方法:取灭菌的1.5 mL离心管,加入150 μL 双无培养基,再加入1.5 μg pCMV-Myc-JOSD2质粒,最后再加入7.5 μL PEI转染试剂(质粒:转染试剂:双无培养基=1∶5∶100),吹打混匀,室温静置20 min。将离心管中的混合液体加入到六孔板中,轻轻混匀后放入37 ℃,5% 的CO2培养箱中继续培养。6 h后换液,24~48 h后进行Western 印迹鉴定表达。
1.6 蛋白质免疫印迹分析
将细胞裂解提取的蛋白质加入等体积的上样缓冲液,沸水中煮10 min使蛋白质变性。取10 μL 样品进行SDS-PAGE电泳,电转移至硝酸纤维素膜上,电转完成后在5% 的脱脂奶粉封闭液中室温封闭1~2 h。封闭后先用1×TBST(Tris buffered saline solution with Tween 20)溶液洗去膜上的封闭液,用稀释好的一抗孵育液4 ℃ 孵育过夜,一抗结束后,用1×TBST洗膜,一共3次,每次10 min。再进行二抗孵育,将硝酸纤维素膜放在按一定比例稀释好的二抗孵育液中40 min,结束后用1×TBST洗膜,一共3次,每次10 min。显色,将显色底物A和B等体积混合,加在膜上4 min,放入成像仪显影。
1.7 细胞存活检测
将pCMV-Myc-JOSD2和pCMV-Myc空载体转染到HepG2和MHCC-97H细胞,孵育18~24 h弃去培养基将细胞进行常规消化、离心、重悬和细胞计数。HepG2细胞按照每孔2 500个细胞(100 μL/孔)、MHCC-97H细胞按照每孔3 500个细胞(100 μL/孔)并做3个复孔,置于37 ℃,5% 的CO2培养箱中培养。待细胞贴壁后向每孔中加入10 μL CCK8(Cell Counting Kit-8)溶液,分别检测0、24、48、72、96 h的细胞存活情况。
1.8 细胞迁移实验
将pCMV-Myc-JOSD2和pCMV-Myc空载体转染HepG2细胞和MHCC-97H细胞,18~24 h后弃去培养基并将细胞进行常规消化和离心,用无血清培养基进行重悬,并进行细胞计数。HepG2细胞密度调整至6×104/mL,MHCC-97H细胞密度调整至1×105/mL,计数后取所需的细胞数目,然后用无血清培养基补至200 μL。取200 μL细胞悬液加入到细胞迁移实验用Transwell小室,24孔板下室加入600 μL 含有20% 血清的DMEM(Dulbecco’s Modified Eagle Medium)培养基,放入37 ℃,5% CO2培养箱中培养24 h。取出Transwell小室,用棉签擦去小室上层未迁移的细胞,并用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,放在甲醇溶液中固定20 min。再用0.1% 结晶紫染色20 min,结束后用流水冲洗和晾干,在显微镜下随机选9个视野,进行计数分析。
1.9 细胞侵袭实验
将pCMV-Myc-JOSD2和pCMV-Myc空载体转染HepG2细胞和MHCC-97H细胞,18~24 h后弃去培养基并将细胞进行常规消化和离心,用无血清培养基进行重悬,并进行细胞计数。HepG2细胞密度调整至7×104/mL,MHCC-97H细胞密度调整至1×105/mL,计数后取所需的细胞数目,再用无血清培养基补至200 μL,取200 μL细胞悬液加入到细胞侵袭实验用Transwell小室,24孔板下室加入600 μL含有20% 血清的DMEM培养基,放入37 ℃,5% CO2培养箱中培养48 h。取出Transwell小室,用棉签擦去小室上层未迁移的细胞,并用PBS冲洗3次,放在甲醇溶液中固定20 min。再用0.1%结晶紫染色20 min,结束后用流水冲洗和晾干,在显微镜下随机选9个视野,进行计数分析。
1.10 统计学方法
其他功能实验采用Graphpad Prism 8软件进行统计学分析,使用Student’st检验,P<0.05为有统计学意义。
2 结果
2.1 去泛素化酶JOSD2与肝细胞癌风险相关
本文分析了63种去泛素化酶在肝细胞癌中的总生存期和无病生存期与肿瘤预后的关系。同时分析了相应去泛素化酶在肿瘤组织与癌旁组织的基因表达量差异,最终发现,其中17个去泛素化酶在肿瘤组织中显著高表达(Table 1,倍数变化大于1.5倍,P<0.05),且与无病生存期或总生存期显著相关(log rankP<0.05,HR>1)。发现MJD去泛素化酶家族中,只有JOSD2在肝细胞癌组织中比癌旁高表达(P=2.92E-27),并且与病人总生存期显著相关(P<0.05)。本文进一步对JOSD2在组织中的分布进行了分析,根据HPA的人转录组数据(Table 2)发现,JOSD2在HPA检测的所有组织中均有分布,属于组成型表达,但在脑、肌肉和肝组织中表达丰度最高,提示其可能在肝中发挥重要功能。通过进一步查询HPA数据库中提供的17种肿瘤组织中JOSD2的mRNA表达水平,结果显示(Table 3),JOSD2在各种肿瘤组织中均表达,未见肿瘤特异性,此结果与JOSD2在正常组织中组成型表达是一致的。在肝细胞癌中JOSD2的表达水平属于中等,未见明显高于其他肿瘤组织。
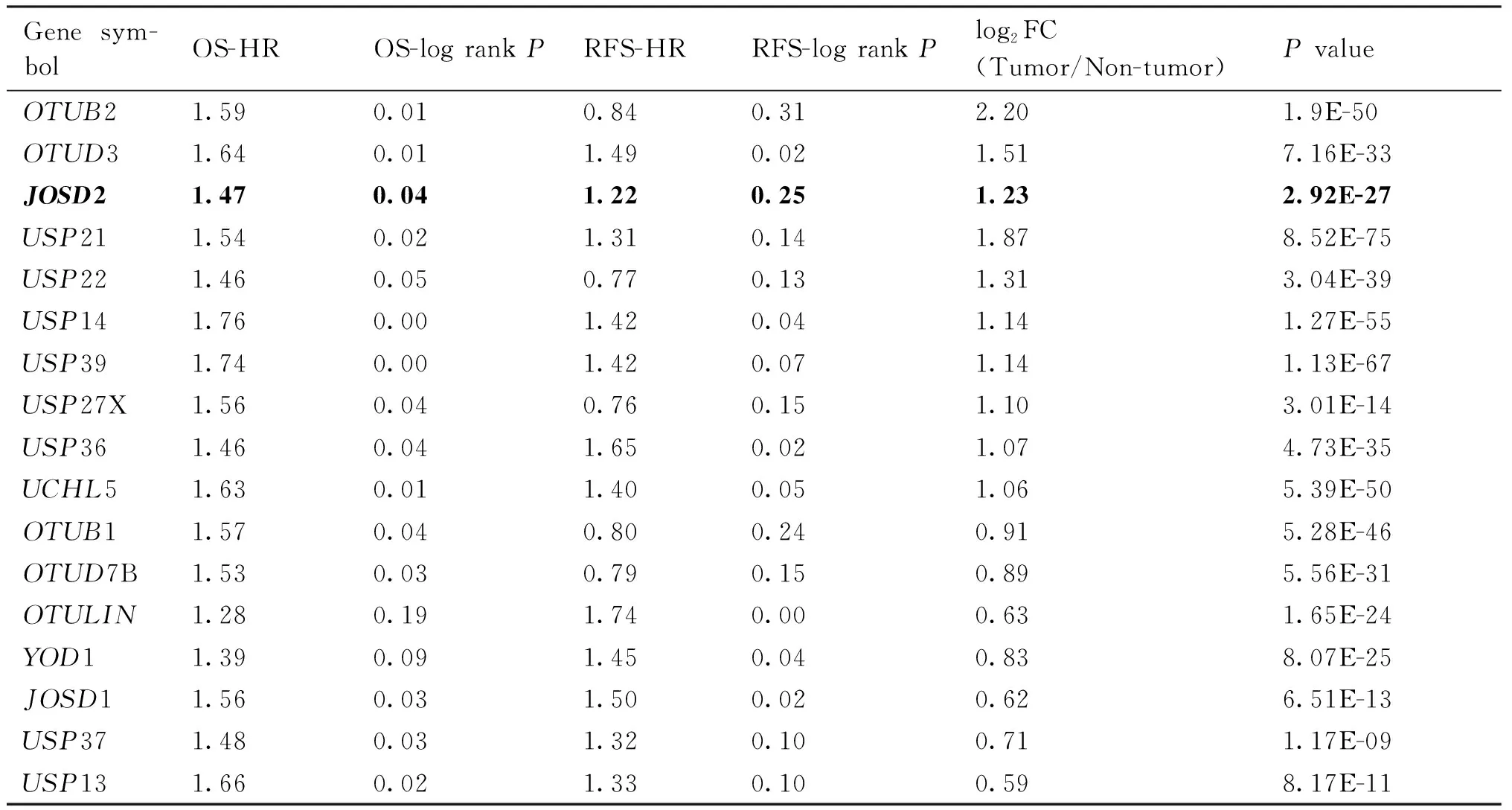
Table 1 List of 17 deubiquitinases associated with the prognosis of hepatocellular carcinoma
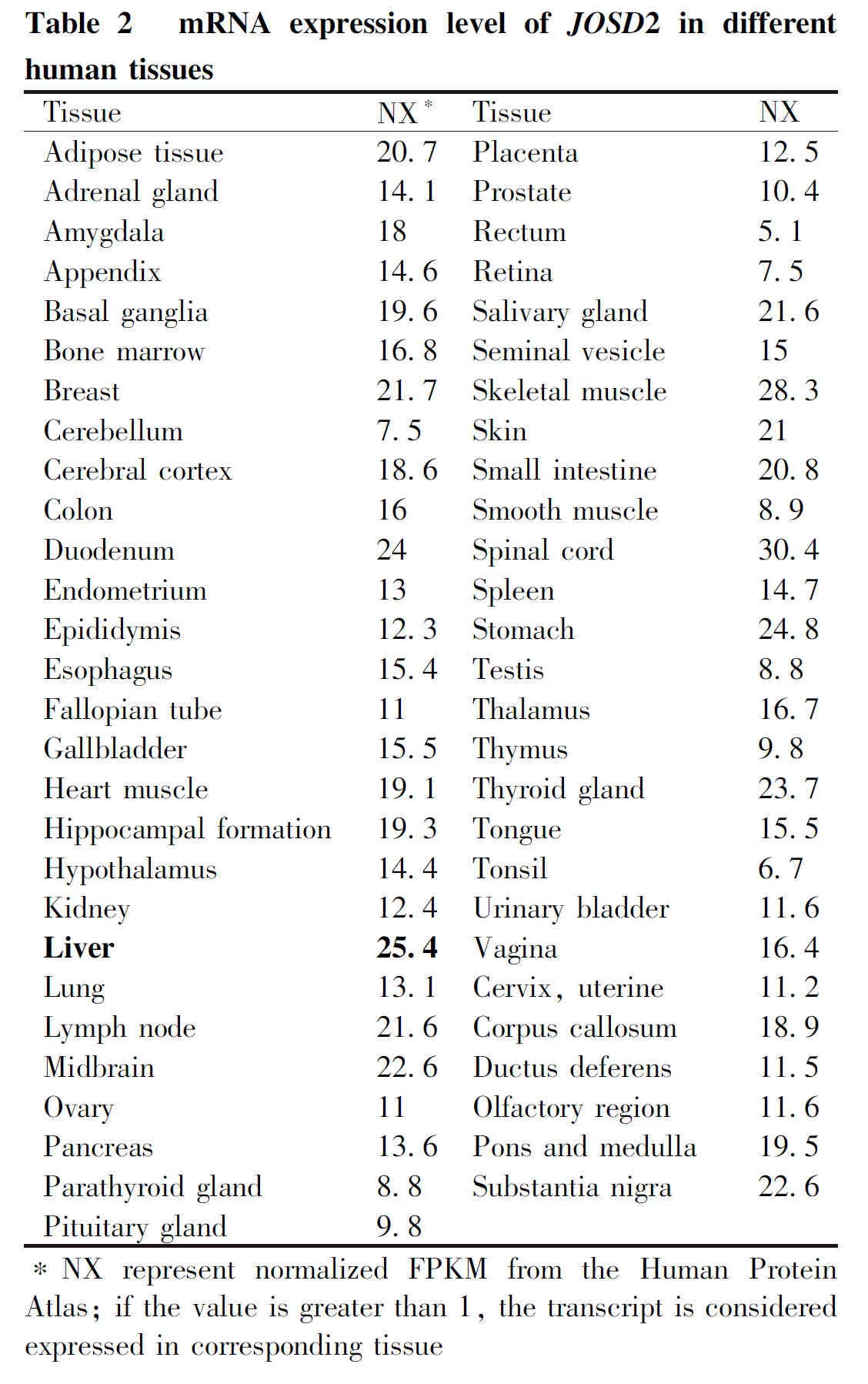
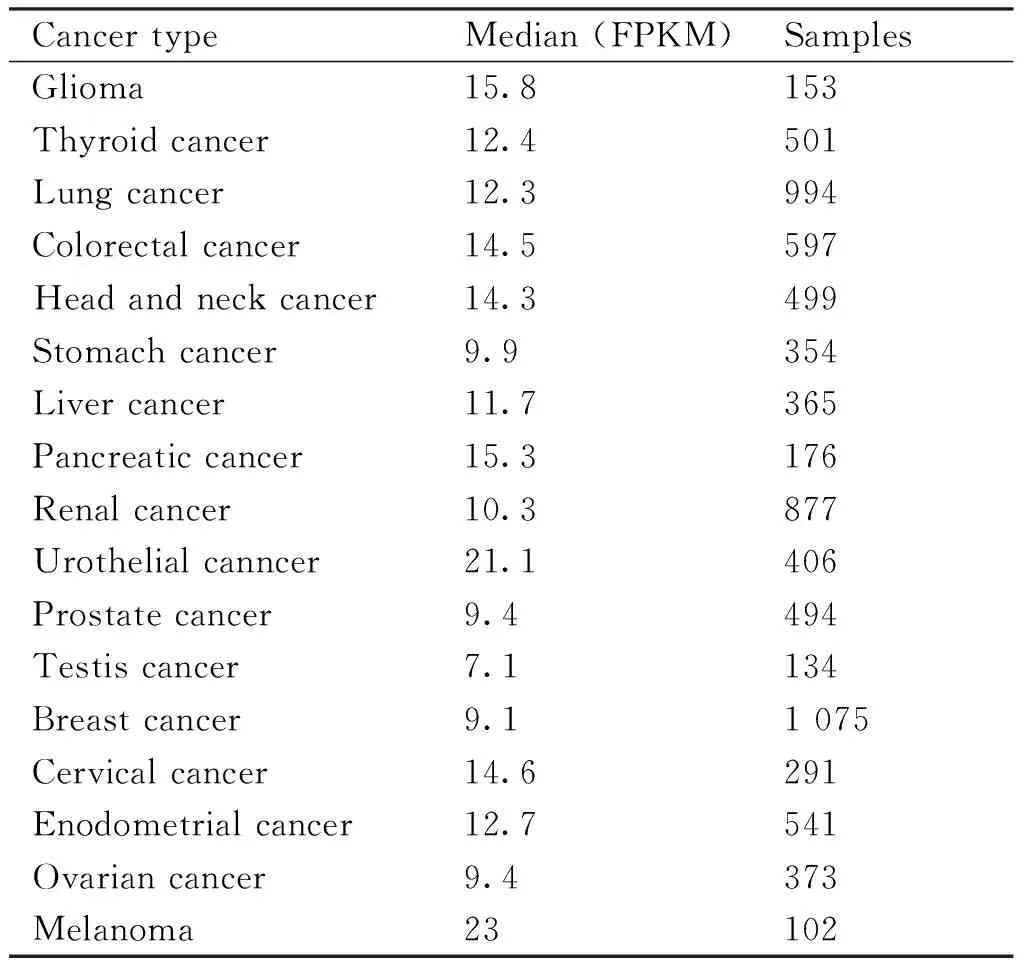
Table 3 TCGA mRNA expression level of JOSD2 in different human tumors
通过TCGA中下载的364例肝细胞癌样本的mRNA-seq数据分析发现,JOSD2的表达量在癌组织中显著高于癌旁(P<0.0001, Fig.1A)。进一步对肝细胞癌样本分析发现,根据AJCC癌症TNM分期,在不同癌症分期中,JOSD2的表达量随肝细胞癌往晚期发展而未见显著性变化(Fig.1B),为了排除肿瘤癌旁表达量差异对统计检验的干扰,本文单独分析肿瘤和癌旁组织中的JOSD2表达量,发现该基因表达量同样无显著差异(Fig.1C, D)。尽管TCGA-LIHC数据中,JOSD2在肿瘤中的表达量显著高于癌旁,但是其表达量不随肿瘤发展阶段的进展而升高,为了确认这种现象的普遍性,本文选择了GEO数据库中2组具有完整临床信息的肝细胞癌RNA表达芯片的数据GSE76427(114例肿瘤,52例癌旁样本)和GSE36376(240例肿瘤,193例癌旁样本)进行了分析。结果显示,2组肝细胞癌数据中JOSD2在肿瘤中的表达量均显著高于癌旁(P<0.0001, Fig.1E和1G),而在不同AJCC分期中JOSD2表达量无显著差异(Fig.1F和1H)。
肝细胞癌分期通过肿瘤(tumor, T)、淋巴结(node, N)和转移(metastasis, M)三个指标共同评估,进一步分析了JOSD2在不同肿瘤分型中淋巴结和转移样本中的表达量。在远端转移分类中,M0为无远端转移,M1为有远端转移,MX为无法评估,JOSD2的表达量在三类转移样本中表达量均无差异(Fig.1I)。在淋巴结受累程度评估中,N0为无区域淋巴结,N1为少数淋巴结受累,NX为情况无法评估。JOSD2的表达量在不同类型区域淋巴结样本中表达量均无差异(Fig.1J)。这些结果显示,JOSD2表达量不随肝细胞癌的发展阶段的进程而增加,并且其对肿瘤转移的影响与表达量无相关性。

Fig.1 Bioinformatics analysis of TCGA-LIHC, GEO and CHCC-HBV datasets (A) The difference of JOSD2 expression between tumor and non-tumor tissue in TCGA-LIHC data,****P<0.0001. (B) The difference of JOSD2 expression between different stages of cancer in all TCGA-LIHC sample. ns, no significance. (C) The difference of JOSD2 expression between different stages of cancer in TCGA-LIHC tumor sample. ns, no significance. (D) The difference of JOSD2 expression between different stage of cancer in TCGA-LIHC non-tumor sample. ns, no significance. (E) The difference of JOSD2 expression between tumor and non-tumor tissue in GSE76427 sample,****P<0.0001. (F) The difference of JOSD2 expression between different stages of cancer in all GSE76427 sample. ns, no significance. (G) The difference of JOSD2 expression between tumor and non-tumor tissue in GSE36376 sample.****P<0.0001. (H) The difference of JOSD2 expression between different stages of cancer in all GSE36376 sample. ns, no significance. (I) The difference of JOSD2 expression of between different levels of distant metastases. ns, no significance. (J) The difference of JOSD2 expression between various nearby (regional) lymph nodes. ns, no significance. (K) Overall survival analysis of JOSD2 in TCGA-LIHC mRNA-seq data. (L) Recurrence-free survival analysis of JOSD2 in TCGA-LIHC mRNA-seq data. (M) Overall survival analysis of JOSD2 in CHCC-HBV mRNA-seq data. (N) Recurrence-free survival analysis of JOSD2 in CHCC-HBV mRNA-seq data
HPA对JOSD2的病理注释为肝癌的不良预后基因。通过对TCGA数据进行了Kaplan-Meier生存分析,结果显示,JOSD2的高表达是与总生存期显著相关(P<0.05)的风险因素(HR>1, Fig.1K,n=364)。但是其高表达与无复发生存期无显著关系(Fig.1L,n=316)。这些结果显示,JOSD2的高表达可能是肝细胞癌中总生存期显著降低的风险因素。乙肝病毒相关肝细胞癌是我国肝细胞癌的主要类型,而TCGA数据中与乙肝病毒相关肝癌的病例极少。CHCC-HBV数据是乙肝相关肝细胞癌研究,有完善和业内普遍认可的临床和转录组数据,因此,本文使用该数据集对JOSD2在乙肝相关肝细胞癌做了生存分析。结果表明,在总生存期(Fig.1M,n=159)和无复发生存期(Fig.1N,n=159)JOSD2的高表达同样是风险因素,但统计学上不显著。针对不同来源的肝细胞癌转录组数据,JOSD2的高表达整体与预后呈不良趋势,但是其统计学不显著可能是由于不同样本中具有较大异质性导致的。
2.2 JOSD2高表达病人的差异基因功能分析
根据Kaplan-Meier Plotter分析给出的最佳卡值(FPKM=10),将所有364例病人样本分为高表达和低表达组,其中高表达组224例,低表达组140例。从TCGA数据库下载FPKM矩阵,对高表达、低表达样本组,进行差异分析,统计方法采用双样本异方差双尾t检验(Welcht.test),进行多重假设检验矫正。差异基因的选取标准为倍数变化2倍以上,FDR<0.05。分析结果得到上调转录本1 338个(代表非冗余基因889个),下调转录本197个(代表非冗余基因103个)(Fig.2)。对差异基因进行KEGG通路富集分析显示,上调蛋白质中主要富集有Wnt、Hippo、ECM(extracellular matrix)等通路(Fig.3A);下调蛋白质中主要富集有细胞色素P450、类固醇激素生物合成和PPAR(peroxisome proliferator-activated receptor)等通路。GO(gene ontology)生物学过程功能富集分析,发现上调蛋白质则显著富集与肿瘤发生相关的Wnt、G蛋白偶联受体、BMP(bone morphogenetic proteins)通路等;下调蛋白质的生物过程显著富集类固醇、胆固醇和激素等相关条目(Fig.3B)。根据GO和通路富集分析,JOSD2过表达上调的Wnt、Hippo、BMP等通路均与细胞增殖有关,提示JOSD2可能影响细胞增殖和分化,从而进一步影响肿瘤的转移(Fig.3)。
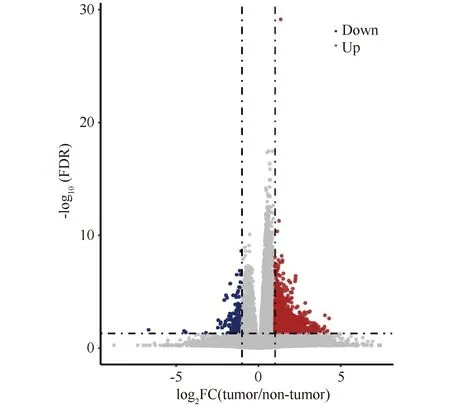
Fig.2 Differential expression gene analysis between samples with JOSD2 high and low expression Welch t test P value was corrected by Benjamini & Hochberg multiple hypothesis test and FDR<0.05 was considered as differentially expressed genes with statistical significance. Red dots represent significantly up-regulated genes with a log2 fold change greater that one, while blue dots represent significantly down-regulated genes with a log2 fold change greater that one
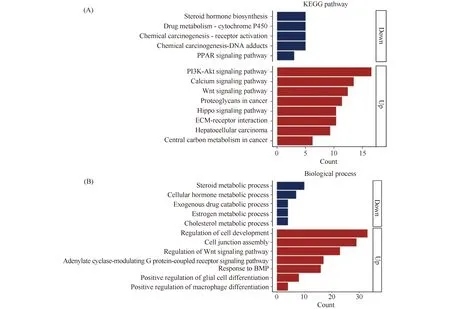
Fig.3 KEGG pathway and gene ontology enrichment analysis of differential expression genes (A) Significantly enriched KEGG pathways of differential expression genes, P<0.05. (B) Significantly enriched biological process terms of differential expression genes, q value (FDR)<0.05
2.3 JOSD2促进HepG2细胞的存活、迁移和侵袭
根据前述的分析结果提示,JOSD2可能影响肝细胞癌的转移,为了验证此推测,本文在肝癌细胞系HepG2细胞中过表达JOSD2,采用pCMV-Myc空载体作为对照。通过Western 印迹结果表明转染和表达JOSD2成功(Fig.4A)。随后进行了细胞存活、迁移和侵袭能力的分析。细胞存活结果显示,与对照组相比,过表达JOSD2能提高细胞存活能力(*P<0. 05,**P< 0.01, Fig.4B)。细胞迁移和侵袭结果显示,过表达JOSD2能促进细胞的迁移和侵袭能力(***P<0.001,****P<0.0001, Fig.4C-D)。
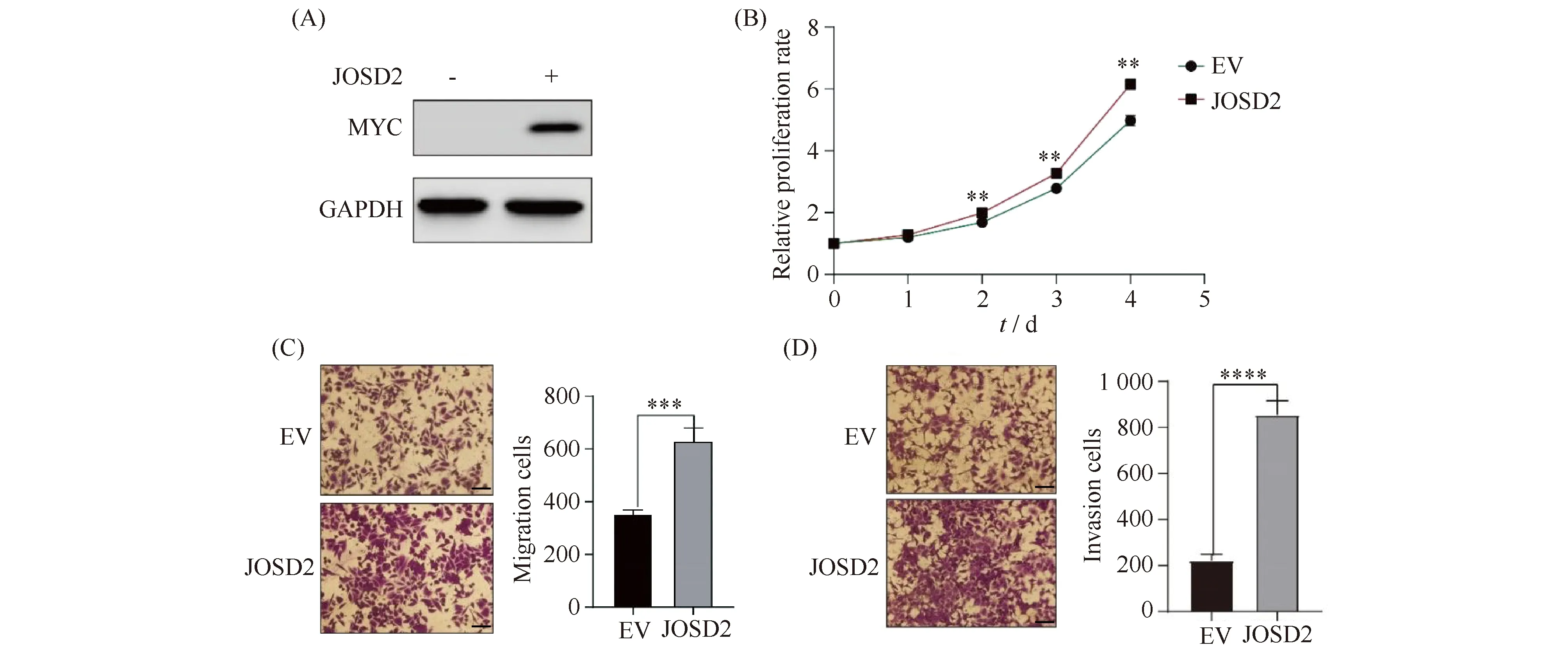
Fig.4 Effects of JOSD2 on HepG2 cell proliferation, migration and invasion (A) Overexpression of JOSD2 protein was detected using Western blotting. GAPDH was used as an internal control. (B) CCK8 assay was performed to detect the survival ability of HepG2 cells after transfection of Myc-JOSD2.*P<0.05,**P<0.01. (C) Transwell migration assay was used to detect the migration ability of HepG2 cells after transfection of Myc-JOSD2 (left). Statistical analysis of migration ability of HepG2 cells after transfection of Myc-JOSD2 (right).***P<0.001. Scale bars, 20 μm. (D) Transwell invasion assay was used to detect the invasion ability of HepG2 cells after transfection of Myc-JOSD2 (left). Statistical analysis of HepG2 cell invasion ability after Myc-JOSD2 transfection (right).****P<0.0001. Scale bars, 20 μm
2.4 JOSD2促进MHCC-97H细胞的存活、迁移和侵袭
由于HepG2细胞为肝母细胞癌细胞,为了进一步确定JOSD2在肝细胞癌中的作用,将pCMV-Myc-JOSD2和pCMV-Myc空载体转入肝细胞癌细胞系MHCC-97H细胞中,Western 印迹结果表明转染和表达成功(Fig.5A)。随后进行了细胞存活、迁移和侵袭能力的分析。细胞存活结果显示,与对照组相比,过表达JOSD2能明显的提高细胞的存活能力(**P< 0.01, Fig.5B)。细胞迁移和侵袭结果显示,过表达JOSD2能明显的促进细胞的迁移和侵袭能力(****P<0.0001, Fig.5C-D)。
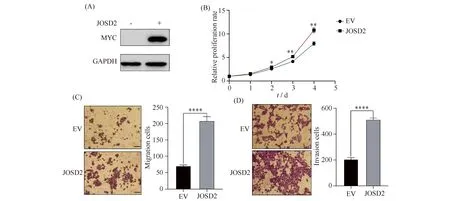
Fig.5 Effects of JOSD2 on MHCC-97H cell proliferation, migration and invasion (A) Overexpression of JOSD2 protein was detected using Western blotting. GAPDH was used as an internal control. (B) CCK8 assay was performed to detect the survival ability of MHCC-97H cells after Myc-JOSD2 transfection.**P<0.01. (C) Transwell migration assay was used to detect the migration ability of MHCC-97H cells after Myc-JOSD2 transfection (left). Statistical analysis of migration ability of MHCC-97H cells after Myc-JOSD2 transfection (right).****P<0.0001. Scale bars, 20 μm. (D) Transwell invasion assay was used to detect the invasion ability of MHCC-97H cells after Myc-JOSD2 transfection (left). Statistical analysis of invasion ability of MHCC-97H cells after Myc-JOSD2 transfection (right). ****P<0.0001. Scale bars, 20 μm
3 讨论
去泛素化酶(DUB)是泛素-蛋白酶体系统的重要组分,能够维持体内功能蛋白质的稳态,在调控细胞周期、表观遗传修饰和信号转导过程中发挥重要作用[10, 11]。JOSD2作为去泛素化酶MJD家族中的一员,它定位于19号染色体,并且只含有MJD家族共有的Josephin结构域,可以直接移除蛋白质的泛素链[12]。目前JOSD2的研究较少。有研究表明,JOSD2去泛素化并稳定了包括醛缩酶 A、磷酸果糖激酶-1 和磷酸甘油酸脱氢酶在内的葡萄糖代谢酶复合物,提高它们的活性和糖酵解速率,与非小细胞肺癌的肿瘤表达谱和不良预后相关[6]。另外,JOSD2通过去泛素酶活性依赖性方式切割多聚泛素链来维持蛋白质的水平,JOSD2的消耗会促进YAP/TAZ转录调控分子通过蛋白酶体进行降解,从而阻碍胆管癌细胞的增殖[7]。同时,JOSD2能调控PHGDH(phosphoglycerate dehydrogenase)蛋白质水平从而调控肺腺癌的发生[13]。本文首次发现JOSD2在肝细胞癌中可能发挥促癌作用。
首先,本文对63种去泛素化酶与肝细胞癌生存期和预后的关系,以及对在肝肿瘤和癌旁表达量的关系进行分析,发现17个去泛素化酶在肿瘤组织中高表达,其中包括与肺癌密切相关的OUT家族中的OTUB2[14](OTU deubiquitinase, ubiquitin aldehyde binding 2)和OTUD3[15, 16](OTU deubiquitinase 3),与肝细胞癌密切相关的USP家族中的USP27[17, 18](ubiquitin-specific peptidase 27)和USP22[19, 20](ubiquitin specific peptidase 22)等,本文发现,MJD家族中只有JOSD2在肝细胞癌组织中比癌旁高表达,并且与病人总生存期显著相关。对JOSD2在正常和癌症组织中进行分析,发现无论正常组织还是癌症样本中,其分布无显著特异性,但是在肝中表达的排名较高;进一步对TCGA-LIHC肝细胞癌数据分析发现,JOSD2在肿瘤中的表达量显著高于癌旁,但是其mRNA水平并不随着肿瘤发展阶段的变化而变化,在不同分期的肝肿瘤的转移和区域淋巴结样本中也无显著性变化,该结果也与两组不同来源的芯片数据分析结果一致;最后对TCGA-LIHC和CHCC-HBV的生存分析,JOSD2仍然与肿瘤不良预后相关,但是在不同来源病人样本中具有异质性。这些结果提示,该蛋白质与肿瘤进展的关系更多的是可能通过转录水平之外的蛋白质水平、蛋白质翻译后修饰或调控肝细胞癌相关蛋白质的丰度来实现。JOSD2高表达的TCGA-LIHC病人样本中,转录水平上调基因的功能和通路富集分析显示Wnt、Hippo、BMP等通路显著富集(P<0.05),提示JOSD2可能通过这些通路分子发挥调控作用,但是具体的分子和细胞学生物学机制有待进一步研究。随后,在肝癌细胞系中通过细胞存活、迁移和侵袭的结果表明,表达JOSD2可以明显的促进肝细胞癌细胞的生长。这些结果初步证明,JOSD2在肝细胞癌中可能发挥促癌因子的作用。
综上所述,本文发现JOSD2在肝细胞癌组织中高表达,并且与肿瘤病人总生存期相关。但JOSD2调控肝细胞癌的具体作用机制、可能调控的靶基因以及信号通路仍有待进一步阐明。