羰基硫催化水解反应机理及动力学研究
2022-09-05袁辉志周兰慧刘爱华刘剑利刘增让徐翠翠
袁辉志,周兰慧,刘爱华,刘剑利,刘增让,徐翠翠
(1.中国石化齐鲁分公司研究院,山东 淄博 255400;2.中国石油大学(华东)重质油国家重点实验室)
《天然气》(GB 17820—2018)[1]质量标准要求:一类天然气的总硫质量浓度(以硫元素计)不大于20 mg/m3、H2S质量浓度(以硫元素计)不大于6 mg/m3。根据国内天然气净化厂统计分析结果可知,凡是原料天然气的H2S或总硫含量高,产品天然气的总硫含量都较高。
为了使天然气产品的质量满足国家标准GB 17820—2018要求,净化厂常用有机硫水解工艺脱除天然气中的硫,即在催化剂的作用下将天然气中的羰基硫(COS)转化为H2S,然后用胺液吸收脱除天然气中的H2S。COS的物化性质相对稳定,其酸性、极性及化学活性均低于H2S,因此COS比H2S更难脱除[2]。COS水解的核心在于水解催化剂的性能,开发和使用高性能COS水解催化剂不但有利于天然气高效脱硫,而且有利于提高总硫回收率,在满足环保法规要求的同时提高经济效益。
根据载体不同,COS 水解催化剂主要分为两大类:一类是以活性炭为代表的非金属氧化物载体,另一类是以氧化钛和氧化铝为代表的金属氧化物载体[3]。氧化钛基催化剂虽然反应活性高,但生产成本也高,限制了其应用[4];而氧化铝基催化剂具有初期活性好、压碎强度高、成本低、硫磺回收率高等优点,因而得到广泛应用[5]。氧化铝基催化剂的型号主要有DD-431,Maxcel727,LS-02,LS-05等[6]。其中,LS-05具有颗粒均匀、活性高、稳定性好的优点。
LS-05催化剂是一种性能良好的COS水解催化剂,但人们对其催化COS水解反应的机理和反应动力学尚不明确。因此,本课题通过考察COS和H2S在LS-05催化剂上的常温吸附、程序升温脱附过程,以及COS在该催化剂上的水解反应过程,分析COS催化水解反应机理和反应动力学,建立反应动力学回归模型,以指导优化COS催化水解反应的效果,提升天然气净化装置的生产效率。
1 实 验
1.1 试剂与原料
LS-05催化剂(40~60目),比表面积约为353.0 m2/g,孔体积为0.43 mL/g,平均孔径为4.61 nm,中国石化齐鲁分公司研究院产品;COS原料气,COS摩尔分数0.1%,平衡气为N2,大连光明特种气体有限公司产品;H2S气体,H2S摩尔分数0.5%,平衡气为N2,大连光明特种气体有限公司产品;N2载气,N2摩尔分数99.999%,烟台得一气体有限公司产品;高纯水,自制。
1.2 试验方法
以LS-05为催化剂,以COS,H2S,H2O,N2为原料气(H2O由N2携带入系统),考察原料气在催化剂表面吸附和转化反应的机理和反应动力学。原料气的流量由美国Brooks 5800E系列质量流量计控制,原料气及尾气组成使用德国耐驰公司生产的QMS403C型四极杆质谱仪进行在线分析。
在催化剂作用下,COS发生水解反应转化为H2S的反应式如式(1)所示[7]。

(1)
研究COS水解的反应动力学,可将该反应视为不可逆反应[7],利用幂函数模型得到该反应的动力学方程。其反应速率的表达式如式(2)所示。
(2)
式中:rCOS为反应物COS的反应速率,mol/(L·h);m为反应物COS的反应级数;n为反应物H2O的反应级数;k0为反应速率常数,mol(1-m-n)/(L(1-m-n)·h);Ea为反应活化能,J/mol;T为反应温度,K;Ci为组分i的浓度,mol/L。
利用软件Matlab R2021a Logistic回归分析处理试验数据,可得到相应的动力学参数。
1.3 试验条件
1.3.1 干燥催化剂上COS和H2S的程序升温脱附(TPD)试验
称取250 mg LS-05催化剂样品,在N2(流量30 mL/min)吹扫下升温至300 ℃并保持20 min,随后降至室温,将N2切换为COS(流量30 mL/min)吸附30 min,吸附结束后用N2(流量30 mL/min)吹扫15 min,然后以10 ℃/min的速率由室温升温至400 ℃脱附,记录COS,CO2,H2S质谱信号强度的变化趋势。
用H2S替代COS,重复上述试验过程,开展H2S在LS-05催化剂上的吸附-脱附试验,记录H2S质谱信号强度的变化趋势。
1.3.2 蒸汽处理催化剂上COS的TPD试验
称取250 mg催化剂样品,在N2(流量30 mL/min)吹扫下升温至300 ℃后,用N2携带体积分数约10%的水蒸气通过催化剂,保持20 min后逐渐降温,降温至100 ℃时关停水蒸气,继续降温至室温后将N2切换为COS(流量30 mL/min)吸附30 min,之后进行程序升温脱附,脱附参数与干燥催化剂上试验过程相同,记录COS,H2S,CO2质谱信号强度的变化趋势。
1.3.3 程序升温表面反应(TPSR)
称取500 mg催化剂样品,用N2(流量30 mL/min)吹扫10 min后,再用N2将H2O携带进入反应系统,同时通入COS原料气。反应条件为:H2O体积分数3%,COS体积分数0.03%,空速3 000 h-1。以5 ℃/min速率由室温升温至400 ℃,记录升温过程中COS,CO2,H2S质谱信号强度的变化趋势。
1.3.4 LS-05催化COS水解动力学考察
反应物和产物在催化剂上的内、外扩散过程会影响其在反应体系内浓度,进而影响反应速率,因而开展动力学研究时需要消除内、外扩散的影响。内扩散主要受催化剂孔径和孔道长度的影响,外扩散过程则主要受气体质量流率的影响。因此,通过调整催化剂颗粒尺寸和反应条件可以消除反应体系内各组分内、外扩散对COS水解反应动力学的影响。
在消除内、外扩散影响的基础上,开展LS-05催化COS水解试验,考察该COS水解反应动力学。试验条件为:常压,反应温度60~160 ℃,催化剂质量20 mg,反应空速大于100 000 h-1,进料中COS体积分数0.03%~0.06%,蒸汽与硫化物的摩尔比50~88。
2 结果与讨论
2.1 干燥催化剂上COS-TPD 试验结果
干燥LS-05催化剂室温下吸附COS过程的质谱信号强度变化如图1所示。

图1 干燥LS-05催化剂上室温吸附COS的质谱信号强度
由图1可以看出:质谱检测结果中除COS外,还能观察到CO2和H2S,说明催化剂经300 ℃干燥处理20 min后仍然存在吸附水或表面羟基,而且这种吸附水或表面羟基在室温下就可以与表面吸附的COS发生反应,生成CO2和H2S。COS吸附过程结束后,随着N2吹扫的进行,其质谱信号强度迅速降低,CO2和H2S的质谱信号强度也随之削弱。
干燥LS-05催化剂上COS-TPD过程的质谱检测结果见图2。由图2可以看出:随着脱附温度升高,质谱中依次检测出COS,CO2,H2S的脱附峰;在温度约为92.8 ℃时,COS的质谱信号强度达到峰值,其强度约为9.0×10-8a.u.;在温度约为102 ℃时,CO2的质谱信号强度达到峰值;随着CO2质谱信号强度增加,H2S质谱信号强度同步增加,并在137 ℃出现峰值。这表明在TPD过程中,表面吸附的COS能够被活化并水解生成CO2和H2S;而且,COS水解生成CO2和H2S的速率随着温度升高而增大。此外,相比于H2S,CO2的质谱信号强度下降较慢,说明催化剂表面存在多种吸附CO2的活性位,不同活性位对CO2的吸附作用强度差异较大,从弱到强都有,而吸附作用强的CO2较难脱附,导致脱附延迟。

图2 干燥LS-05催化剂上COS-TPD过程的质谱信号强度
2.2 干燥催化剂上H2S-TPD试验结果
干燥LS-05催化剂室温下吸附H2S过程的质谱信号强度变化如图3所示。由图3可以看出,在LS-05催化剂吸附H2S的过程中,H2S的质谱信号强度呈现缓慢升高的趋势。这说明LS-05催化剂表面对H2S有吸附。随着H2S吸附过程结束,H2S质谱检测信号迅速减弱。

图3 干燥LS-05催化剂室温下吸附H2S过程的质谱信号强度
干燥LS-05催化剂上H2S-TPD过程的质谱检测结果如图4所示。由图4可以看出:随着脱附温度升高,出现显著的H2S脱附宽峰,而且在97.7 ℃和117.7 ℃分别出现两个脱附峰值,H2S脱附峰强度最大达到2.1×10-11a.u.,说明干燥LS-05催化剂上至少存在两种碱性强弱不同的H2S的吸附中心;与高温脱附峰相比,低温脱附峰的峰强度稍大,说明催化剂上较弱碱性的H2S吸附中心数量较多。

图4 干燥LS-05催化剂上H2S-TPD过程的质谱信号强度
2.3 蒸汽处理LS-05催化剂上COS-TPD 试验
蒸汽处理LS-05催化剂室温下吸附COS过程的质谱信号强度变化如图5所示。由图5可以看出,经蒸汽处理后,催化剂吸附COS过程中未吸附COS的质谱信号强度在短时间内迅速升高,最高值为1.1×10-6a.u.,远高于干燥LS-05催化剂室温下吸附COS的最高值(<1.2×10-7a.u.),说明蒸汽处理后催化剂对COS的吸附明显减少。可能是因为催化剂经蒸汽处理后,水蒸气在催化剂孔道中凝结,堵塞了孔道,阻碍了催化剂对COS的吸附,大大降低了催化剂对COS的吸附量。此外,在蒸汽处理LS-05催化剂吸附COS过程中也观察到了CO2和H2S的质谱信号,说明COS与吸附在催化剂表面上的羟基发生水解反应,生成了相应的水解产物。吸附结束后,COS的质谱信号强度迅速减弱,CO2和H2S的响应信号也逐渐减弱。
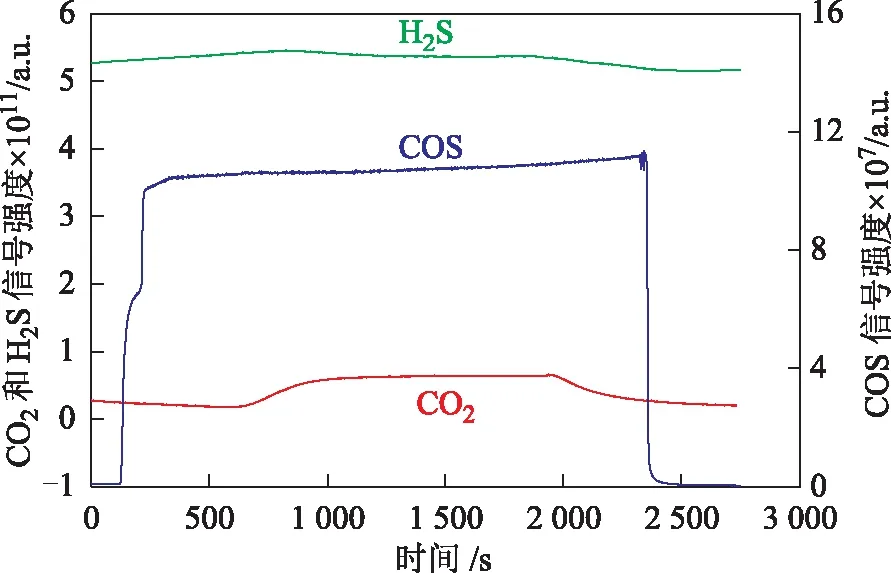
图5 蒸汽处理LS-05催化剂上室温吸附COS的质谱信号强度
蒸汽处理LS-05催化剂上COS-TPD过程的质谱检测结果见图6。由图6可知,随着脱附温度升高,COS的质谱中仅出现一个明显的脱附峰,峰温为84.6 ℃,峰强度约1.35×10-8a.u.,明显低于干燥催化剂上COS的脱附峰强度(9.0×10-8a.u.),同样说明蒸汽处理后催化剂对COS的吸附量明显下降,蒸汽在催化剂孔道中凝结影响了COS的吸附。COS升温脱附过程中并未观察到H2S的质谱信号,说明COS在脱附过程中没有发生水解;但检测到CO2出现高、低温两种脱附峰,其峰强度较干燥催化剂上COS-TPD过程中CO2脱附峰强度大幅降低,推测这部分CO2是在COS吸附过程中COS水解生成并吸附在催化剂碱性中心上的,由于吸附作用较强室温下未脱附,因而在升温脱附过程中释放出来。此外,CO2低温脱附峰面积更大,说明催化剂上吸附CO2的弱碱性中心数量相对较多。

图6 蒸汽处理LS-05催化剂上COS-TPD过程的质谱信号强度
2.4 LS-05催化剂上的COS-TPSR试验
COS在LS-05催化剂上的TPSR曲线如图7所示。由图7(a)可以看出:升温初期,随着反应温度升高,COS的质谱信号强度呈直线下降;当温度升至60 ℃时,COS的质谱信号强度降至初值的7%,意味着COS水解转化率达到93%;当温度达到65 ℃时,COS水解转化率可达98%,说明LS-05催化COS水解的活性很高。由图7(b)可以看出,在升温初期阶段,随着COS快速水解,产物CO2和H2S快速生成,相应地,CO2和H2S的质谱信号强度快速增大,达到最高点后随着二者从催化剂上不断脱附而使其信号强度逐渐降低。

图7 COS 在LS-05催化剂上的TPSR曲线
结合分析上述试验结果,可以推测COS在LS-05催化剂上的水解反应为碱催化反应[8],催化剂上的弱碱性中心为COS发生水解反应的主要催化活性中心,在COS水解反应过程中起到关键催化作用。新鲜LS-05催化剂表面的结构羟基以及吸附的H2O分子在催化剂表面解离产生的羟基均可与吸附的COS发生水解反应,这符合George提出的“协调机理”[9]。由于H2O在催化剂上的吸附比COS的吸附更快[2],因此认为COS的吸附为其水解反应的速率控制步骤。COS在催化剂上发生水解时,吸附态的COS分子中S与H2O分子中的O发生O/S交换,生成吸附态产物CO2和H2S,之后产物CO2和H2S从催化剂表面脱附。其反应过程示意如图8所示。
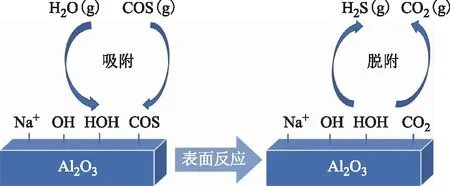
图8 COS催化水解反应机理
2.5 LS-05催化COS水解动力学分析
为了能够拟合出羰基硫水解的反应动力学方程,需要对试验原始数据进行一定的处理,其中H2O和COS的浓度要由动力学试验的反应温度、各组分分压进行换算获得;进而,通过调节试验过程中的反应温度、COS和H2O的浓度,由式(2)计算得到各反应条件下的反应速率,结果见表1。
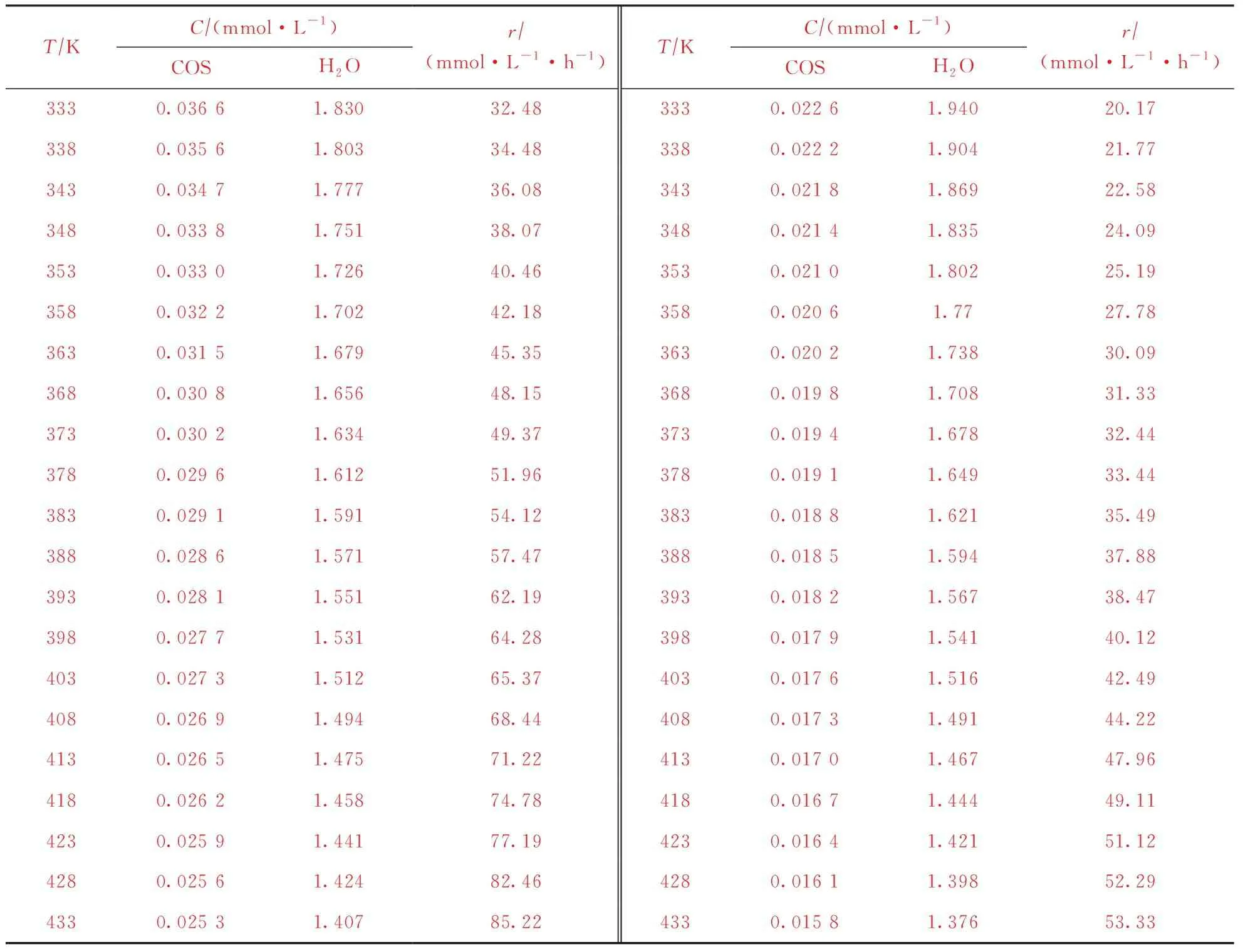
表1 LS-05催化COS水解动力学数据
采用Matlab R2021a Logistic回归分析上述动力学数据,得到相应的LS-05催化COS水解动力学参数,如表2所示。从表2可知,LS-05催化COS水解反应的活化能较低,为15.46 kJ/mol,说明该反应容易进行,LS-05催化剂具有良好的COS水解催化活性。

表2 Logistic回归分析得到的COS水解动力学参数
将表2动力学参数代入式(2),可得LS-05催化COS水解反应的动力学方程,如式(3)所示。

(3)
式(3)中,COS的反应级数m近似为1,H2O的反应级数n近似为0,说明COS水解反应对反应物COS而言为拟一级反应,对反应物H2O而言为近似零级反应,表明LS-05催化剂上COS水解反应速率与COS浓度成正比,而与H2O浓度关系不大。n为负值(-0.137)说明大量水蒸气的存在对COS水解反应有一定的抑制作用,与COS在干燥催化剂、蒸汽处理催化剂上吸附-脱附质谱检测结果一致,可能是因为H2O与COS相比在催化剂上有竞争吸附优势,H2O分压高时其在催化剂表面的吸附量很大,占据了催化剂上的活性吸附位,从而抑制了COS在催化剂表面的吸附,不利于COS的水解反应。由此可见,COS在催化剂上的吸附是其水解的关键,间接说明COS水解反应是一个符合Langmuir-Hinshelwood(L-H)机理的反应过程。
由反应动力学方程回归预测和由试验测定的LS-05催化COS水解反应速率如图9所示,图10为预测值和试验值的拟合结果。由图9和图10可以看出,回归预测值和试验测定值吻合性很好,且所有预测点都落在试验值±10%范围内,Logistic回归分析拟合结果的决定系数R2=0.998。由此可见,回归模型计算结果和试验结果的相关性很高且误差较小,说明COS水解动力学回归模型合理有效。

图9 LS-05催化COS水解反应速率试验值与回归预测值比较

图10 LS-05催化COS水解反应速率预测值与试验值的拟合结果
3 结 论
干燥催化剂上COS-TPD试验结果表明,催化剂表面吸附的COS在常温下就能够被活化并水解生成CO2和H2S;随着温度升高,COS水解速率增大。蒸汽处理后,催化剂对COS的吸附性能大大降低,原因为水蒸气在催化剂孔道中凝结堵塞了孔道,阻碍了催化剂对COS的吸附。
催化剂上存在多种碱性强、弱不同的吸附中心,对酸性CO2和H2S吸附作用强度不同;二者从催化剂上脱附时,随着温度升高,吸附的CO2和H2S随着吸附作用由弱到强逐渐脱附。
COS水解反应为碱催化反应,催化剂上弱碱性中心为水解反应主要催化活性中心。COS水解时,催化剂表面的结构羟基和吸附水在催化剂表面解离产生的羟基均可与吸附的COS发生反应。吸附态COS中S与H2O中O发生O/S交换,生成吸附态产物CO2和H2S。
COS水解反应符合L-H机理,其活化能较低,为15.461 8 kJ/mol,说明该反应易于进行。COS水解反应对COS为拟一级反应,对H2O为近似零级反应,表明COS水解反应速率与COS浓度成正比,与H2O浓度关系不大。H2O的反应级数为接近零的负值(-0.137),说明大量水蒸气的存在对COS水解有一定的抑制作用。
