运动对心肌线粒体生物发生及SIRT3的作用研究进展
2022-09-05丁晓青马春伟高炳宏
丁晓青 马春伟 高炳宏
1 上海体育学院运动科学学院(上海200438)
2 上海体育学院体育教育训练学院(上海200438)
SIRT3是哺乳动物Sirtuin家族的成员之一,是一种依赖于烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)的线粒体蛋白去乙酰化酶[1]。SIRT3 在心脏、大脑、骨骼肌等高能量代谢组织中高表达[2]。研究表明SIRT3 在心肌线粒体生物发生中起着至关重要的作用,SIRT3表达水平的变化显著影响着心肌线粒体生物发生相关因子的蛋白表达[3]。运动不仅能促进心肌线粒体生物发生,还能够激活心肌中SIRT3表达,促进能量代谢[4],然而其中的具体机制尚不清楚。本文通过检索Pubmed、WOS 数据库及中文CNKI期刊全文数据库,检索时间由数据库建库至2022 年1月,检索关键词包括myocardial,mitochondrial biogenesis,SIRT3,exercise 及心肌、线粒体生物发生、运动等,共纳入了79 篇英文文献、3 篇中文文献。本文结合这些文献综述运动对心肌线粒体生物发生及SIRT3 的调控作用及SIRT3 与心肌线粒体生物发生的关系机制,从而为运动促进心肌线粒体生物发生相关研究提供参考。
1 运动对心肌线粒体生物发生的影响
1.1 线粒体生物发生
线粒体生物发生是为满足能量供应而刺激新的线粒体产生,增加细胞线粒体质量和数量的过程[5]。线粒体生物发生包括线粒体基因组和核基因组的转录、脂质和蛋白质的合成以及功能性呼吸链的组装,任何步骤的损伤都可能阻碍该链的形成,影响ATP 的产生[6]。线粒体生物发生的过程受到多种关键因子调控,目前公认的是过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)通过整合诱导核和线粒体编码的基因转录来协调线粒体生物发生[7]。Puigserver 等[8]最早发现PGC-1α在白色脂肪细胞中的异位表达激活了解偶联蛋白-1(uncoupling protein-1,UCP-1)和呼吸链关键线粒体酶的表达,在脂肪细胞中增加了线粒体DNA(mitochondrial DNA,mtDNA)含量。上游腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)通过直接磷酸化两个关键残基苏氨酸-177 和丝氨酸-538,结合并激活肌肉中的PGC-1α[9]。p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)直接磷酸化氨基酸残基262、265 和298,抑制PGC-1α 蛋白降解,增加PGC-1α 半衰期[10]。此外,PGC-1α 是环磷腺苷效应元件结合蛋白(cAMP-response element binding,CREB)的直接靶点[11],而钙/钙调素依赖性蛋白激酶Ⅳ(calcium/calmodulin-dependent protein kinase Ⅳ,CaMKⅣ)能够通过激活CREB进而间接激活PGC-1α[12,13]。PGC-1α进而与下游核呼吸因子1(nuclear respiratory factor 1,NRF-1)的氨基酸180-403 位点结合,并强烈诱导NRF-1/2 的基因表达[14]。NRF-1和NRF-2分别通过TFAM-76/58、TFAM-34/13 的结合位点直接刺激线粒体转录因子A(mitochondrial transcription factor A,TFAM)启动子,参与TFAM 启动子的激活[15]。TFAM 进而启动mtDNA 的转录和复制,增强线粒体生物发生水平[16]。除TFAM 外,PGC-1α-NRF-1/2 通路还上调线粒体转录因子B1 和B2(mitochondrial transcription factors B1/B2,TFB1M/TFB2M),显著增强mtDNA 的转录[17,18]。这些结果支持PGC-1α-NRF-1/2 通路参与线粒体基因转录。因此,PGC-1α通过与其上下游因子相互作用,促进mtDNA复制,增强线粒体生物发生。
1.2 运动促进心肌线粒体生物发生
近些年来的研究主要关注不同的运动形式和强度对心肌线粒体生物发生关键因子PGC-1α及其上下游机制的影响,见表1。年轻和年老的骨骼肌进行急性和慢性的肌肉收缩后PGC-1α启动子活性均增加[19];参加高强度自行车运动的老年男性骨骼肌PGC-1α的蛋白含量甚至比年轻男性更高,说明运动促进线粒体生物发生可以维持到晚年[20]。急性高强度间歇运动可激活骨骼肌p38 MAPK 和AMPK,并在运动后3 h 观察到核PGC-1α蛋白升高,运动24 h 后线粒体蛋白质含量和酶活性增加,PGC-1α的不断累积促使TFAM 与mtDNA结合,促进线粒体生物发生[21]。6 周的渐进负荷跑台训练也可以增加糖尿病大鼠心肌的PGC-1α表达[22]。以上提示短期和长期的运动均激活了线粒体生物发生的信号通路。

表1 运动对心肌线粒体生物发生的影响
中等强度耐力运动可以使骨骼肌和心肌PGC-1α蛋白表达和mtDNA 含量增加,线粒体网络重构增强,线粒体生物发生的信号激活[23-25]。持续的中等强度较高等强度间歇训练更能提高心肌梗死大鼠p38 MAPK和p-AMPK 蛋白表达[26]。中等强度较高强度耐力运动预适应更能上调力竭大鼠心肌PGC-1α/NRFs/TFAM 信号通路,促进线粒体生物发生,从而增加新生线粒体数量,提高线粒体呼吸速率;并且该研究在比较不同的运动强度后得出,中等强度运动预适应对小鼠心脏造成损伤的风险最小,保护效应最佳,低强度耐力运动预适应对小鼠心肌保护效应最差[27]。经过15周中等强度的跑步锻炼后,糖尿病小鼠在晚期阶段心肌细胞凋亡和纤维化好转,诱导PGC-1α-NRF-1-TFB2M/TFAM 信号轴蛋白表达增强[28]。但一年低强度的跑步运动却未能观察到心肌PGC-1α/TFAM 的变化[29]。一项研究表明长时间中低强度跑步运动虽然激活了骨骼肌AMPK和PGC-1α表达,线粒体原代转录物mRNA 和mtDNA含量增加,促进了线粒体的生物发生,但是在左心室除了AMPK 激活,并未观察到其他线粒体生物发生信号的变化[30]。以上研究提示不同的运动周期或运动强度,线粒体生物发生水平不一致,而且不同组织的线粒体生物发生对同一运动方式的应答效果也不一致。未能在心脏中观察到运动激活PGC-1α的一致变化,可能与运动改变PGC-1α表观遗传调节是一个长期过程有关,但确切原因有待进一步明确[31]。从不同运动形式的研究发现,间歇运动和持续耐力运动后AMPK、p38 MAPK 增加,可引起PGC-1α信号通路的更大活化,但间歇运动产生的效应更显著[32,33]。
由上可知,在运动中PGC-1α是敏感的心肌线粒体生物发生感受器,不同的运动强度和形式均可活化PGC-1α以及上下游机制,促进心肌线粒体生物发生因子的转录。但关于运动强度、周期、形式仍需要进行横向比较研究。心肌方面的研究结果与骨骼肌是否表现相似的变化趋势有待进一步确定。
2 运动对心肌SIRT3的影响
2.1 SIRT3简介
沉默信息调节因子2(silent information regulator 2,SIR2)是一种依赖于NAD+的去乙酰酶,调节复制性衰老,被认为是长寿和DNA 修复的关键中介[34]。目前已经鉴定出7 个哺乳动物SIR2 同源基因,即SIRT1-7[35]。这些Sirtuins 具有不同的亚细胞位置,如SIRT1/6/7位于核内,SIRT2 位于细胞质,SIRT3/4/5 主要位于线粒体,而不同的亚细胞位置有特定的生物学功能,包括对细胞生长、衰老、耐受性和代谢的不同影响[36,37]。其中,SIRT3 主要作用于线粒体,Onyango 等[38]研究发现SIRT3编码的蛋白可以靶向线粒体嵴,并且在N端的独特结构域包含线粒体定位信号,而当SIRT3 中这一结构域缺失时可消除蛋白质产物对线粒体的靶向作用。Lombard 等[39]通过进一步的敲除SIRT3 基因,发现线粒体蛋白表现高度的乙酰化。以上表明,SIRT3是一种定位于线粒体的蛋白去乙酰酶。SIRT3 在人体中以两种不同的形式存在,一种是全长蛋白,位于N 端的独特结构域包含线粒体定位信号;另一种是N端缺乏142个氨基酸的加工多肽[40]。新合成的SIRT3位于细胞核中,当细胞应激时,全长SIRT3 从核易位到线粒体,在体内和体外均能使组蛋白H3-K9ac和H4-K16ac去乙酰化;但在线粒体中也观察到了N 端缺乏氨基酸的SIRT3[40]。这与Schwer 和Shi 等认为SIRT3 需要N 端才能定位到线粒体相反,这可能是因为人体的SIRT3 需要在进入细胞核时被切割,加工后的蛋白进入线粒体,而小鼠的SIRT3 直接由细胞核定位到线粒体[41,42]。 SIRT3 在富含线粒体的组织大脑、心脏组织中表达尤其高[43]。这些组织中高表达的SIRT3 进而与相应的靶蛋白或底物结合以发挥作用。哺乳动物的乙酰辅酶A 合成酶2(acetyl coenzyme A synthetase 2,AceCS2)是第一个被发现的SIRT3 底物蛋白,SIRT3 可以去乙酰化AceCS 2 的活性位点Lys-642,激活AceCS2,供给三羧酸循环,满足机体能量需求[44,45];另外,SIRT3 与电子传递链复合体Ⅰ中的至少一个已知亚基NADH:泛醌氧化还原酶亚基A9(NADH: ubiquinone oxidoreductase subunit A9,NDUFA9)发生物理作用,促进线粒体呼吸,提高线粒体能量代谢水平[46]。不断发现的新底物推动着SIRT3对线粒体功能影响的相关研究。
2.2 运动促进心肌SIRT3表达
人体实验和动物实验中均发现机体在一定的运动强度和形式下,SIRT3 的表达水平出现上升的趋势(见表2)。在久坐的成年人骨骼肌中SIRT3 蛋白表达随着年龄的增长而降低,而在中等强度的耐力运动受试者中SIRT3 蛋白表达显著高于久坐的受试者[47]。心肌梗死48 小时后,中等强度耐力训练诱导小鼠心脏SIRT3的激活,从而促进p53 诱导的细胞凋亡和叉头框转录因子O3a(forkhead- box transcription factor O3a,Foxo3a)诱导的氧化应激,预防心肌损伤[48]。中等强度的耐力训练还通过增加SIRT3和超氧化物歧化酶2(superoxide dismutase 2,SOD2)蛋白表达,减少心肌线粒体的损伤和活性氧(reactive oxygen species,ROS)生成,从而保护自发性高血压大鼠心脏功能免受氧化应激损害[49]。以上说明运动可以激活SIRT3,并减少氧化应激和细胞凋亡的危害。跑台耐力训练能够逆转阿霉素(doxorubicin,DOX)诱导的小鼠心肌线粒体SIRT3 和TFAM 水平下降,促进线粒体生物发生[50]。不同运动形式的研究发现,游泳、抗阻运动、间歇有氧运动训练都可改善肥胖小鼠缺血后心脏功能恢复,提高心肌线粒体SIRT3 蛋白表达或活性[51-54]。而不同时间的干预积累对于SIRT3及相关因子的激活至关重要,经过2天、7天、14天、28天的自主跑轮训练,仅有训练28天的小鼠心脏SIRT3、PGC-1α基因表达有显著的提高[4]。此外,关于SIRT3 蛋白和基因表达的一致性问题,尚存在争议。大鼠中SIRT3基因表达在单次急性运动后2、4和8小时没有改变,重复的耐力运动才能有效刺激其基因表达,但是SIRT3 蛋白含量在两种运动后均显著增加,以减少氧化应激的损伤,提示SIRT3 基因表达的改变可能不是SIRT3蛋白含量变化所必需的,而SIRT3蛋白的稳定性起着更为重要的作用[55]。综上可知,SIRT3 是敏感的运动感受器,不同形式的中等强度运动可提高心肌SIRT3 的表达水平,在心肌中可以明显改善氧化应激带来的心肌损伤,促进线粒体生物发生,提高心肌能量代谢水平,但运动形式和强度是否是SIRT3 表达的决定性因素及其蛋白和基因表达的一致性问题有待进一步研究。

表2 运动对心肌线粒体SIRT3的影响

(续表2)
3 SIRT3对心肌线粒体生物发生的影响
SIRT3 在心肌中可以直接或间接调节线粒体的DNA 编码或线粒体生物发生的相关因子转录,见图1,但目前关于SIRT3 调节心肌线粒体生物发生的上下游机制尚未完全定论。
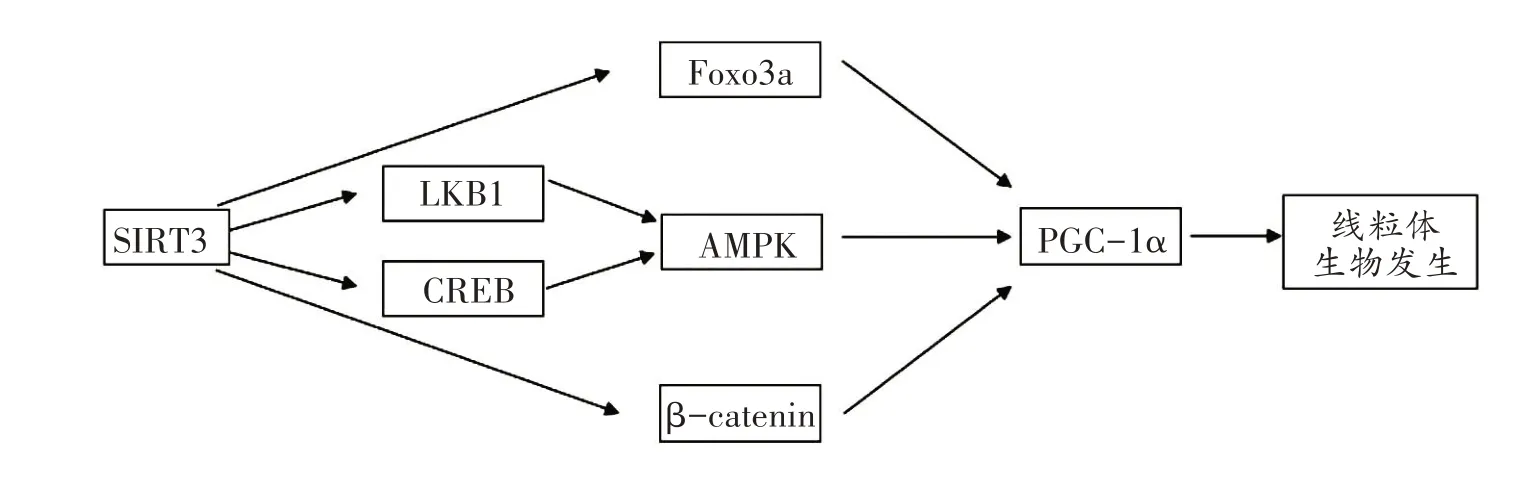
图1 SIRT3影响心肌线粒体生物发生的作用机制
3.1 SIRT3直接影响心肌线粒体生物发生
Wei 等建立心脏缺血/再灌注小鼠模型,经过二氢杨梅素(dihydromyricetin,DHM)治疗后,SIRT3、TFAM和NRF2表达水平提高,原代心肌细胞线粒体结构及线粒体生物发生水平改善;而敲除SIRT3 基因后,TFAM和NRF2 表达以及mtDNA 和ATP 含量降低[56],提示SIRT3 直接调控线粒体生物发生。此外,研究发现SIRT3过表达能够直接去乙酰化TFAM的k154位点,增加TFAM 蛋白与基因表达,提示SIRT3 能够直接激活TFAM,进而结合mtDNA 启动转录,提高线粒体生物发生水平[57,58]。另一项研究观察到SIRT3 过表达后可直接增强PGC-1α、NRF-1 和TFAM 表达,增加了mtDNA含量[59]。但当特异性敲除小鼠SIRT3基因后,发现小鼠心肌PGC-1α乙酰化水平升高[60]。同样在人体卵母细胞中,SIRT3 基因敲除也直接导致mtDNA 拷贝数减少,从而损害人类体外成熟卵母细胞的发育能力,而注射SIRT3 mRNA 后可增加PGC-1α表达和mtDNA 拷贝数[61],说明SIRT3可以直接调节心肌线粒体生物发生。
3.2 SIRT3间接影响心肌线粒体生物发生
一方面,研究认为AMPK/PGC-1α是SIRT3 的下游通路,并与下游转录因子结合,提高mtDNA 水平,促进线粒体生物发生。AMPK 能够直接磷酸化PGC-1α两个关键残基苏氨酸-177 和丝氨酸-538,结合并激活肌肉中的PGC-1α[9]。Xin 等发现,过表达SIRT3 激活心肌损伤小鼠的心肌细胞AMPK 通路,并伴随PGC-1α、NRF1、TFAM 表达升高,促进线粒体生物发生,而加入AMPK 的抑制剂后则逆转了上述现象,说明SIRT3通过AMPK 途径调控心肌线粒体生物发生[3]。有研究表明,SIRT3 还可以通过肝激酶B1(liver kinase B1,LKB1)、CREB 等来调节AMPK,进而影响线粒体生物发生。LKB1 是一种肿瘤抑制因子,可激活AMPK 发挥其功能[62],Pillai 等发现SIRT3 基因敲除小鼠心脏LKB1 乙酰化增加,而在SIRT3 过表达的原代心肌细胞中,LKB1 乙酰化明显下降,并促进其Ser428位点的磷酸化[63]。Verma 等[64]通过建立SIRT3基因敲除小鼠模型,发现缺血/再灌注的大脑LKB1 磷酸化显著下降,上述研究提示SIRT3 可通过调节LKB1 来促进AMPK 表达,进而影响线粒体生物发生。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)是一种糖异生酶[65],骨骼肌中SIRT3 过表达可直接促使CREB 磷酸化,进而促进PGC-1α转录合成[66],而AMPK是CREB 上游调节因子[67],说明SIRT3 可以直接磷酸化CREB,也可以通过激活AMPK 进而激活CREB,从而促进线粒体生物发生。SIRT3 还可以通过调节Foxo3a、β-连环蛋白(β-catenin),进而影响线粒体生物发生。Foxo3a 是一种重要的转录因子,参与调控细胞凋亡和代谢过程[68]。研究报道通过过氧化氢来诱导SIRT3 表达可使Foxo3a 去乙酰化,SIRT3/Foxo3a上调PGC-1α和TFAM,显著改善线粒体的数量和质量[69],提示SIRT3 通过Foxo3a/PGC-1α这一信号通路,增强与PGC-1α的下游转录因子TFAM 的结合,促进线粒体生物发生。有研究观察到SIRT3 过表达可通过β-catenin的降解上调过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)的表达,抑制PPARγ乙酰化,增强PGC-1α的表达,进而调节线粒体生物发生[70]。这提示,SIRT3 除了调节AMPK作为PGC-1α的上游因子调节生物发生以外,SIRT3/Foxo3a/PGC-1α和SIRT3/β-catenin/PPARγ/PGC-1α也是相关的线粒体生物发生信号轴。
另一方面,少数研究表明AMPK/PGC-1α可能是SIRT3 的上游因子,影响SIRT3 表达。Yu 等通过体内注射AMPK 抑制剂或体外低表达AMPK 可显著抑制心肌PGC-1α和SIRT3 表达,而体外基因敲除SIRT3 抑制NRF-1 和TFAM 表达,但没有显著改变AMPK 磷酸化和PGC-1α水平[71,72],提示AMPK-SIRT3 通路可能存在。有研究给小鼠注射AICAR(AMPK 激活剂)后AMPK 表达水平提高,小鼠肾脏SIRT3 和PGC-1α的表达协同增强,说明AMPK 可能是SIRT3 和PGC-1α共同的上游信号,诱导线粒体数量增加[73]。而PGC-1α在SIRT3启动子中可以识别两个作用位点,与ERR-α(estrogen-related receptor-α,ERR-α)协同促进SIRT3 基因转录[74]。在敲低PGC-1α后,SIRT3基因表达也会降低[75,76],说明PGC-1α也可能作为SIRT3 基因表达的上游激活因子。
综上所述,SIRT3可调节心肌线粒体生物发生的相关因子表达,仅有少数研究可能提示线粒体生物发生的相关因子与SIRT3 存在交互作用或协同作用,共同促进线粒体生物发生,这一观点需要进一步研究明确。
4 运动通过SIRT3调节线粒体生物发生
目前研究表明运动既能够调节SIRT3 表达,又能调节线粒体生物发生过程,而进一步研究发现运动能够介导SIRT3 影响线粒体生物发生。有氧运动增加了久坐、超重或肥胖青少年的骨骼肌SIRT3 和PGC-1α的蛋白表达,二者在运动前后存在正相关关系,共同促进线粒体生物发生[77]。此外,老年患者在接受康复综合性运动即有氧、力量、平衡运动后骨骼肌SIRT3 和PGC-1α的蛋白表达水平也呈现同步升高趋势[78]。此外,耐力运动、间歇性低氧和间歇性低氧结合有氧运动等不同的运动形式均可促进线粒体结构形态好转,肝脏和骨骼肌SIRT3、PGC-1α、TFAM 蛋白表达上升[79,80]。敲除SIRT3基因的小鼠在运动干预后骨骼肌AMPK磷酸化和PGC-1α表达下降,这表明SIRT3 在运动促进线粒体生物发生过程中是直接的调控因子[66]。比较不同年龄人群的线粒体生物发生对运动的应答,发现与年轻组相比,两组老年受试者骨骼肌SIRT3 和PGC-1α水平仍然较低,说明年龄是运动影响线粒体生物发生的重要因素[81]。此外,长期运动促进SIRT3-M1 和SIRT3-M2 mRNA水平升高,而极短时间的运动却不能促进PGC-1α和SIRT3 表达,说明运动时间也是影响SIRT3介导线粒体生物发生的重要因素[82]。
目前虽然尚未见研究直接指出运动通过介导SIRT3 调控心肌线粒体生物发生,但通过前文论述可知,运动可以通过介导SIRT3 调节骨骼肌线粒体生物发生。我们推测运动可能通过SIRT3 调控心肌线粒体生物发生,改善线粒体能量代谢,但其在心肌中的调控机制需要通过低表达SIRT3、PGC-1α等因子来观察运动后心肌SIRT3与线粒体生物发生的因果关系。
5 小结与展望
SIRT3 对心肌线粒体生物发生的作用日益被重视。目前大量研究表明SIRT3 是心肌线粒体生物发生的上游信号,它主要通过AMPK/PGC-1α轴促进转录因子TFAM、TFEB 与mtDNA 的结合,增加线粒体数量和质量,促进能量代谢,从而在线粒体生物发生中发挥关键作用。运动是促进心肌功能的重要干预手段。从机制上来讲,运动能够促进SIRT3 表达,保护心肌免受氧化应激损伤,改善心肌功能;同时运动还能够通过PGC-1α通路来增强心肌线粒体生物发生。但是不同形式和不同强度的运动对于SIRT3 及线粒体生物发生的影响也存在一定的差异,因此何种运动能够最大程度地促进线粒体生物发生仍需进一步探索。目前关于运动促进SIRT3 与线粒体生物发生的研究多为关联性研究,因此需要进一步实验来探索运动环境下SIRT3如何调节心肌线粒体生物发生。在不同形式和强度的运动中,SIRT3是否都能促进线粒体生物发生尚未完全明确。SIRT3 除了介导AMPK 促进PGC-1α表达,P53、Foxo3a 和p38MAPK 也是调控线粒体生物发生的重要途径,而运动是否激活SIRT3 进一步促进这些因子表达,提高线粒体生物发生水平,有待进一步研究。
