18F-FDG PET/CT代谢参数和代谢异质性与胃癌患者人表皮生长因子受体2表达状态的相关性
2022-09-05王建林史爱琪范丑丑王育珠郭国蓉柳江燕
王建林,史爱琪,范丑丑,王育珠,郭国蓉,柳江燕
兰州大学第二医院核医学科,兰州 730030
胃癌是消化道最常见的恶性肿瘤之一,WHO国际癌症机构显示,在中国癌症排名中胃癌高居第二,患者5年生存率为20%~30%[1],因此,胃癌患者的治疗一直是临床实践中极具挑战性的任务。研究显示人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)与胃癌的生物学特性及预后密切相关,是胃癌的标志性分子靶点之一[2- 3]。随着临床研究的深入,人们从生物学和基因组角度对胃癌发病过程的认识取得了重大进展,从而奠定了抗HER2治疗在晚期胃癌一线治疗中的重要地位[4]。安全、可靠地评定和监测肿瘤HER2表达状态不仅能指导患者治疗方案的选择,还可以改善预后。然而,活检作为有创检查,使部分患者因严重心肺功能不全或精神疾病等原因无法进行,而且由于肿瘤的异质性,内镜活检标本检测HER2表达的准确率不高,胃镜活检单次取材不能准确反映肿瘤整体的HER2表达,需要多点活检取材以避免检测的偏差,给HER2整体表达检测带来不便[5- 8]。因此,在术前寻求一种无创、简便、准确监测HER2表达水平的方法具有重要意义。18F-FDG PET/CT集解剖与分子成像于一身,作为一种无创工具已在评估多种恶性肿瘤的分子表型中初显成效,如大肠癌中的Kirsten大鼠肉瘤病毒癌基因同源物状态和肺腺癌中的乳酸脱氢酶a表达水平,后者对于涉及乳酸脱氢酶a抑制剂的治疗策略有帮助[9- 13]。本研究旨在探讨18F-FDG PET/CT代谢参数[最大标准摄取值(maximum standardized uptake value,SUVmax)、肿瘤代谢体积(metabolic tumor volume,MTV)、总病变糖酵解量(total lesion glycolysis,TLG)及异质性指数(heterogeneity index,HI)]在预测胃癌HER2表达及指导临床制定胃癌患者个体化治疗方案中的价值。
资料和方法
资料回顾性分析2016年9月至2021年5月在兰州大学第二医院收治的胃癌患者的临床资料。纳入标准:(1)所有患者均行手术治疗,术后病理证实为胃腺癌;(2)所有患者于治疗前均行18F-FDG PET/CT检查,影像资料完整;(3)组织标本可行HER2检测;(4)临床资料完整;(5)无其他恶性肿瘤病史。最终筛选符合纳入标准的45例作为研究对象。
18F-FDG PET/CT图像采集方法通过医用回旋加速器(型号:Minitracer Qilin,美国GE公司)加速质子轰击18O-H2O,发生(p,n)反应,产生18F-离子,传输至放射性药物自动化合成模块(型号:TRACERlab,美国GE公司),采用软件控制自动合成,溶液经纯化柱和0.22 μm无菌过滤膜后得到无菌18F-FDG注射液。使用薄层色谱(型号:Scan-RAM Radio-TLC Detector,英国LabLogic公司)测量18F-FDG溶液的放射化学纯度(>95%),用活度计(型号:CRC- 25PET,美国Capintec公司)测量18F-FDG的放射性活度。所有患者均通过Discovery 690型PET/CT显像仪 (美国通用电气公司)进行检查。患者在扫描前禁食、禁饮含糖饮料至少6 h,注射18F-FDG前确认外周血葡萄糖水平均在9.0 mmol/L以下并详细记录患者身高、体重等信息。18F-FDG通过患者肘静脉注射,剂量为2.96~5.55 MBq/kg。平静呼吸下患者取仰卧位进行PET/CT扫描,范围从头顶至股骨上段。扫描时先行低剂量CT(120 kV,50~220 mA)图像采集,层厚3.75 mm,后行PET图像采集,采用static TOF+3D的方法采集,图像矩阵为256×256。应用VUE Point迭代算法进行图像重建(截止频率:1.0 mm,迭代子集:18,迭代次数:4),重建后的图像经北京麦迪克斯公司图像处理工作站后处理及融合,从而得到各个三维扫描层面的PET、CT、PET/CT融合图像。
18F-FDG PET/CT图像分析方法由2名工龄分别为6、8年的核医学诊断医师对图像进行分析,根据18F-FDG摄取情况对病灶进行感兴趣区(region of interest,ROI)的勾画,由工作站自动计算相关代谢参数SUVmax、MTV和TLG,肿瘤负荷三维ROI边缘阈值为40%×SUVmax。胃癌代谢异质性以HI表示,即不同SUVmax阈值(40%×SUVmax、80%×SUVmax)所对应的MTV之间的线性回归斜率的绝对值。
HER2表达检测方法选取适当癌组织,通过免疫组织化学染色的方法检测癌组织中的HER2表达情况,参照《胃癌HER2检测指南》[6]评分标准:(1)0:胞膜无染色或者<10%肿瘤细胞膜染色;(2)1+:≥10%肿瘤细胞微弱或隐约可见膜染色,仅有部分细胞膜染色;(3)2+:≥10%肿瘤细胞有弱到中度的基底侧膜、侧膜或完全性膜染色;(4)3+:≥10%肿瘤细胞基底侧膜、侧膜或完全性膜强染色。根据既往研究[4]以0和1+为阴性,2+和3+为阳性。
统计学处理采用SPSS 25.0软件进行统计分析。计数资料直接用例数表示,非正态分布的计量资料采用中位数(四分位间距)表示,组间比较采用Fisher’s精确检验以及Mann-WhitneyU检验。采用受试者工作特征曲线评价18F-FDG PET/CT各参数及HI对预测HER2表达的效能。所有临床病理变量、18F-FDG PET/CT代谢参数及HI均采用单因素分析,判断各变量与HER2表达状态的相关性,根据单因素分析结果将差异具有统计学意义的变量纳入多因素Logistic回归模型中,从而判断HER2表达的独立预测因素。P<0.05为差异有统计学意义。
结 果
临床病理特征共纳入45例胃癌患者,男33例、女12例,年龄(60±12)岁,肿瘤大小0.4~12 cm,位于贲门/胃底10例、胃体20例、胃窦15例,中/高分化22例、低分化23例,肠型30例、弥漫型6例、混合型9例,术后T1/T2期28例、T3/T4期17例、N0期16例、N+期29例。HER2阳性10例、HER2阴性35例,阳性率22%(10/45)。中/高分化型胃癌HER2阳性表达高于低分化型胃癌(P=0.004),年龄、性别、肿瘤大小、肿瘤部位、Lauren分型、T分期及N分期均与HER2表达无相关性(表1、图1、图2)。
胃癌原发灶的代谢参数和HI与HER2表达的关系胃癌HER2阳性表达者原发灶SUVmax、MTV、TLG及HI分别为6.50(5.44,9.13)、7.39(4.47,9.89) cm3、20.42(13.76,44.50) g及2.01(1.44,3.57),阴性表达者原发灶SUVmax、MTV、TLG及HI分别为6.68(4.49,11.41)、18.78(7.82,29.57) cm3、55.34(29.69,189.00) g及4.80(2.53,6.80),MTV(P=0.043)及HI(P=0.048)在HER2阳性表达者中低于阴性者,而SUVmax及TLG在胃癌HER2阳性表达与阴性表达者间差异均无统计学意义(P均>0.05)。根据受试者工作特征曲线确定胃癌原发灶MTV及HI预测HER2阳性表达的最佳阈值分别为12.10 cm3及3.71,其预测HER2阳性表达的准确率分别为62.2%(95%CI=47.5%~77.0%)及57.8%(95%CI=42.8%~72.8%),特异度分别为70.4%(95%CI=49.7%~85.5%)及63.0%(95%CI=42.5%~79.9%),敏感度分别为85.7%(95%CI=42.0%~99.2%)及85.7%(95%CI=42.0%~99.2%),阳性预测值分别为36.0%及33.3%,阴性预测值分别为95.0%及94.4%(图3)。
根据MTV最佳阈值对患者进行分组,MTV<12.10 cm3者共25例,HER2阳性9例、阴性16例,MTV≥12.10 cm3者共20例,HER2阳性1例、阴性19例,两组患者HER2阳性表达率差异有统计学意义(P=0.027);根据HI最佳阈值对患者进行分组,HI<3.71者共27例,HER2阳性9例、阴性18例,HI≥3.71者共18例,HER2阳性1例、阴性17例,两组患者HER2阳性表达率差异有统计学意义(P=0.034)。
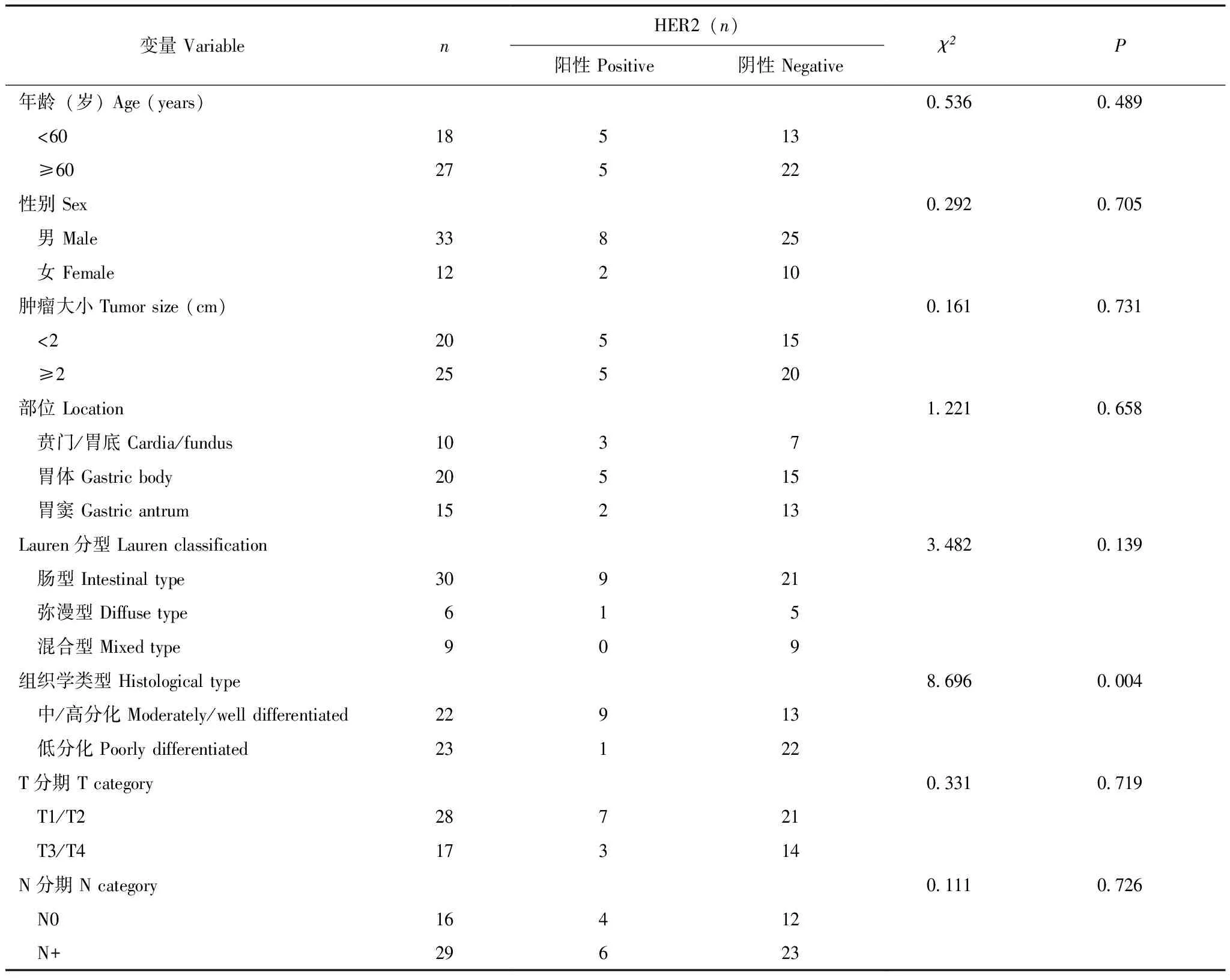
表1 胃癌患者临床病理特征与HER2表达的单因素分析

SUVmax:最大标准摄取值;MTV:肿瘤代谢体积;TLG:总病变糖酵解量;HI:异质性指数
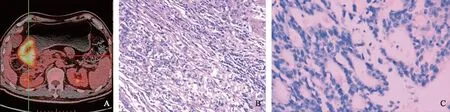
A.18F-FDG PET/CT融合图像(SUVmax=13.37、MTV=40.51 cm3、TLG=308.61 g、HI=6.24);B.HE染色(×100);C.免疫组织化学染色[HER2(0),×200]

图3 受试者工作特征曲线评价18F-FDG PET/CT代谢参数及代谢异质性判断HER2表达的效能
胃癌患者中影响HER2表达的相关变量多因素回归分析及分层分析单因素分析显示肿瘤的分化程度、MTV及HI与HER2表达状态相关。多因素Logistic回归分析显示仅肿瘤的分化程度是预测HER2表达的独立因素,中/高分化胃癌患者HER2阳性表达更高(OR=20.130,95%CI=1.843~219.860,P=0.014)(表2)。对肿瘤分化程度进一步分层分析显示,在中/高分化胃癌中,HER2表达状态仅在不同MTV阈值组间差异有统计学意义(P=0.031),而不同HI阈值组间差异无统计学意义(P=0.165);在低分化胃癌中,HER2表达状态在不同MTV(P=1.000)及HI(P=1.000)阈值组间差异均无统计学意义(表3)。
讨 论
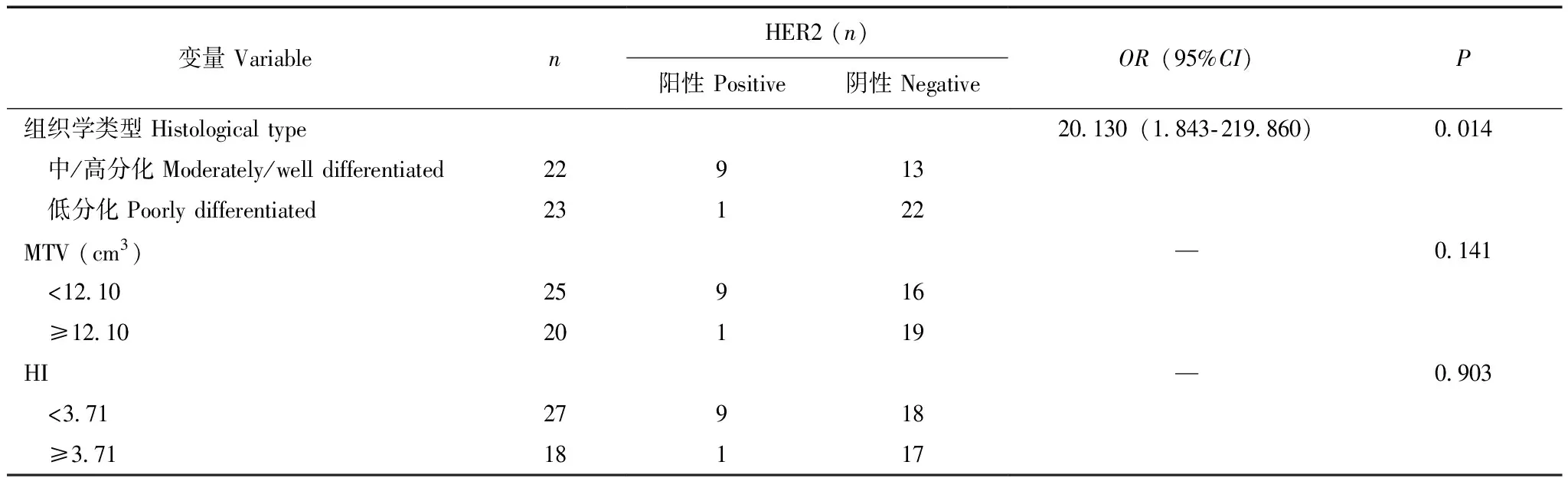
表2 预测HER2表达的多因素分析
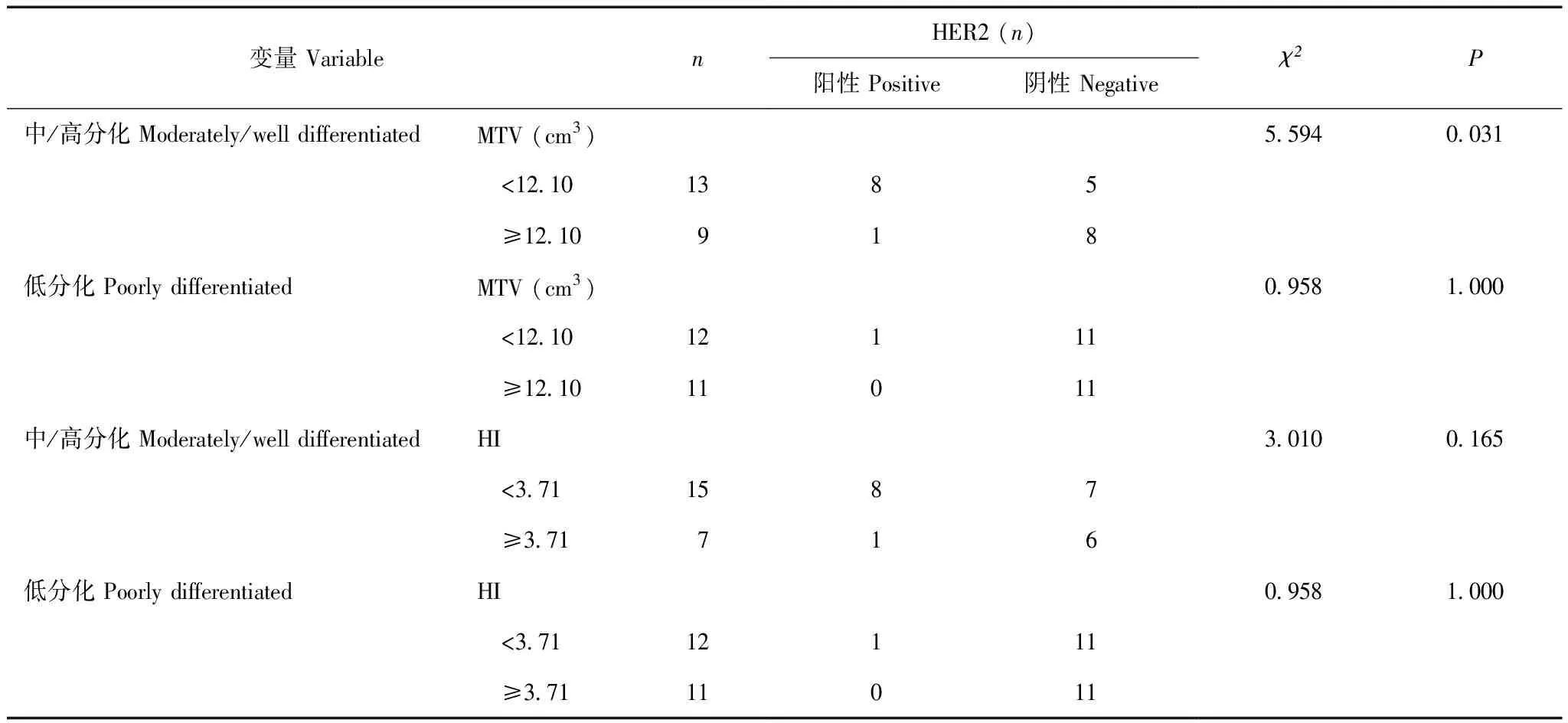
表3 混杂影响因素的分层分析
胃癌是威胁人类健康的重大疾病之一,由于发病时临床症状缺乏特异性,多数患者确诊时已处于进展期,预后差,据不完全统计,仅2018年全球就有78.4万人死于胃癌[14- 15]。相关研究表明HER2与胃癌的发生、进展密切相关,是胃癌独立的预后预测指标之一[16]。化疗联合曲妥珠单抗(一种抗HER2的单克隆抗体)是HER2阳性胃癌患者的标准治疗策略,可显著延长患者的生存期[17- 18]。因此,在治疗前明确HER2的表达,是临床上胃癌治疗的常规做法,本研究HER2阳性率为22%,与先前研究结果[4,19]相符。另外,本研究显示在低分化胃癌患者中,HER2阳性率显著低于中/高分化胃癌患者,与既往研究[20]相似,同时,胃癌原发病灶MTV及HI在HER2表达阴性患者中显著高于HER2阳性患者。但低分化腺癌由于其恶性度高,代谢增殖快,肿瘤细胞生长旺盛,所以肿瘤负荷MTV较中/高分化腺癌高,同时快速地增殖生长导致肿瘤内部坏死增多,从而原发病灶的异质性增大,这可能解释了MTV与HI在HER2表达阴性的胃癌患者中高于HER2表达阳性者。
既往研究结果显示,18F-FDG PET/CT相关代谢参数与胃癌HER2表达情况存在一定的差异,Chen等[21]对64例术前胃癌患者的SUVmax进行分析,结果显示在仅有腺癌的情况下,胃癌原发灶SUVmax在HER2表达阳性与阴性患者中差异有统计学意义,HER2阳性者SUVmax明显低于HER2阴性者。而Park等[22]研究结果显示SUVmax在HER2表达阳性与阴性患者中差异无统计学意义。弭丽丽等[23]研究显示,排除印戒细胞癌的干扰后,MTV、TLG、肿瘤分化程度及肿瘤的组织学分型在HER2表达阳性和阴性患者中差异有统计学意义,且TLG与肿瘤的组织学分型是预测HER2表达的独立因素。本研究结果显示MTV、HI及肿瘤的分化程度在胃癌HER2表达阳性与阴性患者差异均有统计学意义,但预测HER2表达的独立因素仅有肿瘤的分化程度。以上相关研究结果与本研究结果存在不同程度上的差异,究其原因可能与以下因素有关:(1)PET/CT代谢参数所对应的病灶不尽相同,既往的部分研究包含了转移灶的代谢参数,而本研究仅为原发灶的代谢参数;(2)HER2表达阳性的定义不同;(3)部分既往研究的研究对象包括局部进展期胃癌与晚期胃癌,本研究仅为局部晚期胃癌;(4)本研究创新性的引入了HI代表肿瘤的异质性。然而,进一步对肿瘤分化程度进行分层分析提示,对于中/高分化胃癌,MTV对HER2表达状态的预测效能高于HI,这可能与HI的计算方式有关,百分比阈值法强烈依赖于肿瘤的SUVmax,这导致18F-FDG摄取高的肿瘤病变之间存在较大差异,而在低18F-FDG摄取的肿瘤中,相邻胃壁的生理性摄取又会影响对胃癌边缘的准确评估,因此,相较于MTV,需多次进行测量并计算的HI可能进一步放大了误差,从而降低了其本身的预测效能。对于低分化胃癌二者差异无统计学意义,这可能是由于分层后阳性样本量占比过少而导致统计学上的偏倚。
目前,对HER2能否被视为胃癌预后指标尚存异议。一些研究未能发现其与预后的关系[24- 25],而另一些研究显示HER2表达或扩增与低生存率之间存在直接关系[26- 27]。但是,靶向治疗已成为肿瘤治疗的新导向,在胃癌方面,分子靶向治疗也逐渐得到重视。近年来,由于人们对HER2及新型放射性示踪剂研究的不断深入,使放射性标记的曲妥珠单抗在反应肿瘤组织HER2表达状态上表现出巨大潜力,不仅可以无创地显示HER2表达的癌细胞,而且能长时间监测患者的治疗靶点参与情况[28- 30]。在一项针对HER2成像的临床研究中,Laforest等[31]在转移性乳腺癌患者中进行了首次人体89Zr-曲妥珠单抗PET成像,结果显示89Zr-曲妥珠单抗表现出良好的肿瘤摄取和HER2阳性转移病灶的可视化。同样,89Zr-曲妥珠单抗在描述HER2阳性胃癌[28- 29]和监测肿瘤对HER2导向疗法的应答方面效果显著,并且相较18F-FDG,89Zr-曲妥珠单抗在HER2阳性表达的胃癌患者中更具特异性[30]。另外,Guo等[32]在对胃癌患者行124I-曲妥珠单抗PET成像的研究显示,对于HER2阳性与阴性患者,124I-曲妥珠单抗具有较高区分度,当以SUVmax=4.0作为阈值时,其诊断敏感性和特异性可达94.4%与100%,同时也证实了成像对患者的安全性。然而,上述研究大多停留在临床前研究或存在研究样本少的缺点,目前尚未实现临床普及。
本研究的不足之处:(1)回顾性研究,对样本的不同组织学分型存在选择偏倚;(2)单中心研究,样本量少,需要进一步前瞻性、大样本、多中心的临床研究给予完善。
综上,18F-FDG作为目前临床使用最为广泛的示踪剂,对其在胃癌HER2表达上的研究非常必要,虽然本研究结果显示18F-FDG PET/CT在预测胃癌HER2表达上具有中等效能,暂不能达到独立预测的作用,但在一定程度上可帮助胃癌患者进行HER2表达状态的综合性评估,辅助临床指导治疗。
