重度主动脉瓣狭窄合并左心室流出道梗阻经导管主动脉瓣置换术1 例
2022-09-05侯士强潘文志陈莎莎周达新葛均波
侯士强 潘文志 陈莎莎 周达新 葛均波
1 临床资料
患者 男,84岁。因“反复胸闷5年,加重2个月,晕厥2次”于2021年9月2日入住复旦大学附属中山医院。既往阵发性心房颤动病史6年,半年前行经皮左心耳封堵术。高血压病史20余年,最高血压180/90 mmHg(1 mmHg=0.133 kPa),服用氨氯地平治疗,血压控制可。糖尿病病史10余年,服用二甲双胍、格列齐特,血糖控制可。同时存在慢性阻塞性肺病和肾功能不全病史。入院查体:体温36.5℃,心率92次/分,律齐,呼吸20次/分,血压117/52 mmHg;神志清,口唇无发绀,双侧颈静脉无怒张;双下肺可闻及少量湿啰音,胸骨右缘第2肋间可闻及4/6级收缩期喷射性杂音,伴震颤;双下肢轻度水肿。实验室检查示:血红蛋白115 g/L,血小板计数136×109/L,肌钙蛋白T 0.139 ng/ml,N末端B型脑钠肽前体30 442 pg/ml,血肌酐220 μmol/L,白蛋白30 g/L,电解质、血脂、甲状腺功能正常。心电图示:窦性心律(心率92次/分,PR间期为128 ms,无各类型传导阻滞)。经胸超声心动图示:主动脉瓣明显增厚钙化伴重度狭窄(瓣口面积为0.7 cm2,主动脉瓣平均跨瓣压差51 mmHg),合并轻度反流;左心室壁明显增厚,左心室流出道(left ventricular outflow tract,LVOT)梗阻,LVOT峰值压差52 mmHg,见二尖瓣前叶收缩期前向运动(systolic anterior motion,SAM)征;肺动脉收缩压33 mmHg,左心室舒张末期内径49 mm,左心室收缩末期内径33 mm,左心室射血分数55%。CT血管造影(CT angiography,CTA)示(图1):主动脉瓣为三叶式(部分融合),瓣环径23.4 mm,LVOT宽度在瓣下4 mm为22.2 mm,瓣下6 mm为22.6 mm,瓣下8 mm为23.0 mm,瓣下11 mm为13.9 mm,窦管交界29.2 mm,升主动脉内径34.4 mm;左冠状动脉开口高度为15.0 mm,右冠状动脉开口高度为10.0 mm;冠状动脉左前降支轻度狭窄,存在经皮腔内室间隔心肌消融术(percutaneous transluminal septal myocardial ablation,PTSMA) 可用间隔支。初步诊断:心脏瓣膜病(主动脉瓣重度狭窄、轻度反流),阵发性心房颤动(左心耳封堵术后),纽约心脏病协会心功能分级Ⅳ级,高血压病3级(极高危),糖尿病,慢性阻塞性肺病,肾功能不全。
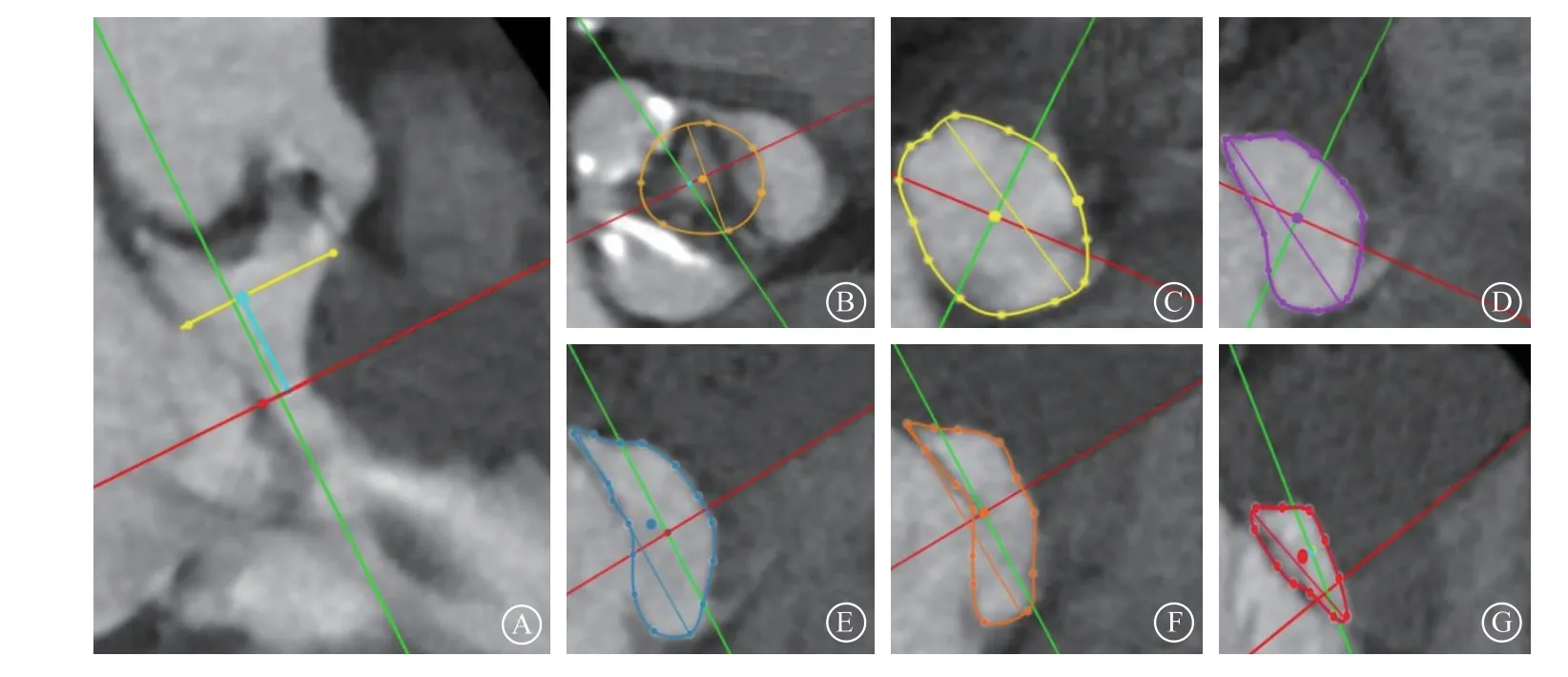
图1 CT 血管造影评估主动脉根部结构 A. LVOT;B. 瓣上6 mm LVOT;C. 主动脉瓣环; D. 瓣下4 mm LVOT;E. 瓣下6 mm LVOT;F. 瓣下8 mm LVOT;G. 瓣下11 mm LVOT
经心脏多学科团队对患者综合评估后认为:患者的美国胸外科医师协会手术风险评分15.790%,为外科手术极高危,行外科换瓣联合LVOT疏通术的手术风险极高,介入治疗似乎是其唯一希望;单纯经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)可能出现术后SAM征加重,循环崩溃;结合本中心既往经验[1],考虑可先行TAVR,再根据术中情况决定是否行PTSMA;同时瓣膜适当低位释放,以达到瓣膜支架支撑LVOT的目的;手术在杂交手术室进行,做好外科补救的准备。根据术前CTA对血管路径、主动脉根部和LVOT解剖结构的详细评估,采用右股动脉为路径,选择18 mm×40 mm球囊进行预扩张,置入23 mm Venus-A瓣膜(杭州启明医疗器械有限公司)。瓣膜释放策略采用起始低位,释放过程中逐渐接近目标着陆区(图2)。术中血流动力学稳定,测得左心室心尖部压力(术前189/1 mmHg,术后110/2 mmHg)、主动脉瓣压(术前154/19 mmHg,术后107/4 mmHg)、主动脉根部压力(术前102/48 mmHg,术后100/50 mmHg)。术后经食管超声心动图示(图3):人工主动脉瓣工作良好,瓣膜支架支撑LVOT,SAM征改善,轻微瓣周漏,二尖瓣开放不受限,轻度二尖瓣反流。术后无新发束支传导阻滞,于术后24 h拔除临时起搏器。患者心力衰竭明显好转,药物治疗以血管紧张素受体脑啡肽酶抑制剂、β受体阻滞剂为主,顺利出院。术后3个月临床随访,患者无明显心力衰竭症状,心电图无新发束支传导阻滞,超声心动图提示人工主动脉瓣工作良好。
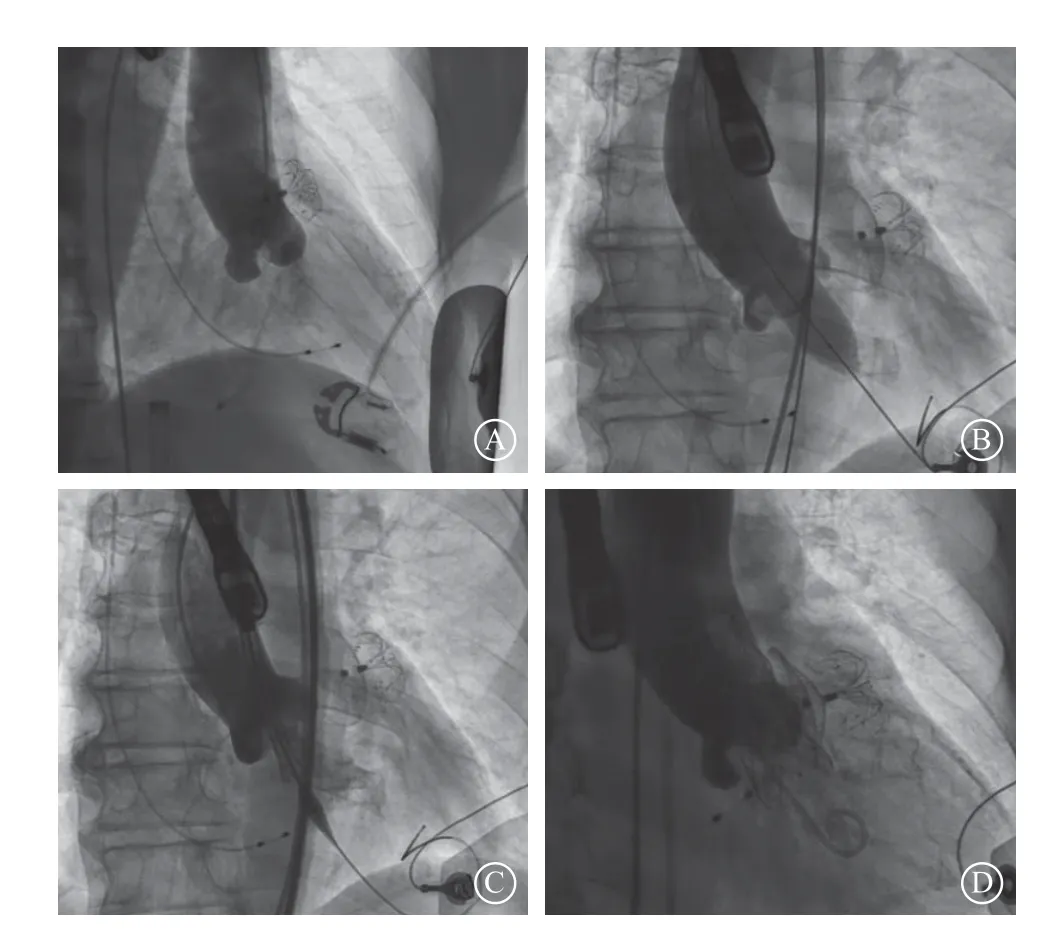
图2 手术过程 A. 主动脉根部造影;B. 球囊预扩张;C. 释放定位;D. 术后造影

图3 术前术后行经食管超声心动图 A. 术前经食管超声心动图;B.术后经食管超声心动图
2 讨论
主动脉瓣狭窄合并心肌肥厚临床上较为常见。对于主动脉瓣狭窄合并LV OT梗阻,超声心动图较难准确评估跨瓣压差和LVOT压差,测量压差时可选择不同切面以尽量避免干扰;在心肌形态上,主动脉瓣狭窄时心肌多为对称性肥厚、质地较均匀,而肥厚型梗阻性心肌病时心肌为非对称性肥厚、质地不均匀。另外,还需结合患者的病史、辅助检查、治疗过程等,对二者进行临床上的鉴别诊断。术中导管测压可进行准确测量,鉴别哪种因素为主。主动脉瓣狭窄造成LVOT后负荷增加,梗阻程度容易被低估或掩盖。目前主动脉瓣狭窄合并LVOT梗阻被列为TAVR禁忌证[2]。TAVR术后新发或加重LVOT梗阻的机制为:(1)TAVR术后,左心后负荷骤然下降,LVOT处的血流速度加快,造成Venturi效应吸引二尖瓣前叶及腱索前向运动;(2)左心室充盈压下降(尤其是左心室内径小的患者),加剧LVOT梗阻。TAVR术后出现LVOT梗阻的病例在国际上屡有个例报道,PTSMA作为紧急补救措施(bail-out strategy)治疗后均获得改善[3-6]。本中心于2020年4月在国内首次开展“一站式”TAVR+PTSMA手术,效果良好[1]。
虽然PTSMA可作为补救措施,但在患者生命体征极不稳定的情况下进行抢救性PTSMA操作存在很大风险。因此,对于此病例我们思考是否可将部分可控风险前移,避免循环崩溃后带来的抢救性操作,以提高此类患者的救治成功率。本病例提供了另一种“一石二鸟”的解决思路:将TAVR瓣膜较深地置入,解决瓣膜狭窄的同时利用瓣架作为LVOT的支撑,解决LVOT梗阻。这也为无合适间隔支不能行PTSMA的患者提供了另外一种解决方案。但是,术前需要仔细评估主动脉根部解剖及各平面直径,充分预估由于较深置入TAVR瓣膜后可能存在的风险,包括:瓣周漏、二尖瓣瓣口狭窄、二尖瓣复合物损伤、传导阻滞等[7]。瓣膜选择应避免尺寸过大,因为瓣膜尺寸过大会严重挤压LVOT,传导阻滞风险会升高;另外瓣膜尺寸过大时瓣膜下移风险也升高,可能影响二尖瓣功能。术中造影和经食管超声心动图监测可为瓣架置入的合适深度提供重要指引。
对于主动脉瓣狭窄合并LVOT梗阻,若先行PTSMA缓解LVOT梗阻,由于瓣口狭窄未解除,会使跨瓣压差骤升、血流速度进一步加快,Venturi效应增强造成严重SAM征。另外,临床上大部分主动脉狭窄合并流出道梗阻患者,瓣口狭窄解除后,若即刻未出现梗阻加重,长期来讲由于后负荷降低,心肌收缩力也随之下降,梗阻反而会较前缓解。所以,对于此类患者,应该先解除瓣口狭窄,再评估流出道情况。本例患者为外科手术极高危,家属强烈要求介入治疗,经评估手术风险在可控范围内,且本中心和国外已有类似病例报道,故在做好应急预案的前提下行TAVR,包括PTSMA和外科手术。本病例经较深的瓣膜置入覆盖部分LVOT后,主动脉瓣狭窄解除的同时并未出现LVOT梗阻,说明了此策略的有效性,术后血流动力学稳定并未进一步行PTSMA等处理。另外,此患者适当加深的瓣膜置入并未发生传导阻滞等并发症,这需要术前对解剖结构详细的评估、选择合适的瓣膜尺寸、以及术中瓣膜释放的精准定位。需特别注意的是,目前此类患者如可耐受仍首先推荐外科手术。由于介入治疗风险也较大,此类手术的施行需要强大的心脏内外科团队力量支撑。
目前,虽然主动脉瓣狭窄合并LVOT梗阻被列为TAVR禁忌,但对于无法行外科手术的患者,介入治疗是其唯一希望。此类TAVR的手术策略包括:PTSMA和瓣膜较深置入。若预测LVOT梗阻高危,术中紧急风险大,则需要心脏内外科团队仔细评估风险与获益,再决定选择外科还是经导管介入治疗。本病例的成功处理为此类患者的救治提供了参考经验,也为TAVR适应证拓展了新的方向。
利益冲突所有作者均声明不存在利益冲突
