基于小分子探针的硫化氢光电化学传感器
2022-09-05叶晓雪刘志洪
孔 耀,叶晓雪†,刘志洪,2†
1. 湖北大学化学化工学院/有机化工新材料湖北省协同创新中心/有机功能分子合成与应用教育部重点实验室,湖北 武汉430062;2. 武汉大学 化学与分子科学学院,湖北 武汉430072
0 引 言
硫化氢(H2S)作为与人类健康高度相关的分子,其高浓度下的生物毒性以及内源性H2S 的生理调节作用都受到广泛关注[1]。众所周知,H2S 是石油开采、燃料燃烧和废物处理等各种工业活动中最常见的有毒气体之一[2,3]。另一方面,H2S 已被证明是继一氧化氮(NO)和一氧化碳(CO)之后的第三种内源性气体信号化合物[4],在中枢神经系统和其他器官中发挥着关键作用,参与介导多种生理过程,如细胞凋亡[5]、炎症[6]和神经调节[7]等。到目前为止,已经开发了多种方法用于H2S 测定,如色谱法[8]、表面增强拉曼光谱法[9]、荧光光谱法[10,11]等。然而,这些方法依赖于昂贵的设备和耗时的预处理过程,不利于在环境监测和生物分析中的快速检测,因此,亟需开发更加便捷可靠的分析工具用于H2S 的高效检测。
光电化学(PEC)传感是一种新兴的分析技术,近年来引起了人们的广泛兴趣[12]。在激发光的照射下,电极表面的光电活性材料吸收能量大于或等于其带隙的光子,产生光生电子-空穴对,其价带(VB)上的光生电子跃迁至导带(CB),CB 中的电子转移至电极界面(或溶液中),从而产生可检测的阳极(或阴极)光电流信号[13]。PEC 传感具有仪器设备简单,易于小型化等优点,同时,光和电两种完全分离的能量形式分别被作为激发源(光源)和检测信号(电信号),使得PEC 传感具有更加优异的信噪比和灵敏度[14]。这些独特的性能和技术优势使PEC传感在环境监测、食品安全检测和生物分析等领域展现出良好的应用前景。然而,面对复杂的样品环境,PEC 传感的选择性却面临巨大的挑战[15]。有机小分子探针通过特异性化学反应识别目标分子,因此具有很高的选择性,在荧光分析中应用广泛[16,17]。由于有机小分子探针结构灵活,通过与不同的识别域偶联而用于多种目标物检测,包括活性氧、活性硫以及其他生物活性小分子等,具有较好的普适性[18,19]。因此,将小分子探针引入PEC 传感的识别机制,是解决现有PEC 传感在复杂体系中选择性不足的理想策略。如何将小分子探针与目标物的识别过程转换为可检测的光电流信号是构建高选择性传感界面的关键。由于光电活性材料和小分子探针都具有光吸收的特点,因此,我们提出了利用小分子探针与光电活性材料对光子的竞争吸收来构建PEC 传感器的新思路。
基于以上研究,本文发展了一种基于小分子探针的PEC 传感新策略用于水溶液中H2S 检测,拟通过探针与目标物之间的特异性化学反应提高PEC传感的选择性。首先合成了具有香豆素骨架结构且能够特异性识别H2S 的小分子探针(命名为pH2S),pH2S 在波长590 nm 处的吸收强度随着H2S浓度的升高而减弱。在590 nm 激光照射下,半导体Bi2S3价带上的电子受激跃迁至导带,产生光生电子-空穴对,当光生电子迁移至电极表面时,即产生阳极光电流。溶液中的抗坏血酸(AA)作为电子给体可捕获价带上的空穴(AA 被空穴氧化为AA+),可促进光生电子和空穴的有效分离,增强光电流响应。当小分子探针pH2S 存在时,由于pH2S 和Bi2S3纳米颗粒在590 nm 处存在竞争吸收,因此光电活性材料Bi2S3的激发被抑制,光电流响应信号较小。当目标物H2S 存在时,H2S 亲核进攻pH2S 上吲哚盐的不饱和双键,生成产物pH2S-S2-,破坏探针的共轭体系,使小分子探针的分子内电荷转移(ICT)效应受到限制,导致pH2S 在590 nm 处的吸收强度显著降低,更多的Bi2S3被激发,从而使传感器的光电流恢复(图1)。由此,通过pH2S 与目标物之间的特异性识别反应调控光电流信号,实现对目标物H2S 的高选择性检测。

图1 (a)基于小分子探针构建PEC 传感器检测水溶液中的H2S;(b)探针pH2S 的识别过程Fig.1 (a)The small molecule probe constructed PEC sensor for the detection of H2S in aqueous solution;(b)the recognition process of H2S by pH2S
1 实验部分
1.1 试剂及仪器
试剂:Bi(NO3)2·5H2O、Na2S·9H2O、硫代乙酰胺(TAA)、4-二乙氨基水杨醛、丙二酸二乙酯、三氯氧磷(POCl3)、N,N-二甲基甲酰胺(DMF)、2,3,3-三甲基吲哚、苄基溴购自上海阿拉丁试剂有限公司;乙二醇、无水乙醇(EtOH)、抗酸血酸(AA)、哌啶、浓盐酸、冰醋酸、氢氧化钠、正己烷、甲苯购自上海国药试剂有限公司;实验用水为超纯水。
仪器:CHI 660E 电化学工作站(上海辰华仪器有限公司),590 nm 激光器(广州彤泰科技公司),UV-2650 型 紫 外-可见 分 光光 度 计(Shimadzu 公司),ZS90 型纳米粒度电位仪(Malvern 公司),Sigma 500 型场发射扫描电子显微镜(SEM,Zeiss 公司),ASCEND-400 型核磁共振波谱仪(Bruker公司)。
1.2 合成方法
1.2.1 Bi2S3纳米颗粒的合成
Bi2S3纳米颗粒的合成方法参考文献方法[20]并稍作修改。具体实验步骤如下:将Bi(NO3)2·5H2O(1.94 g,4 mmol)溶于40 mL 乙二醇中,超声使其分散均匀,然后向溶液中加入TAA(0.45 g,6 mmol),超声使其分散均匀,将混合物在室温下搅拌5 h。反应结束后,通过离心(8 000 r/min)分离,分别用超纯水和EtOH 洗涤产物3 次,得到纯化的沉淀物,冷冻干燥,于冰箱中-20 ℃储存。
1.2.2 硫化氢小分子探针pH2S 的合成
pH2S 的合成依据参考文献方法[21],合成路线如图2 所示。
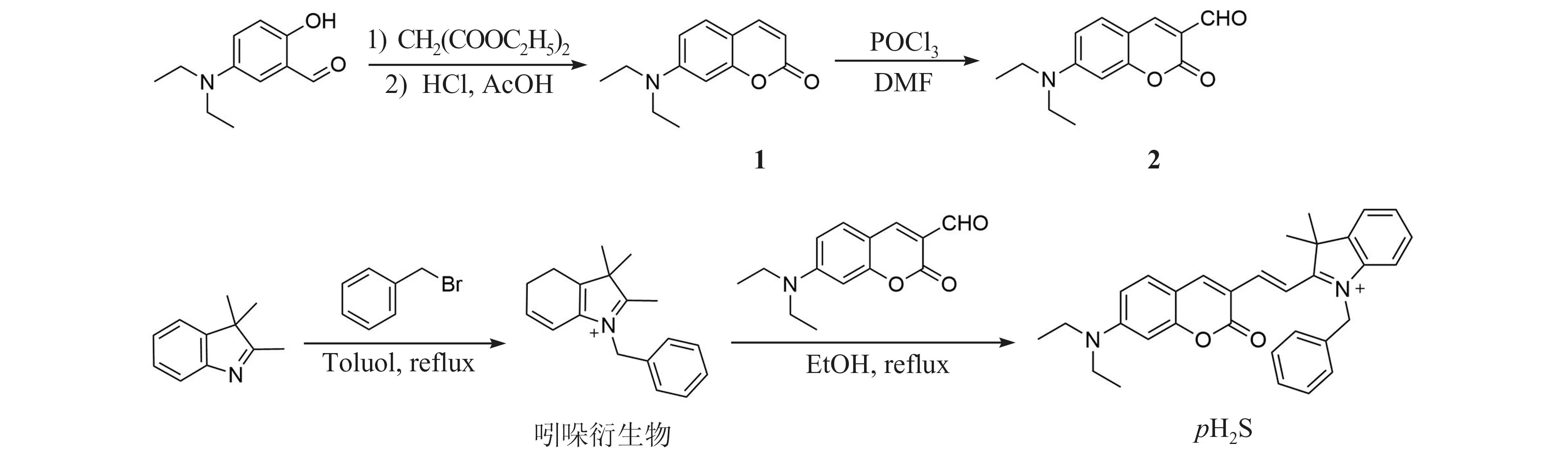
图2 有机小分子探针pH2S 的合成路线Fig.2 Synthetic route to the organic small molecule probe pH2S
化合物1的合成。将4-二乙氨基水杨醛(1.93 g,10 mmol)、丙二酸二乙酯(3.2 g,20 mmol)和哌啶(1 mL)依次溶解在EtOH(30 mL)中,将混合物在搅拌下回流6 h。反应结束后,将混合物真空蒸发,然后向残余物中依次加入浓盐酸(20 mL)和冰醋酸(20 mL),将所得混合物继续在搅拌下回流6 h。反应结束后,将产物加入冰水(100 mL)中,逐滴滴加40%氢氧化钠溶液,调节pH 值至5.0,即得到灰白色沉淀,继续搅拌30 min 后,减压过滤,水洗,干燥,将所得产物加入到甲苯中重结晶,得到化合物1(1.74 g),产率80%。
化合物2 的合成。将三氯氧磷(2 mL)逐滴滴加至DMF(2 mL)中,将混合物在20~50 ℃的N2气氛下搅拌30 min,得到红色溶液。然后将化合物1(1.5 g,6.91 mmol)溶解在DMF(10 mL)中,将该混合物与所得红色溶液混合,于60 ℃搅拌12 h。反应结束后,将所得产物加入到冰水(100 mL)中,逐滴滴加20%氢氧化钠溶液,调节pH 值至5.0,即得到橙红色沉淀,减压过滤,水洗,干燥,将所得产物加入到EtOH 中重结晶,得到化合物2(1.2 g),产率70%。
吲哚衍生物的合成。将2,3,3-三甲基吲哚(1 mL,6.2 mmol)和苄基溴(0.8 mL,6.7 mmol)依次加入到甲苯(20 mL)中,将所得混合物在搅拌下回流18 h。反应结束后,过滤并浓缩滤液,用正己烷洗涤。最后,减压过滤除去溶剂,真空干燥后得到红色固体吲哚衍生物(0.8 g),产率52%。
化合物pH2S 的合成:将化合物2(245 mg, 1.0 mmol)和吲哚衍生物(330 mg, 1.0 mmol)依次溶解在20 mL EtOH 中,将所得混合物在搅拌下回流12 h。反应结束后将混合物真空蒸发,残余物通过硅胶柱层析法纯化(CH2Cl2/MeOH 体积比20∶1),得到深蓝色固体pH2S(190 mg),产率34%。产物的1H NMR(400 MHz,CH3OD)化学位移值δ:8.52(s,1H),8.35(d,J=15.3 Hz,1H),8.13(d,J=15.5 Hz,1H),7.75(m,J=7.2,5.7,2.8 Hz,2H),7.61~7.54(m, 3H), 7.40(m, 5H), 6.95~6.87(dd, 1H),6.63(d,J=2.4 Hz,1H),5.74(s,2H),3.61(q,J=7.1 Hz,4H),1.87(s,6H),1.27(t,J=7.0 Hz,6H)。
1.3 光电化学传感器的制备
将氧化铟锡(ITO)电极依次用丙酮、EtOH 和超纯水超声清洗,在烘箱中于60 ℃干燥,再将打孔的3M 胶带粘贴在电极的导电面,使ITO 电极的导电面积固定为直径0.5 cm 的圆形,然后浸入Bi2S3分散液(1 mg/mL)中浸泡30 min,取出,于烘箱中60 ℃烘干,在其表面形成均匀稳定的Bi2S3涂层,即得Bi2S3/ITO 电极。将Bi2S3/ITO 电极浸泡于pH2S溶液中,置于烘箱中60 ℃干燥,得到PEC 传感器,命名为pH2S/Bi2S3/ITO。
1.4 H2S 的光电化学检测
Na2S 溶解在水溶液中以后,主要以HS-和H2S的形式存在,在此以不同浓度的Na2S 作为H2S 供体配制检测溶液,用于评估传感器检测H2S 的性能。pH2S/Bi2S3/ITO 与不同浓度的H2S(Na2S)在25 °C孵育4 min,用磷酸盐缓冲溶液(PBS)洗去未反应的H2S。光电化学和电化学测量均在CHI 660E 电化学工作站上使用常规的三电极系统进行。经过修饰的ITO 电极作为工作电极,铂丝电极和饱和甘汞电极(SCE)分别作为对电极和参比电极。测试温度为室温,电解液为含AA(0.1 mol/L)的PBS(0.1 mol/L,pH 7.4),激发光为波长590 nm 的激光。测试模式为:黑暗10 s-光照10 s-黑暗10 s,连续测试。
2 结果与讨论
2.1 Bi2S3纳米颗粒和pH2S 探针的表征和光学性质
对制备的Bi2S3纳米颗粒和pH2S 探针进行表征,结果如图3 所示。从图3 (a)中Bi2S3的扫描电镜(SEM)图可以看出,Bi2S3纳米材料呈颗粒状结构,平均尺寸约为25 nm。图3 (b)中Bi2S3的X 射线衍射(XRD)图显示,所制备Bi2S3纳米颗粒的衍射峰位置与JCPDS# 17-0320 标准卡一致,为正交晶相Bi2S3[22],初步证实Bi2S3纳米颗粒合成成功。图3 (c)中Bi2S3的动态光散射(DLS)结果表明,Bi2S3的水合粒径约为91.3 nm,分散系数(PDI)为0.182,表明该纳米颗粒具有良好的分散性,有利于其在电极表面的均匀修饰。图3 (d)中Bi2S3和pH2S 的Zeta 电势图显示,Bi2S3纳米颗粒带负电荷,而pH2S 带正电荷,表明两者可以在电极表面通过静电作用结合。

图3 Bi2S3的SEM 图(a)、XRD 图(b)、DLS 图(c)及Bi2S3和pH2S 的Zeta 电势图(d)Fig.3 SEM image (a), XRD pattern (b)and DLS (c)of Bi2S3, Zeta potential of Bi2S3 and pH2S (d)
对Bi2S3和pH2S 的光学性质进行表征。如图4(a)所示,Bi2S3纳米颗粒在可见光区域显示出较宽的吸收范围和较强的吸收,表现出良好的光电活性;pH2S 在590 nm 处有一最大吸收峰,表明在该波长附近,pH2S 会与Bi2S3发生竞争吸收,从而减弱Bi2S3的光电流响应。进一步考察了pH2S(10 μmol/L)的光吸收以及对H2S 的响应。从图4 (b)中可以看到,在PBS 缓冲溶液(0.1 mol/L, pH 7.4, 5%EtOH)中,随着H2S 浓度的增加,pH2S 在590 nm 附近的光吸收强度逐渐减弱,也就是说,pH2S 与Bi2S3纳米颗粒之间的竞争吸收作用可通过目标物H2S 调控。这为通过目标物H2S 调控传感器的光电流响应信号提供了基础。

图4 (a)Bi2S3和pH2S 的UV-Vis 吸收光谱;(b)pH2S 与不同浓度H2S 孵育后的UV-Vis 吸收光谱Fig.4 (a)UV-Vis absorption spectra of Bi2S3 and pH2S;(b)UV-Vis absorption spectra of pH2S in the presence of the varying amount of H2S
2.2 光电化学传感器的构建过程
为了证明PEC 传感器构建成功,对其构建过程进行PEC 响应和EIS 测试。如图5 (a)所示,与裸ITO 电极(曲线1)相比,修饰Bi2S3后的ITO 电极观察到显著增强的光电流信号(曲线2),这归因于Bi2S3优异的光电活性;将pH2S 修饰在Bi2S3/ITO 表面后,光电流信号明显减弱(曲线3),这是由于在590 nm 激光照射下,pH2S 与Bi2S3竞争吸收光子能量,导致Bi2S3的激发受到抑制;当pH2S/Bi2S3/ITO与H2S 孵育后,光电流信号部分恢复(曲线4),是因为小分子探针pH2S 与H2S 发生化学反应后,pH2S在590 nm 处的吸收减弱,其与Bi2S3竞争吸收光子的能力降低,从而使Bi2S3吸收更多的光子能量增强光电流响应。上述结果证实了通过竞争吸收机制构建高选择性PEC 传感器的可行性,也初步证明了PEC 传感器的成功构建。
图5 (b)中电极的EIS 测试结果显示:相比裸ITO 电极(曲线1),由于Bi2S3的高电导率,Bi2S3/ITO 电极具有较小的阻抗值Ret(曲线2);进一步修饰了导电性较弱的pH2S 后,pH2S/Bi2S3/ITO 电极上得到了增大的Ret值(曲线3)。EIS 结果从电化学的角度进一步证实PEC 传感器构建成功。

图5 PEC 传感器的光电流响应(a)和EIS 图(b)1:裸ITO 电极;2:Bi2S3/ITO;3:pH2S/Bi2S3/ITO;4:pH2S/Bi2S3/ITO 与160 μmol/L H2S 孵育后Fig.5 Photocurrent responses (a)and EIS characterization (b)of PEC sensor 1:bare ITO, 2:Bi2S3/ITO, 3:pH2S/Bi2S3/ITO, and 4:pH2S/Bi2S3/ITO incubated with 160 μmol/L H2S
2.3 实验条件的优化
为了实现最佳的传感性能,对关键的实验条件进行了优化,包括Bi2S3浓度、pH2S 浓度以及H2S 的反应时间。如图6 所示,光电流随着Bi2S3浓度的增加而增大,但在1.0 mg/mL 时增大幅度趋于平缓,故选择1.0 mg/mL 作为Bi2S3的最佳浓度(图6(a));而对于作为竞争吸收剂的pH2S,综合考量了其对光电流信号的猝灭能力和灵敏度,最终选择100 μmol/L 作为最佳浓度(图6(b));电极与目标物H2S的反应时间结果显示,随着反应时间的增加,光电流逐渐增大,于4 min 时趋于稳定,因此,选择电极与H2S 的最佳孵育时间为4 min(图6(c))。

图6 Bi2S3的浓度(a)、pH2S 的浓度(b)和反应时间(c)对光电流的影响Fig.6 Effects of the concentration of Bi2S3(a), pH2S, (b)and the reaction time (c)on the photocurrents
2.4 光电化学传感器对H2S 的分析性能
在最佳实验条件下,研究了所构建的PEC 传感器对不同浓度H2S(10~160 μmol/L)的分析性能。随着目标物H2S(Na2S)浓度的增加,相应的光电流响应信号逐渐增强(图7(a)),且光电流信号与H2S浓度c在10~160 μmol/L 范围内呈现出良好的线性关系(图7(b)),线性回归方程为I=4.36+0.013c(R2=0.99),检出限(LOD)为4.9 μmol/L(S/N=3)。图7(b)线性曲线中各数据点来自图7(a)中各浓度下光电流曲线上第20 s 所对应的光电流值与第5 s 对应的暗电流值的之间的差值(平行测定3 组)。

图7 PEC 传感器与不同浓度H2S 反应后的光电流响应(a)及线性回归曲线(b)Fig.7 The photocurrents response (a)and calibration curve (b)of PEC sensor for detecting different concentrations of H2S 1-10:10,15,20,40,60,80,100,120,140,160 μmol/L H2S
2.5 光电化学传感器的选择性、稳定性及重现性
选择性是本研究最关注的问题,因此我们先考察了传感器对目标物H2S 的选择性。在相同的实验条件下,将PEC 传感器对H2S 的光电流响应信号与多种阴离子(Cl-、Br-、CO32-、NO3-)、含硫物种(SO42-、SO32-、S2O32-、半胱氨酸(Cys)、谷胱甘肽(GSH))和氧化性干扰物质(H2O2)等进行对比研究,以评估该传感器的选择性。如图8 所示,当体系中只存在干扰物质(1 mmol/L)时,传感器的光电流响应信号无明显变化;而体系中只有H2S(160 μmol/L)存在时,传感器的光电流响应发生明显变化,这归因于探针pH2S 对H2S 的特异性识别;当干扰物与H2S 共存时,干扰物对H2S 的检测无明显影响。上述结果表明,该PEC 传感器对H2S 具有很高的选择性,常见干扰物对其光电流信号没有影响。

图8 PEC 传感器对H2S 的选择性Fig.8 Selectivity of the PEC sensor toward H2S
稳定性和重现性是评估PEC 传感器的关键参数,对传感器的实际应用至关重要。如图9(a)所示,将PEC 传感器与160 μmol/L H2S 孵育 后,在连续10 个周期的off-on-off 光照射循环测试模式下,仍可以观察到稳定的光电流响应(相对标准偏差RSD=1.4%),表明该PEC 传感器具有较好的稳定性。此外,如图9(b)所示,同一方法制备的5 个PEC传感器在相同测试条件下获得了较好重现性(RSD=1.7%)。

图9 PEC 传感器的稳定性(a)和重现性(b)Fig.9 Stability (a)and reproducibility (b)of the PEC sensor
3 结 语
综上所述,我们发展了一种以有机小分子探针作为特异性识别单元的PEC 传感器,可用于水溶液中H2S 的高选择性检测;提出了基于竞争吸收机制的传感策略,可将小分子与目标物的识别过程转换为光电流信号的变化。该传感器还表现出较高的稳定性以及重现性,且构建步骤简单。小分子探针与目标物之间的特异性化学识别有利于传感器在复杂环境基质中对目标物的高选择性检测。该传感器的检测线性范围为10~160 μmol/L,有望用于血清中H2S(生理浓度范围为30~100 μmol/L)的高选择性检测。由于小分子探针结构灵活,通过合理的设计可与多种识别域偶联,因此该传感策略可以扩展用于其他目标物的检测,并可根据实际应用调节传感器的灵敏度和线性范围,这将极大地促进PEC 传感在不同领域的应用。
