梭梭HaNAC12转录因子抗逆功能验证
2022-09-05穆榕博周亮第姚正培任燕萍杨文艳
穆榕博,张 桦,周亮第,刘 豪,姚正培,任燕萍,王 波,马 丽,杨文艳
(新疆农业大学生命科学学院,新疆乌鲁木齐 830001)
0 引言
【研究意义】梭梭[(C.A.Mey.)Bunge]藜科(Chenopodiaceae)梭梭属()超旱生小乔木,作为我国西北荒漠区植被的主要建群种,对干旱、盐碱、高温等极端生态环境有着较强的适应能力(满玲娟,2019),不仅具有重要的生态和经济价值,还是研究植物抗逆分子机制的理想材料。NAC基因家族是植物特有的一类转录因子,不仅参与调控植物的生长和发育,而且在非生物胁迫中发挥了重要作用(Olsen et al.,2005;周丽霞和曹红星,2020)。因此,对梭梭HaNAC12转录因子进行抗逆功能验证,不仅有助于解析梭梭应对逆境因子胁迫分子机制,还为农林作物基因工程提供重要的基因资源,对梭梭及其他作物遗传改良具有重要的意义。【前人研究进展】NAC转录因子命名源于矮牵牛()NAM(No apical meristem)、拟南芥()ATAF/2和CUC2(Cupshaped cotyledon)(Souer et al.,1996)。该类转录因子具有共同的结构特点,即N端含有约150个氨基酸残基组成的高度保守NAC结构域,此区域可结合DNA和其他蛋白质,C端为可变的转录调控区域(Ernst et al.,2004)。NAC作为植物体内最大的转录因子家族之一,广泛分布于陆生植物中(李小兰等,2013),如拟南芥有117个(Riechmann et al.,2000)、烟草有152个(Xiong et al.,2005)、水稻有151个(Pinheiro et al.,2009)NAC家族成员,主要参与植物生长发育过程(李伟等,2011)。Duval等(2002)研究表明,拟南芥AtNAM蛋白在种子胚时期参与了顶端分生组织的形成。Fang 等(2015)研究表明,水稻基因表达可增强植株对干旱、高温的耐受性。丁泽红等(2016)通过转录组水平分析验证木薯NAC家族基因参与了木薯对干旱的响应。Yu等(2016)研究表明,鹰嘴豆基因通过调控下游逆境相关基因表达量从而增强了植株抗旱性。Yang等(2018)研究表明,芒草基因通过调节植株对植物激素ABA的敏感度从而正调控植株对干旱和盐胁迫的响应。Chung等(2018)通过Chip-Seq和RNA-Seq分析结果显示,水稻中过表达后通过激活根特异性启动子RCc3改变植株根系结构,从而提高植株的抗旱能力。So和Lee(2019)在拟南芥中过表达大豆基因可增强了植株耐旱性。Jia等(2020)研究发现,苹果基因通过调节光合作用强度来增强抗氧化酶活性,导致植株耐旱性增强。Wang等(2020)研究发现,烟草中过表达明百合花基因后植株耐盐性上升,但耐旱性下降。陈文烨等(2020)研究发现,小麦基因可能参与响应高盐、渗透和冷胁迫等逆境胁迫。本研究课题组基于梭梭干旱转录组测序结果已克隆差异表 达NAC 基因,如(李志强等,2016)、(宗兴风等,2019)、(周亮第等,2021)、(伍霞,2021),并对其功能进行研究,结果发现这些基因均参与植株响应非生物胁迫,并提高了植物抵御非生物胁迫的能力。【本研究切入点】虽然已有研究证实HaNAC12转录因子与拟南芥ANAC082和ANAC103亲缘关系更近,同属于NAC2亚家族(李志强,2016),且该亚族中代表基因(Ohbayashi et al.,2017)与(Yamaguchi et al.,2015)被证明参与了植株对干旱等非生物胁迫的响应,因此,推测基因同样参与非生物胁迫响应。但目前未见隆基因克隆及功能验证的研究报道。【拟解决的关键问题】通过实时荧光定量PCR检测基因在干旱、高盐和脱落酸(ABA)处理下的表达模式分析。利用同源重组法、农杆菌介导喷花法、喷洒除草剂等方法构建并筛选转基因拟南芥阳性株系,在不同胁迫处理后测定其与野生型(WT)在萌发率、气孔开度、相对含水量、株高、生长速率和生理指标等方面的差异,分析基因在逆境胁迫下的抗逆功能,以期解析梭梭响应逆境胁迫的分子机制,为梭梭及其他作物抗逆遗传改良提供理论参考。
1 材料与方法
1.1 试验材料
供试材料梭梭种子采自新疆古尔班通古特沙漠。拟南芥种子由新疆农业大学农学院农业生物技术重点实验室繁存。农杆菌菌株GV3101为新疆农业大学生命科学学院植物生物技术实验室保存。Trazol-up、Fly DNA聚合酶、Trans-T1大肠杆菌感受态细胞、pEASY Blunt-Zero克隆载体、T4 DNA Ligase和DNA Marker均购于北京全式金生物技术有限公司。琼脂糖凝胶回收试剂盒和RNase A购于南京诺维赞生物科技有限公司。荧光定量试剂盒和反转录试剂盒购于加拿大ABM生物科技有限公司。试验所用卡那霉素、庆大霉素、吗啉乙磺酸(MES)、乙酰丁香酮、MgCl等化学试剂均为国产分析纯。引物合成和DNA测序均由上海生工生物技术有限公司完成。丙二醛、过氧化氢、脯氨酸含量测定试剂盒和过氧化氢酶测定试剂盒购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 样品处理 筛选颗粒饱满的梭梭种子,使用100% NaClO溶液涡旋清洗30 s,浸泡5 min,用75%乙醇溶液涡旋清洗30 s,浸泡2 min,用无菌水涡旋浸泡洗涤6次,将梭梭种子移入装有1/2 MS培养基的组培瓶中培养,培养至梭梭幼苗同化枝长度约10 cm,25 ℃条件下进行模拟干旱处理(20% PEG 6000溶液)、高盐处理(200 mmol/L NaCl溶液)、(ABA)处理(100 μmol/L ABA溶液)。以正常生长的植株为对照。
1.2.2 胁迫下基因表达分析 使用Primer 5.0设计基因的特异性引物(表1),并由生工生物工程有限公司合成。RNA提取及实时荧光定量PCR检测方法参考Wang(2018)的方法。
1.2.3转基因拟南芥阳性植株筛选 根据基因编码区(CDS)设计含有I、E II酶切位点引物N12-3301-F/N12-3301-R(表2),用于扩增同源重组目的片段。通过同源重组法构建pCAMBIA3301-植物表达载体,利用冻融法转化农杆菌GV3101。利用农杆菌介导喷花法将含有基因完整CDS的过表达载体转染WT,收种种子记为T代。通过喷洒1/3000除草剂筛选T代转基因拟南芥,并对存活植株进行收种,种子记为T代,使用MS筛选培养基(0.033%除草剂+MS)培养T代转基因植株。使用SPSS 24.0对其萌发率进行卡方检验,>0.05视为符合孟德尔遗传定律。将符合孟德尔遗传定律转基因植株移至营养土(草炭∶蛭石=2∶1)中培养至收种,种子记为T代;通过实时荧光定量PCR从T代植株中筛选得到3个表达量最高的株系记为T代,用于后续试验,具体操作参考满玲娟(2021)的方法。

1.2.4转基因拟南芥萌发率测定 选用同批收种WT与T代转基因拟南芥作为材料,分别点种54粒在MS培养基、MS+200 mmol/L甘露醇、MS+200 mmol/L NaCl固体培养基中,春化3 d后正常培养。每个处理设置3个重复,以露白为统计标准,每隔24 h统计正常培养基和胁迫培养基中种子萌发数目,再根据种子萌发率(%)=种子露白数/种子总数×100,计算各株系种子萌发率。
1.2.5 不同胁迫下表型和生理指标测定 将同批收种WT与T代转基因拟南芥在MS培养基中培育10 d后转移至营养土中进行培养,待培养至4周龄后选择生长状况一致的拟南芥植株分别进行干旱胁迫(充分浇足水后进行自然干旱)和高盐胁迫(200 mmol/L NaCl溶液浇灌植株),以正常生长的植株为对照。胁迫后分别对植株表型进行拍照记录并对比,然后测量各株系在不同处理下的丙二醛、过氧化氢和脯氨酸含量,以及过氧化氢酶活性。测定方法参考丙二醛、过氧化氢、脯氨酸含量测定试剂盒和过氧化氢酶测定试剂盒说明进行。
1.2.6 气孔开度和相对含水量测定 使用Motic BA400光学显微镜观察气孔开度,并使用Motic Image Advanced 3.2进行拍照,使用Image J对气孔开度进行测量;选取1.2.5中种植的干旱胁迫后的植株,使用软刷将其从土壤中剥离,分别测量鲜重、饱和鲜重以及干重,再根据相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)×100,计算各株系植株的相对含水量。
1.3 统计分析
采用Excel 2007进行数据处理,使用SPSS 24.0进行单因素方差分析(ANOVA),LSD算法对其显著性进行分析,使用Prism 8.0进行作图。
2 结果与分析
2.1 不同胁迫处理下梭梭HaNAC12基因表达分析结果
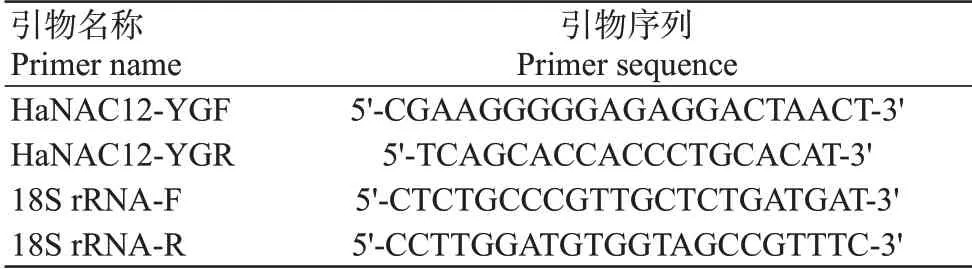
采用实时荧光定量PCR检测基因在模拟干旱(20% PEG 6000)、高盐(200 mmol/L NaCl溶液)、ABA(100 mmol/L ABA溶液)处理下的表达情况,结果如图1所示。在干旱胁迫下,基因相对表达量在处理12 h时极显著高于处理0 h(未胁迫)(<0.01,下同),约为0 h相对表达量的4.5倍,于处理24 h时恢复至正常水平。高盐胁迫下,基因相对表达量整体呈先升高后降低的变化趋势,处理1 h时相对表达量极显著高于处理0 h,而后开始下降。ABA处理下,基因相对表达量在处理3和12 h显著高于处理0 h(<0.05,下同)。综上所述,基因能响应干旱、盐和ABA信号。
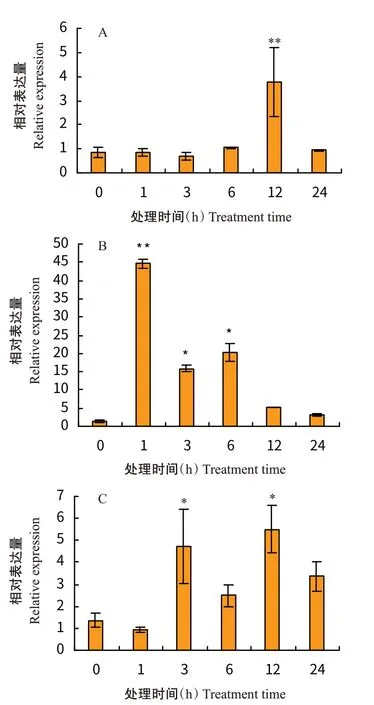
2.2 HaNAC12转基因拟南芥阳性植株筛选
利用喷洒除草剂对T代转基因拟南芥进行初步筛选,结果图2-A所示。将T代收获的种子记为T代,并重新种植在含有0.033%除草剂的MS培养基上,培养8 d后对其成活率进行计数,计数结果符合孟德尔遗传定律3∶1分离比(图2-B)。以存活的拟南芥莲座叶为材料,对其载体上特异性片段及目的基因特异性片段进行扩增,结果显示存活的拟南芥中重组载体均稳定表达(图2-C)。采用实时荧光定量PCR筛选转基因拟南芥T代,筛选出3 个高表达量的株系HaNAC12-1、HaNAC12-2和HaNAC12-3(图3)。
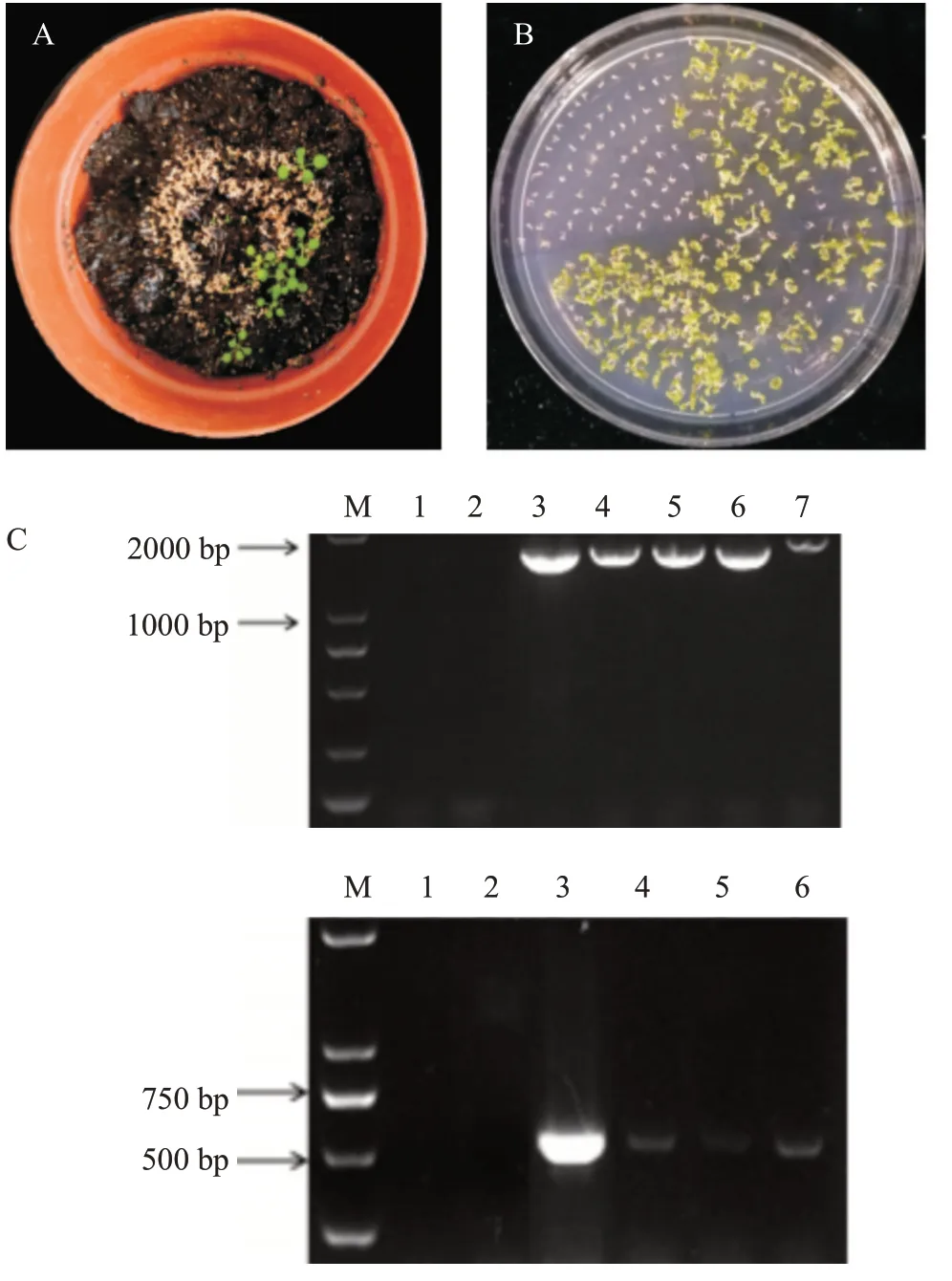

2.3 HaNAC12转基因拟南芥萌发率测定结果
将WT和不同纯合株系转基因拟南芥分别播种在MS培养基、MS+200 mmol/L甘露醇胁迫培养基和MS+200 mmol/L NaCl盐胁迫培养基上,观察拟南芥在不同处理下的生长情况,并定期统计拟南芥萌发率,结果如图4所示。正常情况下,HaNAC12-1、HaNAC12-2和HaNAC12-3的最终萌发率分别为86.11%、90.00%和89.44%,与WT(81.11%)无显著差异(>0.05)(图4-A)。200 mmol/L甘露醇模拟的干旱胁迫处理下,WT、HaNAC12-1、HaNAC12-2 和HaNAC12-3的最终萌发率分别为45.00%、66.11%、80.56%和85.00%(图4-B)。200 mmol/L NaCl 的盐 胁 迫处理下,WT、HaNAC12-1、HaNAC12-2和HaNAC12-3的最终萌发率分别为36.42%、49.38%、51.23%和58.64%,于高盐胁迫3 d萌发率出现极显著差异,并保持极显著差异至试验结束(图4-C)。综上所述,转基因拟南芥在萌发期对干旱和盐胁迫具有更强的耐受性。
2.4 不同胁迫下HaNAC12转基因拟南芥生长情况分析结果
将正常培养4周龄的转基因拟南芥和WT分别进行自然干旱和高盐胁迫,胁迫后观察不同胁迫处理下的拟南芥表型,结果发现,对照组WT和转基因拟南芥生长状态基本保持一致(图5-A);自然干旱15 d后,WT出现明显的干枯现象,转基因拟南芥各株系出现脱水现象,但未出现干枯(图5-B);高盐胁迫7 d后,WT出现明显枯黄现象,转基因株系12-1和12-2出现轻微枯黄,转基因株系12-3植株整体仍保持绿色(图5-C),说明转基因在生长发育阶段对干旱和盐胁迫具有更强的耐受性。

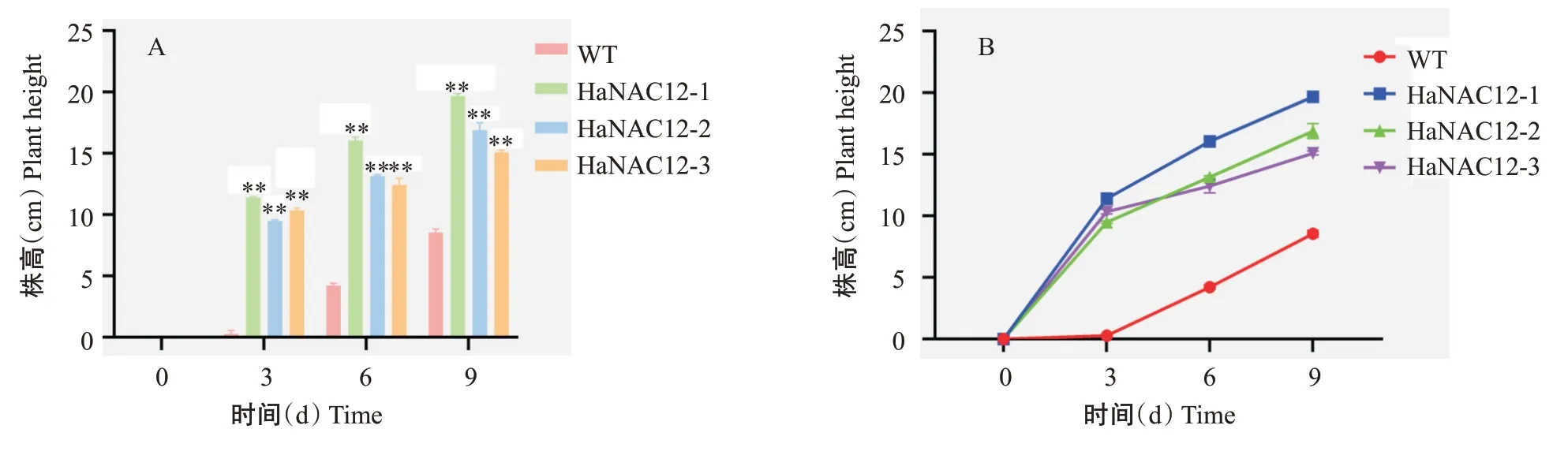
此外,在干旱胁迫下3个转基因拟南芥株系均出现了提前抽薹、早花等生殖发育加速现象(图6),分别于胁迫3 、6 和9 d后对转基因株系进行株高测量,结果(图7-A)显示,干旱胁迫3 d时HaNAC12-1、HaNAC12-2和HaNAC12-3株系的平均株高分别为11.3、9.4和10.3 cm,WT的平均株高为0.3 cm;干旱胁迫6 d时WT出现抽薹现象,平均株高为4.2 cm。基于株高测量数据计算各株系生长速率,结果(图7-B)显示,转基因株系在干旱胁迫0~3 d时生长速率最快,3~9 d时生长速率逐渐降低,WT在干旱胁迫0~3 d时生长速率接近0,说明在干旱胁迫处理下,转基因拟南芥生殖生长速度明显高于WT。

2.5 干旱胁迫下HaNAC12转基因拟南芥气孔开度和相对含水量分析结果
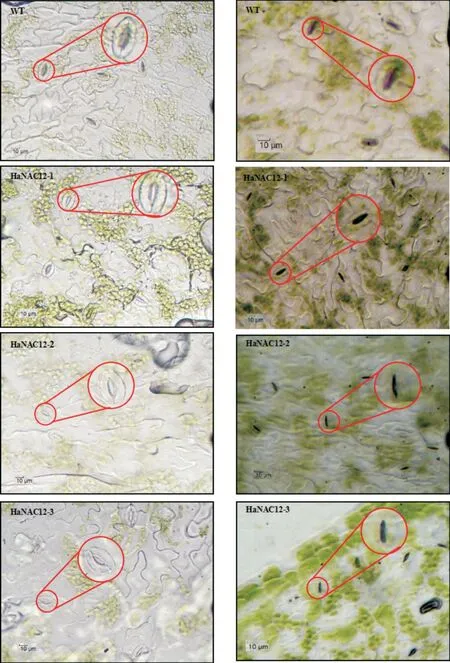
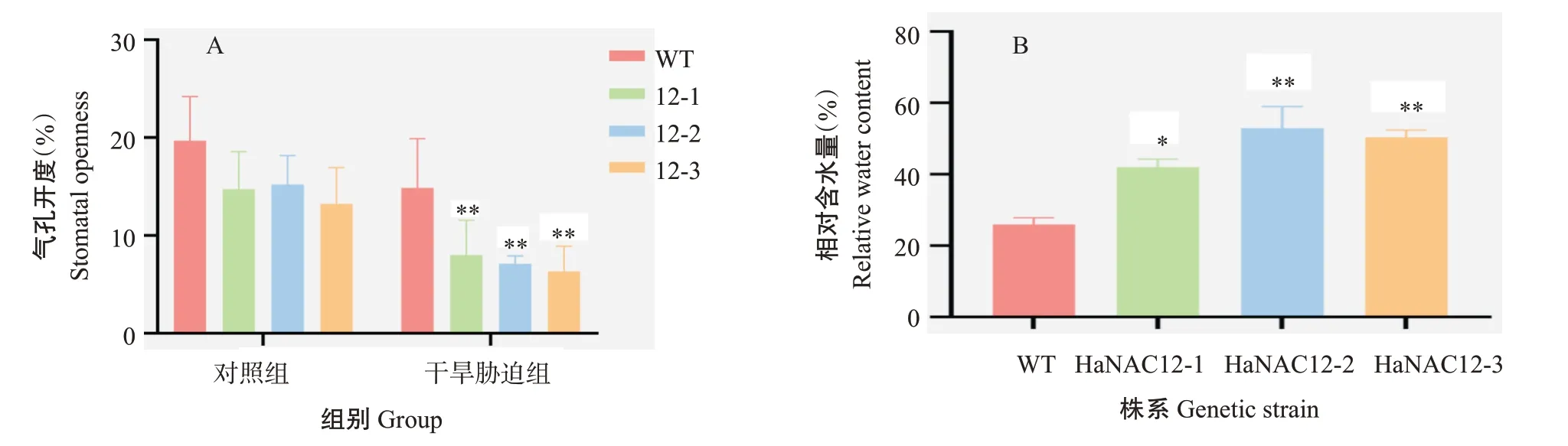
采集自然干旱胁迫10 d和对照组(正常浇水培养)拟南芥新鲜莲座叶下表皮,在显微镜下观察其下表皮气孔情况(图8),并测量其气孔开度,结果如图9-A所示。对照组中WT、HaNAC12-1、HaNAC12-2和HaNAC12-3的气孔开度平均值分别为29.14、26.76、28.17和27.74 μm,转基因株系与WT之间无显著差异。干旱胁迫组中WT、HaNAC12-1、HaNAC12-2和HaNAC12-3的气孔开度平均值分别为9.46、2.38、4.75和4.15 μm,其中,HaNAC12-1和HaNAC12-3的气孔开度与WT存在极显著差异,HaNAC12-2的气孔开度与WT存在显著差异。干旱胁迫组WT的气孔开度比对照组WT 缩小67.54%,干旱胁迫组HaNAC12-1的气孔开度比对照组HaNAC12-1缩小91.08%,干旱胁迫组HaNAC12-2的气孔开度比对照组HaNAC12-2缩小83.14%,干旱胁迫组HaNAC12-3的气孔开度比对照组HaNAC12-3缩小85.04%。
对干旱胁迫后对植株进行相对含水量测定,结果(图9-B)显示WT相对含水量为26.19%,HaNAC12-1的相对含水量显著高于WT,HaNAC12-2、HaNAC12-3的相对含水量极显著高于WT。
2.6 不同胁迫下HaNAC12转基因拟南芥生理指标测定结果
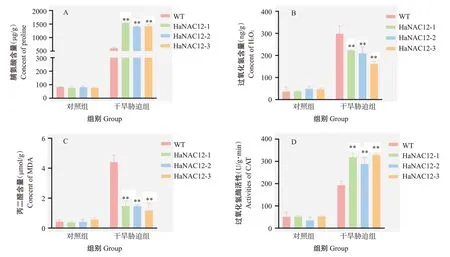
2.6.1 干旱胁迫对拟南芥生理指标的影响 对对照组和干旱胁迫组的植株莲座叶进行生理指标测定,并计算胁迫前后各生理指标的变化情况,结果如图10所示。对照组中HaNAC12-1、HaNAC12-2和HaNAC12-3株系的脯氨酸含量与WT无显著性差异,干旱胁迫组中3个转基因株系的脯氨酸含量分别上升1545.53、1401.21和1419.98 μg/g,极显著高于WT的上升量(607.06 μg/g)(图10-A)。对照组中3个转基因株系的过氧化氢含量与WT无显著性差异,干旱胁迫组3个转基因株系的过氧化氢含量分别上升222.59、209.51和162.29 ng/g,极显著低于WT的上升量(298.92 ng/g)(图10-B)。丙二醛含量测定结果与过氧化氢含量测定较相似,干旱胁迫组中3个转基因株系的胁迫前后丙二醛含量变化量极显著低于WT(图10-C)。对照组中3个转基因株系的过氧化氢酶活性与WT无显著性差异,干旱胁迫组中3个转基因株系的过氧化氢酶活性上升318.96、288.12和328.96 U/(g·min),极显著高于WT的上升量[192.92 U/(g·min)](图10-D)。综上所述,转基因拟南芥株系具有更强的抗旱性。
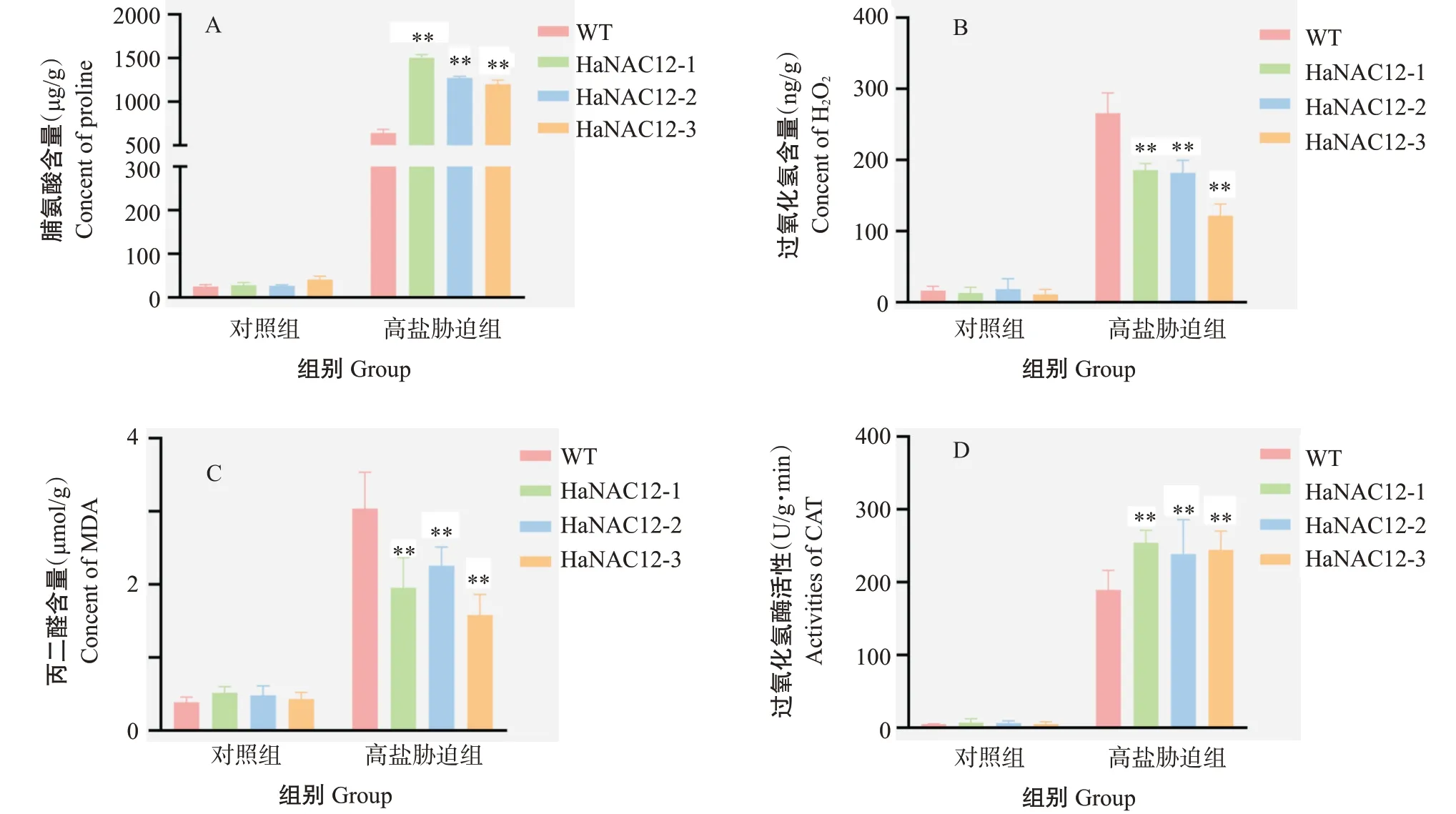
2.6.2 盐胁迫对拟南芥生理指标的影响 对对照组和高盐胁迫组的植株莲座叶进行生理指标测定,并计算胁迫前后各生理指标的变化情况,结果如图11所示。对照组中HaNAC12-1、HaNAC12-2和HaNAC12-3株系的脯氨酸含量与WT无显著性差异,高盐胁迫组中3个转基因株系的脯氨酸含量分别上升1504.97、1271.80和1200.33 μg/g,极显著高于WT的上升量(640.73 μg/g)(图11-A)。对照组中3个转基因株系的过氧化氢含量与WT无显著性差异,高盐胁迫组3个转基因株系的过氧化氢含量分别上升185.94、181.98和121.73 ng/g,极显著低于WT的上升量(265.85 ng/g)(图11-B)。对照组中3个转基因株系的丙二醛含量与WT无显著性差异,高盐胁迫组3个转基因株系的丙二醛含量分别上升1.96、2.25和1.80 μmol/g,极显著低于WT上升量(3.04 μmol/g)(图11-C)。对照组中3个转基因株系的过氧化氢酶活性与WT无显著性差异,高盐胁迫组3个转基因株系的过氧化氢酶活性分别上升254.70、283.54和244.38 U/(g·min),极显著低于WT的上升量[189.58 U/(g·min)](图11-D)。综上所述,转基因拟南芥具有更强的盐胁迫抗性。
3 讨论
一个特定的NAC转录因子往往同时涉及多个发育或应对多个逆境因子胁迫过程。在过表达黄麻基因的植株生长明显加快,出现了早花现象,并且转基因株系的抗旱性显著高于WT(Zhang et al.,2021)。拟南芥NAC家族基因被证明不仅参与了植株生长发育过程,过表达后还增加植株对灰霉菌的抗病性(Wang et al.,2009)。梭梭长期生活在荒漠、半荒漠环境,是研究植物抗逆分子机制的理想材料,对梭梭NAC转录因子基因已有报道,如基因过表达可增强植株对干旱、盐、低温胁迫抗性(韩聚东,2016);基因过表达可增强植株对干旱、盐、高温胁迫抗性(宗兴风等,2019;伍霞,2021);过表达可憎强植株对高盐和高温的耐受性(伍霞,2021),说明梭梭中不同NAC转录因子在提高植物抗逆性上存在差异。本研究结果显示,基因受干旱、盐和ABA 3种外界胁迫信号诱导后过表达,导致转基因拟南芥株系对干旱和盐的抗性较WT明显增强,且在自然干旱胁迫下莲座叶下表皮气孔开度较WT显著减小,成苗干旱和盐胁迫后植株脯氨酸含量大幅度升高。根据脯氨酸的生物学功能(彭志红等,2002),推测基因通过调节植物细胞渗透压从而增强植株对干旱和盐胁迫抗性,结合荧光定量PCR检测结果和生理生化指标测定结果,推测基因与其同亚族基因作用相近,均通过调节植物ABA信号通路从而增加植株对于干旱和盐的抗性(Yamaguchi et al.,2015),其具体的下游调控网络还需通过进一步试验进行验证。
本研究系统进化分析结果显示,HaNAC12转录因子属于NAC2亚族(李志强,2016)。拟南芥中NAC2亚族代表基因(和)被证明参与了植株营养器官生长发育的调节(Morishita et al.,2009);()通过调节植株叶片中的活性氧从而增加植株的抗旱性(Yabuta et al.,2011)。除拟南芥外其他植物中NAC2亚族转录因子也被证实与植物非生物胁迫抗性有关,如刚毛柽柳ThNAC24通过维持细胞膜完整性增加植株对
于盐和干旱胁迫的耐受性(卢惠君等,2019);辣椒基因对干旱胁迫产生响应(赖燕,2011)。但目前极少有研究证实,NAC2亚族基因在受到非生物胁迫后会增加植株生殖发育速度,仅大豆(Pimenta et al.,2016)和番茄(Zhang et al.,2021)受到非生物胁迫后植株出现了生殖发育提前的现象。本研究也发现,转基因拟南芥株系过表达基因后在干旱胁迫下出现了生殖发育提前的生理表型。关于NAC转录因子影响植株生殖发育的研究报道中,以NAC转录因子推迟生殖发育速度的结论居多,如NTL8(ANAC075)(Fujiwara and Mitsuda,2016)、PwNAC2(Liu et al.,2011)等。因此,今后还需对基因对植株生殖发育和非生物胁迫响应的调控机制作深入研究。
4 结论
拟南芥过表达基因可增强植株在萌发期和苗期对干旱和盐胁迫的抗性,干旱胁迫后可促进拟南芥开花,说明基因可提高转基因拟南芥的抗旱和耐盐性。
