生驼乳中金黄色葡萄球菌的分离鉴定与耐药性分析
2022-09-03欧秀玲蔡扩军
欧秀玲,蔡扩军 ,徐 敏
1 新疆华博检测技术有限公司,新疆乌鲁木齐 8300002 新疆农业大学动物医学学院,新疆乌鲁木齐 8300523 乌鲁木齐市动物疾病控制与诊断中心,新疆乌鲁木齐 8300634 乌鲁木齐市奶业协会,新疆乌鲁木齐 830063
0 引言
金黄色葡萄球菌(Staphylococcus aureus,SA)是一种普遍存在于外界环境中的致病菌[1],既对食品卫生安全及人类健康造成严重的威胁[2],也可引起哺乳动物的乳房炎,使产奶量和奶品质下降[3]。近年来,随着生驼乳中多种生物学活性物质被不断发现,驼乳的医学保健功能得到了人们的认可,驼乳的需求量激增,骆驼养殖数量迅速增加,带动了骆驼产业的发展。但驼乳与其他动物乳的饮用方式不同,当地牧民一般不经煮沸,而将生驼乳直接发酵成酸驼乳饮用,因此,对生驼乳中致病微生物的研究具有重要的公共卫生学意义。本研究对养殖环节生驼乳中的金黄色葡萄球菌进行分离与鉴定,并对其耐药性进行分析,为保证生驼乳的质量安全提供参考。
1 材料与方法
1.1 主要试剂
7.5%氯化钠肉汤,北京陆桥技术股份有限公司;金黄色葡萄球菌显色培养基,法国科玛嘉CHROMagar公司;大豆酪蛋白琼脂培养基(TSA),美国BD公司;药敏片,杭州滨和微生物试剂有限公司;革兰氏染色液,珠海贝索生物技术有限公司。
1.2 主要仪器
全自动微生物检定仪(VITEK2)及配套的微生物生化鉴定卡,法国梅里埃公司;生物安全柜,上海力申科学仪器有限公司;显微镜,赛默飞世尔科技公司;恒温摇床(TH2-92B),上海博讯医疗生物仪器股份有限公司;恒温培养箱(BPC-250F),上海一恒科学仪器有限公司;电子天平(FA2104N),上海精密科学仪器有限公司。
1.3 金黄色葡萄球菌的分离、鉴定
1.3.1 样品采集
对驼乳乳头进行消毒,弃去前三把奶,用无菌采样袋采集300 mL生驼乳,放入含有冰袋的运输箱,低温运输至实验室。
1.3.2 检验程序
参考《GB 4789.10—2016食品安全国家标准 食品微生物学检验》金黄色葡萄球菌检验制定检验程序[4]。具体见图1。
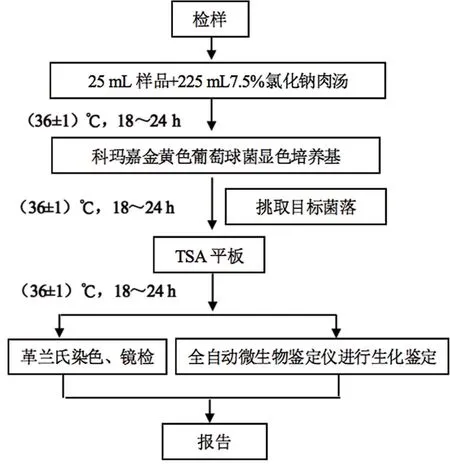
图1 金黄色葡萄球菌检验程序
1.3.3 操作步骤
(1)样品的处理及增菌
量取25 mL生驼乳于225 mL 7.5%氯化钠肉汤中,振荡混匀,(36±1)℃恒温培养箱中培养18 ~24 h。
(2)分离
用无菌接种环取培养好的增菌液,连续划线接种于科马嘉金黄色葡萄球菌显色培养基,并观察菌落生长、形态、显色情况。
(3)纯化
从金黄色葡萄球菌显色培养基上轻轻挑取一个目标菌落,再次划线接种于大豆酪蛋白琼脂培养基(TSA)平板上进行纯化。
(4)革兰氏染色镜检
从大豆酪蛋白琼脂培养基(TSA)平板上挑取疑似菌落涂片固定,按照革兰氏染色液试剂盒说明书中初染、媒染、脱色、复染等四个步骤进行革兰氏染色,并用显微镜镜检。
(5)全自动微生物鉴定仪进行生化鉴定
根据革兰氏染色情况,挑取TSA平板上的疑似菌落,选择革兰氏阳性细菌鉴定卡,用VITEK-2全自动微生物鉴定仪进行鉴定。
2 结果
2.1 金黄色葡萄球菌的分离、鉴定
2.1.1 显色培养基上菌落颜色及形态
金黄色葡萄球菌在科马嘉金黄色葡萄球菌显色培养基上呈现粉红色光滑菌落,如图2。
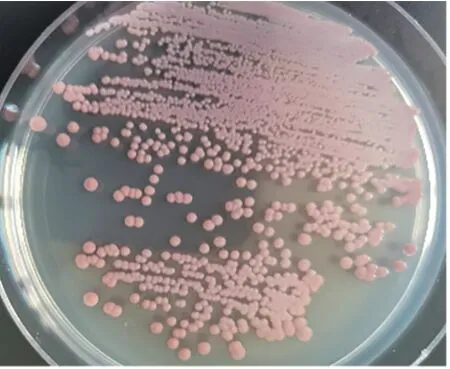
图2 金黄色葡萄球菌在显色培养基上的菌落形态
2.1.2 革兰氏染色镜检
从平板上挑取疑似菌落进行革兰氏染色,染色结果显示,金黄色葡萄球菌为革兰氏阳性菌,显微镜下呈葡萄状排列,无芽胞,无荚膜,直径为0.5 ~1.0 μm(4×100 倍,图3)。
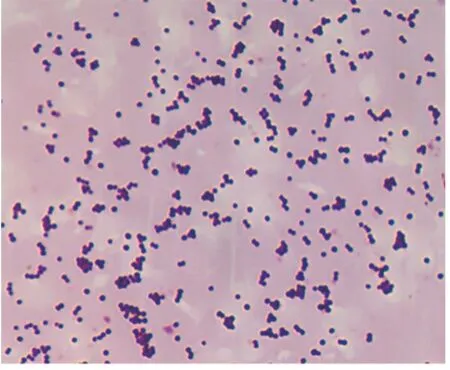
图3 金黄色葡萄球菌镜检
2.1.3 VITEK-2全自动微生物鉴定仪进行生化鉴定
利用VITEK-2全自动微生物鉴定仪对可疑菌落进行鉴定,结果显示,共鉴定出的8 株阳性金黄色葡萄球菌;生化结果显示:分离阳性菌株对精氨酸双水解酶1、β-D-半乳糖苷酶、磷酸酶、焦谷氨酸芳胺酶、多粘菌素B耐受、D-半乳糖、L-乳酸盐等生化反应呈阳性,对磷脂酰磷脂酶C、D-木糖、α-葡萄糖苷酶、环式胡精、α-甘露糖苷酶等生化反应呈阴性(表1)。
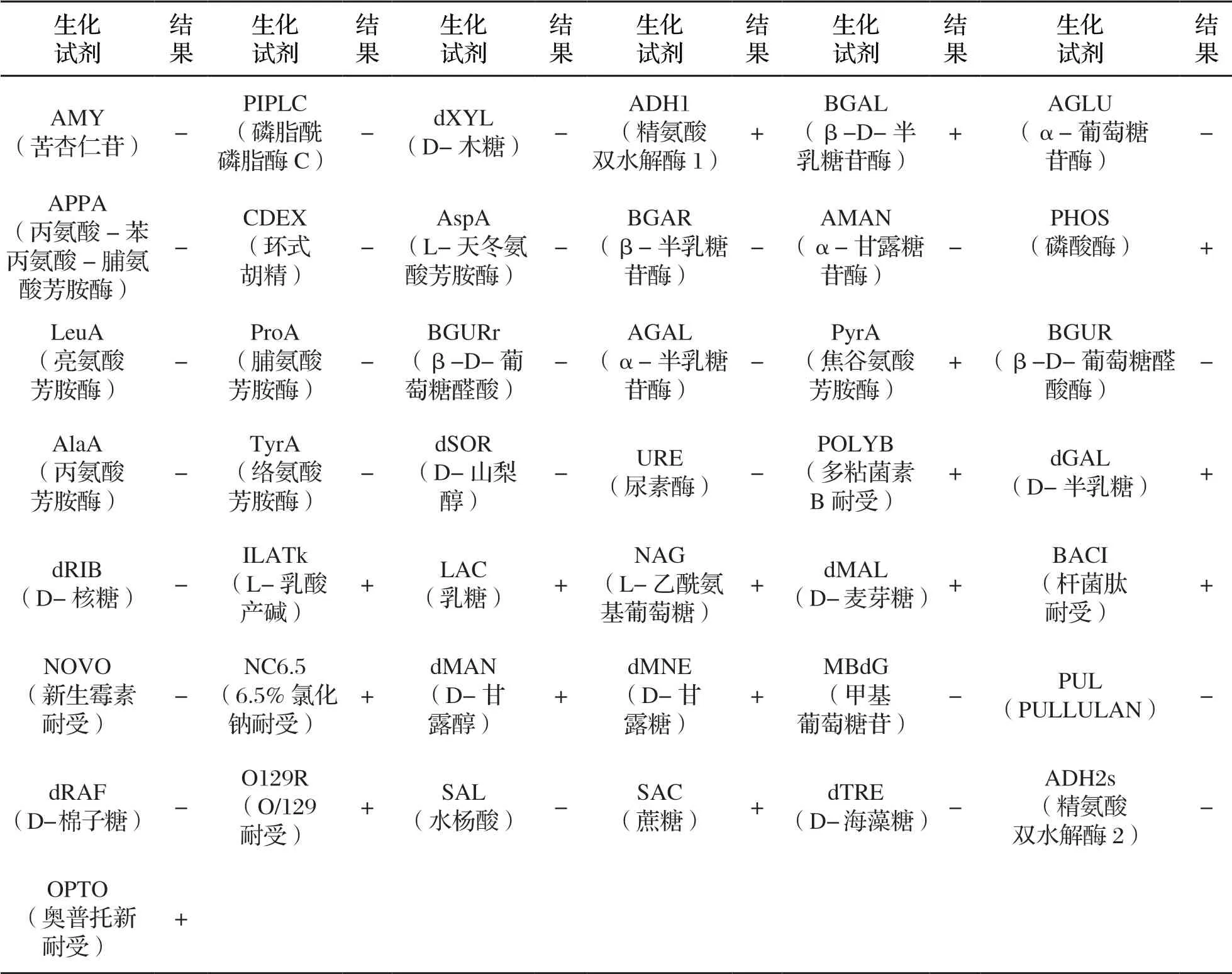
表1 金黄色葡萄球菌全自动微生物鉴定仪生化鉴定结果
2.2 药敏试验结果
对分离的8 株金黄色葡萄球菌菌株利用纸片扩散法进行药敏试验,结果显示,8 株菌株对青霉素耐药率达75%;对氧氟沙星敏感率最高,可达100%;对头孢哌酮钠、环丙沙星敏感性较高,敏感率可达87.5%;对链霉素、卡那霉素、阿莫西林、头孢唑啉和头孢西丁,四环素、氯霉素、头孢噻肟、林可霉素、苯唑西林、庆大霉素较敏感,敏感率在37.5 %~75.0 %之间。见表2。
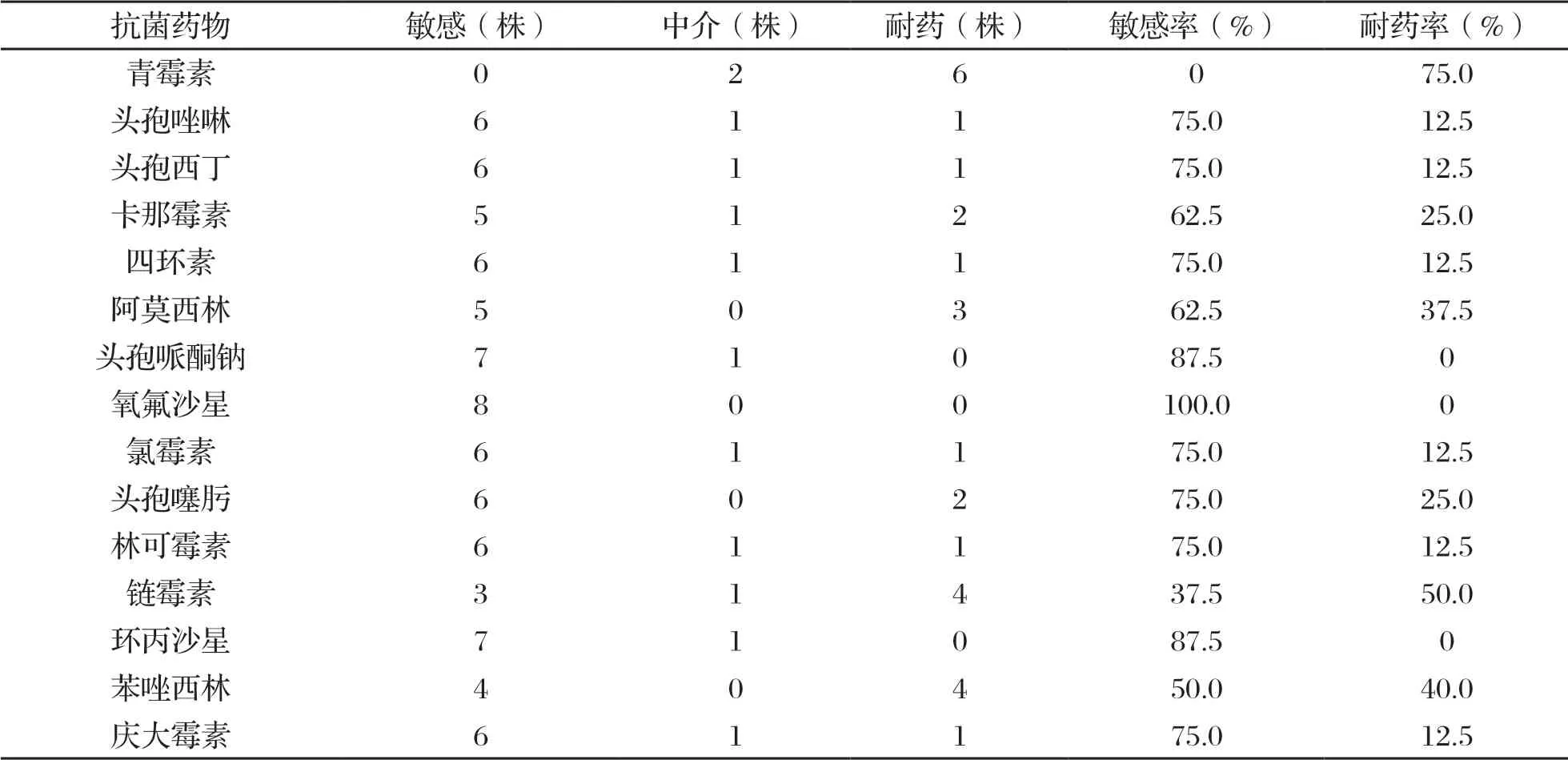
表2 金黄色葡萄球菌的药敏试验
3 讨论和结论
驼乳被誉为“沙漠白金”,具有独特的营养价值和功能。目前对驼乳的研究主要集中于其功能的研究和其有益菌的分离与鉴定。蔡瑞丽[5]和王瑞[6]的研究中均发现驼乳可防治2型糖尿病;徐德洲等[7]的研究发现,驼乳还对急性酒精肝损伤有一定的防治功效;努尔古丽·热合曼[8]从酸驼乳中可分离出优势的乳酸菌株;任冬艳等[9]利用常规分离结合16s rRNA测序技术也分离和鉴定出驼乳中的乳酸杆菌菌株。
金黄色葡萄球菌是引起骆驼乳房炎的主要病原菌之一,危害骆驼健康,降低驼乳的产量和品质[10]。本研究对驼乳中分离的金黄色葡萄球菌进行耐药性分析发现,与牛乳中分离的金黄色葡萄球菌相比,其耐药性较低,可能与骆驼平时很少用药有关[11]。药敏试验表明,青霉素耐药率最高,氧氟沙星、环丙沙星、头孢哌酮钠、头孢唑啉、头孢西丁、头孢噻肟敏感性较高,可用于本地区由金黄色葡萄球菌引起骆驼乳房炎的治疗。
