肥厚型梗阻性心肌病患者室间隔乙醇消融与心肌切除术后心电图变化
2022-09-03曹城玮程梓萌蒙绪良赵海娟黄松群黄新苗
赵 耀, 张 芹, 曹城玮, 程梓萌, 蒙绪良, 赵 腾, 张 敏, 赵海娟,李 珂, 黄松群, 黄新苗
肥厚型心肌病是以心肌显著肥大和左心室腔缩小为特征的遗传性疾病[1-2]。肥厚型梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM)可引起左心室流出道梗阻, 并常使二尖瓣收缩期前移,导致二尖瓣反流并加重梗阻,是年轻运动员心源性猝死最常见原因[3]。 室间隔心肌切除术(surgical septal myectomy,SSM)是治疗伴有严重症状的药物难治性HOCM 金标准[1,4]。室间隔乙醇消融术(alcohol septal ablation,ASA)经导管消融冠状动脉室间隔支,在室间隔基底部形成局部梗死灶,逐渐成为外科手术替代方法[4-7]。两种术式通过切除或消融部分室间隔心肌组织减轻左心室流出道梗阻,同时会损伤相邻束支,造成束支传导阻滞、室内传导阻滞,甚至高度房室传导阻滞[8-10]。 另外,两种术式会损伤室间隔不同部分,造成术后心电图(ECG)差异。本研究探讨HOCM 患者行SSM 与ASA 后ECG 差异。
1 材料与方法
1.1 临床资料
收集2010 年1 月1 日至2020 年12 月31 日上海长海医院收治的HOCM 患者临床资料。诊断依据《2014 年欧洲心脏病学会(ESC)肥厚型心肌病诊断及管理指南》[2]:①超声心动图示非对称性室间隔肥厚≥1.5 cm;②室间隔与左心室后壁厚度之比≥1.5,且有收缩期前移现象;③左心室流出道压差静息状态≥30 mmHg(1 mmHg=0.133 kPa),或激发状态≥50 mmHg。 符合手术指征并接受ASA 或SSM 患者共有252 例,排除160 例缺失术前或术后随访3 个月以上ECG 患者。 入选92 例,其中ASA 组43 例,男18 例,女25 例;SSM 组49 例,男19 例,女30 例。两组患者均具有术前和手术3 个月后标准12 导联ECG 资料。
1.2 ECG 分析
采用标准测量法分析患者住院期、门诊和外院ECG 资料,并由2 名高年资主治医师进行诊断。 重点关注同一患者手术前后ECG 变化,如新出现的房室传导阻滞或束支传导阻滞等。
1.3 统计学方法
采用SPSS 23.0 软件进行统计学分析。 正态分布计量资料以±s表示,组间比较用两独立样本t 检验;计数资料以n(%)表示,组间比较用χ2检验或Fisher 精确概率法。 P<0.05 为差异有统计学意义。
2 结果
2.1 两组基线资料及术前ECG 比较
两组HOCM 患者间年龄、性别、糖尿病史、冠心病史、脑卒中史、家族史、吸烟史、饮酒史、左心室射血分数、左心房直径、室间隔厚度、左心室后壁厚度等参数差异无统计学意义(均P>0.05);高血压史(P=0.015)、左心室流出道压差(P=0.023)差异有统计学意义,见表1。 两组术前ECG 资料差异无统计学意义(均P>0.05),见表2。
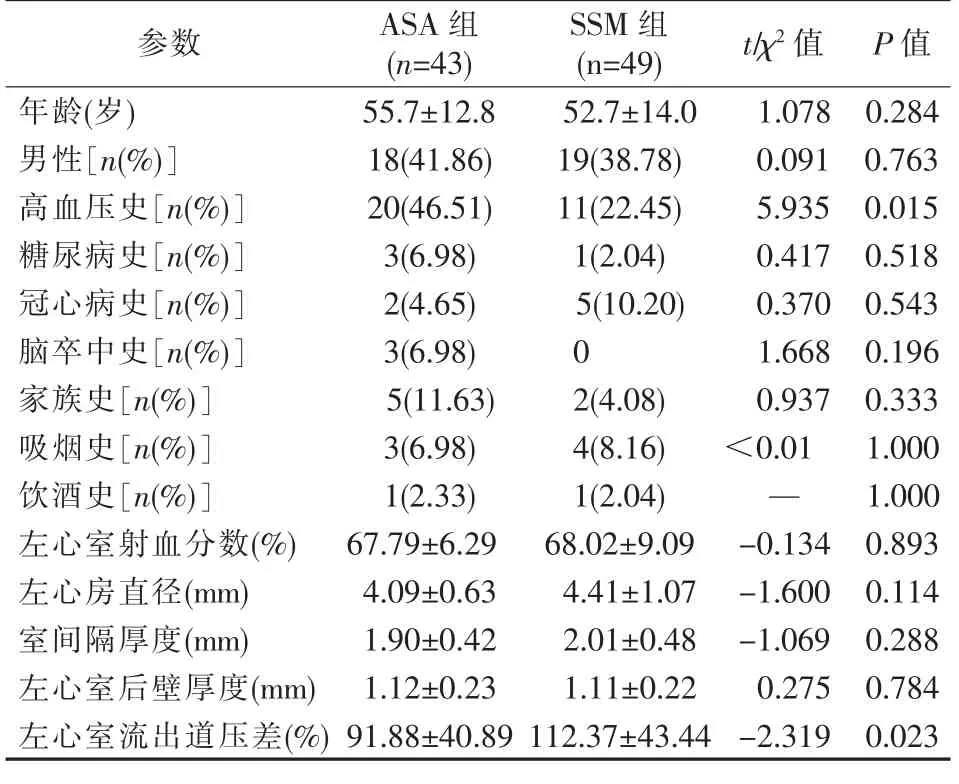
表1 两组患者基线资料比较
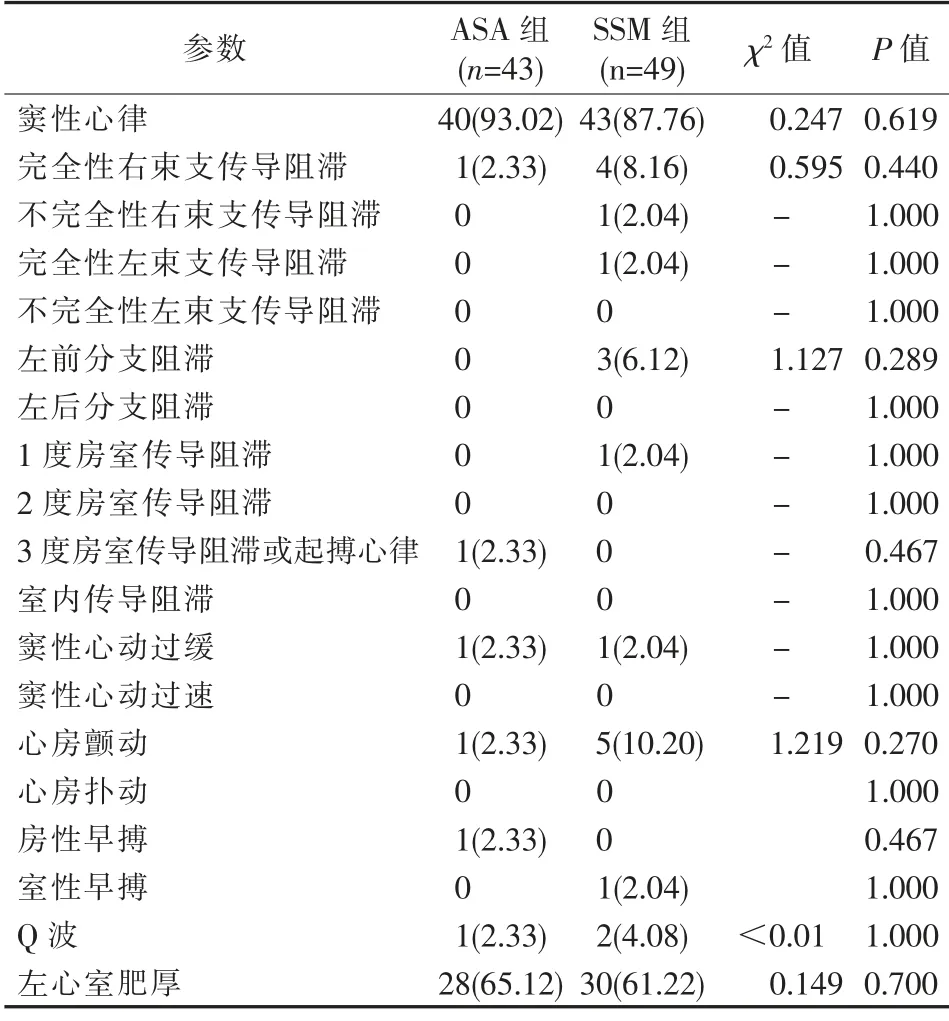
表2 两组患者术前ECG 比较 [n(%)]
2.2 两组术后ECG 变化
ASA 组、SSM 组分别随访(35.19±26.99)个月和(27.57±25.05)个月(t=1.403,P=0.164)。 术后3 个月ECG 随访结果显示,ASA 组、SSM 组间新发完全性右束支传导阻滞、完全性左束支传导阻滞差异有统计学意义(均P<0.05);SSM 组新发心房颤动比例高于ASA 组(P<0.05);新发不完全性右束支传导阻滞、不完全性左束支传导阻滞、左前分支阻滞、左前分支阻滞、 左后分支阻滞、1 度房室传导阻滞、2 度房室传导阻滞、3 度房室传导阻滞、 室内传导阻滞、窦性心动过缓、窦性心动过速、心房扑动、房性早搏、室性早搏、Q 波发生及左心室肥厚缓解等差异无统计学意义(均P>0.05),见表3。
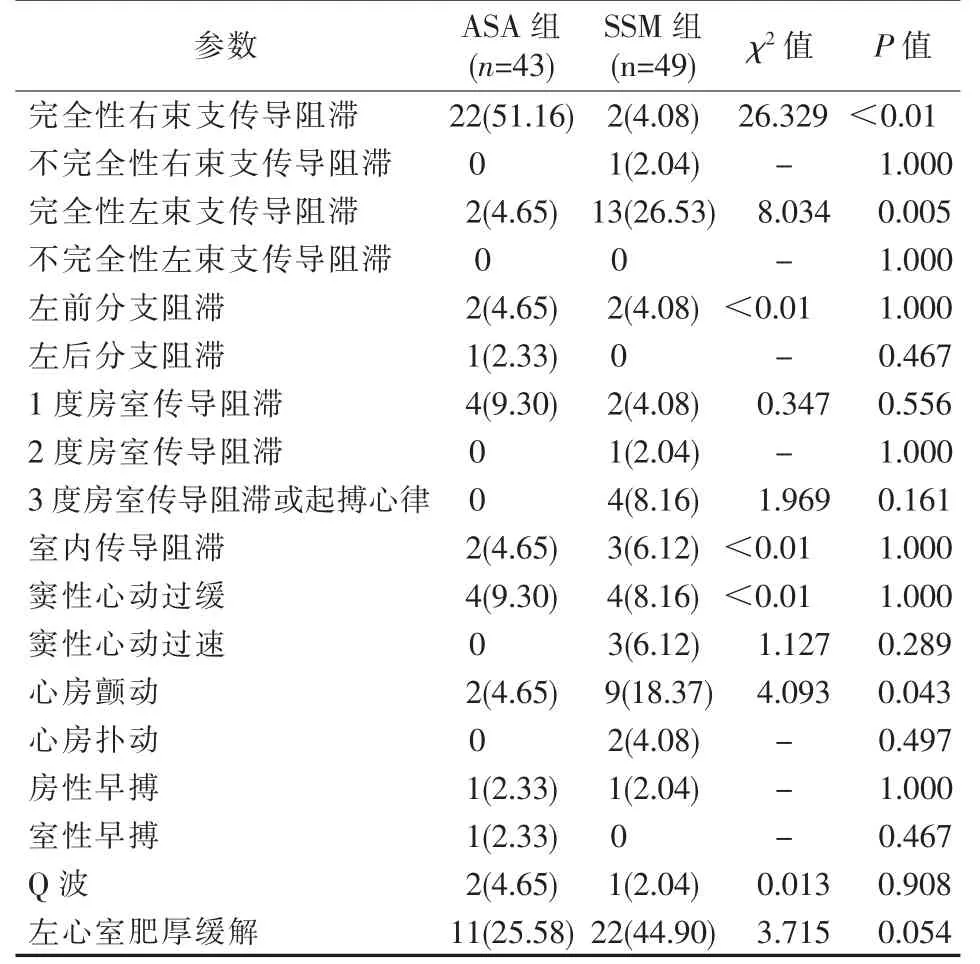
表3 两组HOCM 患者术后3 个月新发心律失常比较 [n(%)]
3 讨论
HOCM 患者肥厚的室间隔部分处于心室传导系统起始位置,该区域减容治疗很可能会影响心室传导。 SSM 术切除了室间隔前部心内膜下大面积左束支及分支主干组织,导致左束支传导阻滞[9,11-14]。对于术前存在完全性右束支传导阻滞患者,SSM 治疗可能会因损伤左束支出现完全性心脏传导阻滞,术后需植入永久心脏起搏器。Wang 等[11]、Talreja 等[9]、Cui 等[15]分别报道SSM 术后左束支传导阻滞发生率为47%、40%、38.8%。 Cui 等[15]报道SSM 术后发生完全性心脏传导阻滞比例仅为2.3%,但术前有完全性右束支传导阻滞患者则高达34.8%。 右束支通常由前降支间隔支供血,乙醇消融室间隔可引起上间隔透壁心肌损伤, 发生完全性右束支传导阻滞改变[9]。Coakley 等[16]、Talreja 等[9]分 别 报 道ASA 术 后 右 束支传导阻滞发生率为50%、36%。 ASA 患者再行SSM 术, 完全性心脏传导阻滞发生率可达9.7%[17]。本研究结果显示,SSM 术后完全性左束支传导阻滞发生率为26.5%,ASA 术后完全性右束支传导阻滞发生率为51.2%。 虽然SSM 术后左心室流出道压差降低优于ASA,但两种治疗方法对于患者生存率的差异无统计学意义[18-19]。 SSM 术后发生完全性心脏传导阻滞、起搏器依赖患者,长期生存率低于传导正常组[13]。 因此建议对术前有完全性右束支传导阻滞患者选择ASA 治疗,有完全性左束支传导阻滞患者选择SSM 治疗,以减少完全性心脏传导阻滞发生。
心脏外科手术后30%~50%患者发生心房颤动[20]。 SSM 术后心房颤动发生率为15%~24.6%[21-23]。ASA 术后1、3、5 年心房颤动发生率分别为0.9%、6.3%、8.3%[24]。 本研究结果显示,SSM、ASA 术后3 个月心房颤动发生率分别为18.37%、4.65%,差异有统计学意义。这可能由于SSM 术患者通常会接受额外手术如瓣膜置换等,造成额外心脏损伤,而ASA 手术经导管微创操作,对心脏损伤范围较小。
本研究显示,SSM 术后左心室肥厚缓解率整体高于ASA 术, 原因可能是ASA 术使用无水乙醇消融间隔支效果取决于间隔支血管支配区域,有时并不能达到理想的消融范围,而SSM 术多可达到理想的切除心肌范围。 SSM 术后左束支传导阻滞率较高,但很难判断是否有左心室肥厚,因此鉴别诊断尤为重要。 Strauss 等[25]提出新的诊断标准:①V2 导联S 波振幅与V6 导联R 波振幅相加>45 mm;②有左心房扩大证据, 即QRS 波时长>0.16 s。 然而,对于术后右束支传导阻滞、3 度房室传导阻滞伴室性逸搏及3 度房室传导阻滞安装起搏器行室性起搏患者左心室肥厚, 目前尚无明确诊断标准,主要依据超声心动图确诊。
本研究的不足:为回顾性研究,且统计分析样本量受限;SSM 组中有部分患者同时接受额外手术,未进一步分组。 有必要开展更大样本量前瞻性研究, 对比两种术式术后中远期新发传导阻滞、心房颤动发生率及左心室肥厚缓解率差异。
综上,ASA 术后新发完全性右束支传导阻滞比例显著增高,而SSM 术后新发完全性左束支传导阻滞、心房颤动比例显著增高。ASA 术可作为不能耐受外科手术或追求低风险治疗患者的合理选择,而完全性左束支传导阻滞行SSM 治疗也许更合适。
