脂溶性茶色素的提取工艺探索
2022-09-03王莎莎张海虹杨芳丽
王莎莎,张海虹,杨芳丽,权 阳
(白水县农产品安全检验检测中心,陕西 渭南 715600)
茶色素是从绿茶中提取的,是由多酚类及其衍生物组成的混合物,主要成分为茶黄素类、茶红素类(>85%),是一种水溶性酚性色素[1],被誉为“药物中的绿色黄金”。通过20 余万临床病例证实,茶色素具有抗衰老、抗菌[2]、抗氧化[3]、防癌与抗癌、双向调节血压血脂、降低血黏度[4]、预防龋齿、增强人体免疫功能等多种药理功能、药理作用。此外其含有大量的维生素、氨基酸和其他营养物质[5],是一种绿色天然食品添加剂,不仅使食品色泽亮丽刺激人们的味觉,而且提高了产品的营养价值和保健功能,同时也延长了产品的保质期,将成为继咖啡碱、茶多酚之后又一具有实用性和应用前景的产品。
溶剂浸提法主要利用茶色素在不同溶剂中溶解度不同从而进行提取分离的。常用的溶剂浸提法的工艺流程为:普通绿茶→沸水浸泡→过滤→溶剂萃取→浓缩→干燥。董基[6]使用有机溶剂从茶叶里提取茶色素,其工艺流程为pH 值7.0 左右,用乙醇提取10 min,提取率为6.8%。唐孝明[7]采用水浸提法提取,针对温度和酸碱性的影响做出分析,结论为提取温度30 ℃下采用10 g/L 碳酸氢钠溶液浸取30 min,提取的茶色素最多(33.3%)。
由于茶色素中所特有的活性酚羟基等一系列活性基因[8],具有极强的清除自由基和抗氧化作用[9],加之其亮丽的颜色和营养价值使得它在食品、医药和日用化工等方面已展现良好的应用前景[10],是一类极具开发潜力的天然茶叶产物。此外我国是茶的故乡,茶资源丰富,但是对于茶叶的利用率较低,例如在茶叶的生产过程中有很大一部分茶叶末、修剪叶和部分陈放的粗茶老茶等,目前几乎是作为废弃物处理的,无法发挥其最大作用[11-12],倘若以它们为原料生产茶色素,不仅能给茶叶的综合利用多出一条途径,同时可以生产出更多的茶色素,为医疗、健康、食品等领域做出巨大贡献,因此,探索茶色素提取制备技术意义重大[13]。
1 实验部分
1.1 主要仪器与试剂
1.1.1 实验试剂
茶叶、三氯甲烷(CHCl3)、四氯化碳(CCl4)、乙酸乙酯(CH3OOCH3)、无水乙醇、氢氧化钠。
1.1.2 实验设备
可见分光光度计7230G(上海菁华科技仪器有限公司);分析电子天平 FA2104(上海良平仪器有限公司);电热恒温水浴锅 DK-2000-ⅢL(天津市泰斯特仪器有限公司);电热鼓风干燥箱101-1AB(天津市泰斯特仪器有限公司);容量瓶、量筒、分液漏斗、玻璃棒、pH 试纸。
1.2 实验方法与步骤
(1)称取一定量茶叶,用蒸发皿盛好,放入干燥箱中烘干,直至质量恒重。
(2)称取15 g 茶叶放入烧杯,加入约300 mL 沸水浸泡30 min,过滤得到茶溶液(为了节约时间、提高准确率,可一次平行多组实验)。
(3)将过滤所得的茶溶液放入烘烤箱并打开风机,进行溶液浓缩,浓缩至大约50 mL。
(4)加入无水乙醇150 mL,搅拌、静置待溶液均匀,加入NaOH 溶液调节pH 值为7.0~7.5,静置,使其他成分沉淀。
(5)使用真空泵抽滤,使沉淀以及难溶性杂质与溶液分离,得到茶色素溶液。
(6)再分别加入100 mL 不同有机溶剂(或者针对不同温度,或不同萃取时间)对溶液进行萃取,放入电鼓风干燥箱,烘干。
(7)将烘干的茶色素固体分别加入对应的溶剂,溶解后,再放入容量瓶中定容,取10 mL 茶色素溶液放入具塞管中测吸光度。
1.3 探索实验提取最佳条件
1.3.1 提取溶剂的选择
同上述实验步骤在控制萃取温度、萃取时间相同的条件下,根据廉价、无毒、提取率高等实验要求,本实验采用三氯甲烷、四氯化碳、乙酸乙酯等进行脂溶性茶色素的提取,选取3 种有机溶剂对茶色素溶液进行萃取,溶剂分别为三氯甲烷(CHCl3)、四氯化碳(CCl4)、乙酸乙酯(CH3OOCH3)。三者进行比较,在常温下,萃取时间都为30 min 时,用3 种不同的溶剂对茶色素溶液进行萃取,通过对三者的吸光度进行比较,吸光度数值最大者,即为最佳溶剂。
1.3.2 提取时间的选择
同上述实验步骤选择一种有机溶剂,控制在相同的实验温度下,设置萃取时间,时间梯度分别为30、40、50 min,将所得的产物配制成茶色素溶液,测量吸光度。
1.3.3 提取温度的选择
同上述实验步骤选择一种有机溶剂,在提取时间相同的情况下,根据不同温度进行萃取,萃取温度分别为20、40、60 ℃,配置茶色素溶液,测量吸光度。
2 实验数据与结果
2.1 脂溶性茶色素的光谱特性
利用7230G 型分光光度计在325~700 nm 的波长范围内对脂溶性茶色素标准液进行吸收光谱测定,利用Excel 处理数据得出脂溶性茶色素在可见光区的吸收光谱(图1)。
通过图1 可以看出脂溶性茶色素在325~700 nm之间有两个吸收峰,为425 和670 nm,由此可以得出脂溶性茶色素的最大吸收峰在670 nm 处。
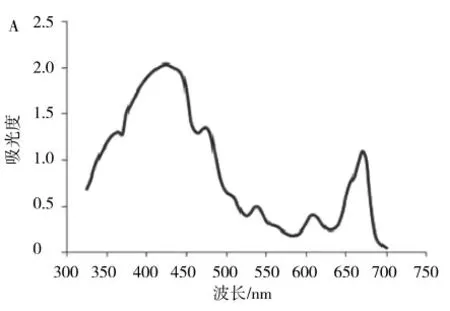
图1 脂溶性茶色素的光谱特性
2.2 提取溶剂的选择(表1)
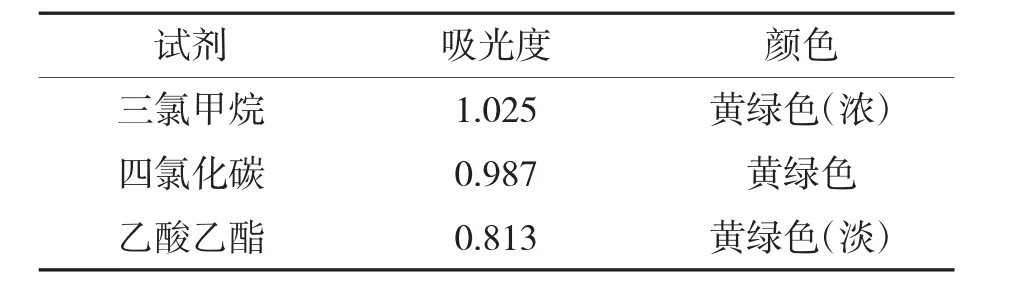
表1 3 种有机溶剂中茶色素的吸光度
通过在其他条件相同的情况下对比3 种溶液的吸光度数值,通过对比参数可得出茶色素在三氯甲烷中溶解度最高。故接下来的几组实验都以三氯甲烷作为萃取剂。
2.3 提取时间的选择(表2、图2)
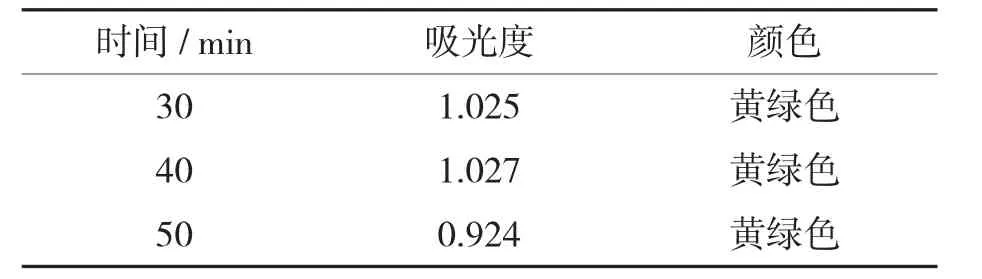
表2 不同萃取时间下茶色素的吸光度
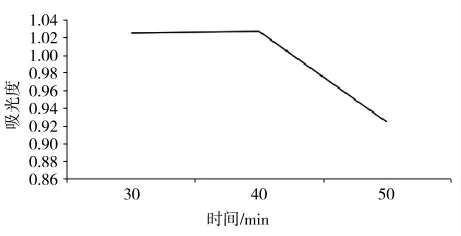
图2 不同萃取时间下茶色素的吸光度图像
此次实验选取三氯甲烷作为萃取液,在常温下,对茶色素溶液进行萃取,通过对比吸光度发现:设置提取时间段在30~40 min 时,茶色素提取率变化不大,50 min 时吸光度呈下降趋势,其可能原因是茶色素稳定性较差,暴露在空气中有所氧化分解。此次实验可得出结论:在萃取溶剂、萃取温度都相同的前提下,30 min 时茶色素的提取率最高。
2.4 提取温度的选择(表3、图3)
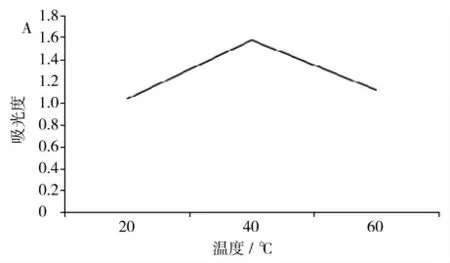
图3 不同萃取温度下茶色素的吸光度图像
根据实验数据得出,提取液都为三氯甲烷,萃取时间都为30 min 时,在温度为40 ℃时,茶色素的吸光度数值最大,即提取率也就最高。刚开始折线升高时,表明随着温度升高茶色素溶解度也在增大,40 ℃以后茶色素含量有所下降,但变化幅度不大,其中可能的原因是随着温度的升高,茶色素的分解所致。
2.5 正交试验
2.5.1 正交试验
单因素实验虽有一定的效果,但仍有不少的局限性。首先实验范围太小,不全面;其次,该方法忽略了试验中各个因素之间的内在影响;最后用单因素法比较时只是单纯地数值比较,不能排除试验中的部分误差。因此可能会造成实验结论的不稳定,故想要得出最佳实验路径,须采取正交试验法。
2.5.2 提取工艺正交试验
将影响提取率的实验因素设计为正交试验表,得到一个L9(3^3)的正交表格。依据其因素的组合进行实验,实验步骤同单因素实验,进行9 次实验,得到的茶色素溶液分别进行吸光度测量,可得表4。
2.5.3 结果分析以及数据处理
表5 中,K 是各因素提取质量之和,k1、k2、k3表示其平均值,R 表示极差。
由表4 可得出当溶剂为三氯甲烷、萃取时间为40 min、萃取温度为40 ℃时,茶色素的提取率最高;在表5 中通过R 值可以看出本实验所有因素存在显著性差异即其主要关系为萃取试剂>萃取温度>萃取时间,即影响茶色素提取工艺最主要的影响因素为萃取溶剂,其次为萃取温度,最后为萃取时间。
3 结 论
(1)本文通过单因素试验以及正交试验对脂溶性茶色素提取工艺进行了研究,最终确定了脂溶性茶色素的最佳提取工艺即:溶剂为三氯甲烷、萃取时间40 min、萃取温度为40 ℃。
(2)不同提取因素对脂溶性茶色素的提取工艺影响不同,即有机溶剂影响最大,萃取温度次之,萃取时间影响最小。
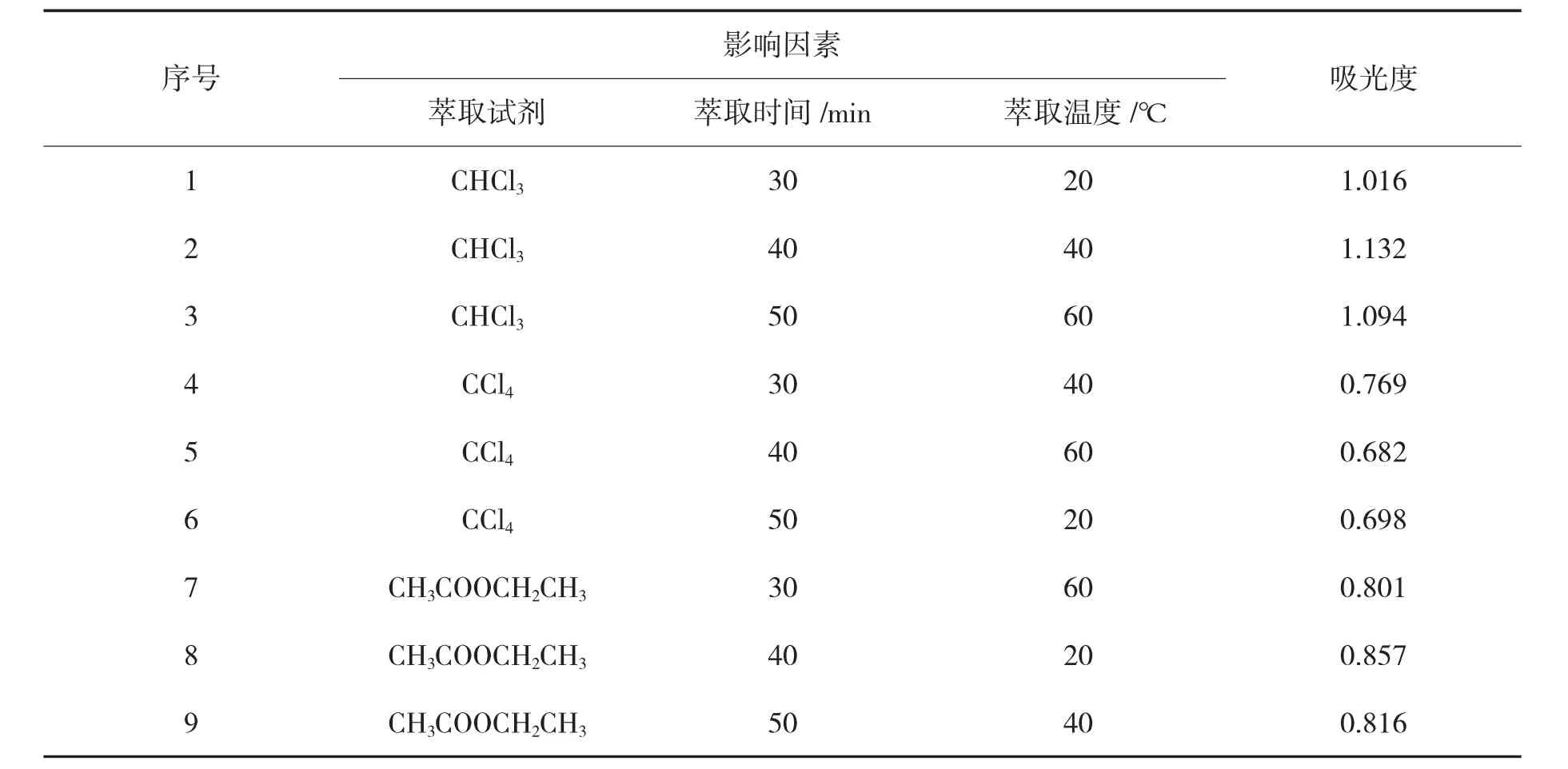
表4 正交试验安排及结果
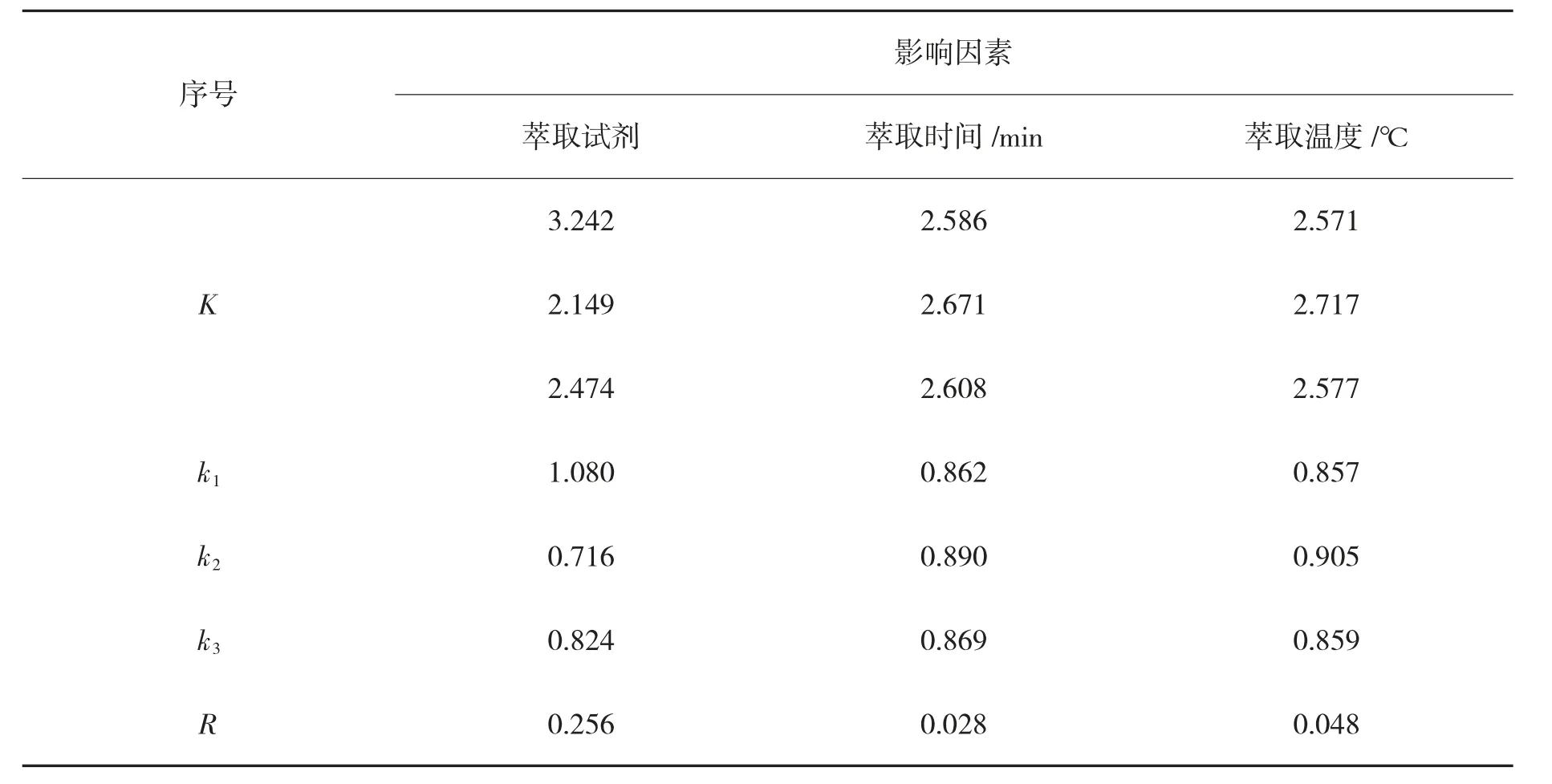
表5 实验结果分析
(3)本实验由于实验条件有限,试验次数相对较少,影响因素难以完全控制,此外,由于溶剂萃取法存在提取率较低等一系列问题,都可能导致实验结果有所偏差,在下一步的研究中我们会对上述问题进行改进。
