肠道菌群多样性变化与手足口病相关性的分析
2022-09-03林先耀赵仕勇陈海哨宋闻滕淑祁正红
林先耀 赵仕勇* 陈海哨 宋闻 滕淑 祁正红
近10年,手足口病仍是我国儿童发病率及病死率最高的丙类传染病,严重影响儿童健康[1-2]。越来越多的研究报道关于疾病与肠道微生态失衡的关系,也称为肠道微生态失调[3-4]。肠道微生物群落与营养物质消化吸收、免疫调节应答,具有高度的相关性[5]。然而,关于手足口病患儿肠道菌群结构的变异性和多样性的报道较少。本文探讨手足口病患儿肠道菌群的变异性和多样性,分析肠道菌群与手足口病的相关性。现报道如下。
1 资料与方法
1.1 一般资料 收集2017年1月至12月本院经实时荧光聚合酶链反应(RT-PCR)法进行病毒核酸检测及分型,实验室确诊肠道病毒感染的手足口病患儿37例,其中15例为普通手足口病(common HFMD patients,HD)、22例为重症手足口病(HFMD patients with encephalitis,HE),另收集同期20例本院体检健康儿童(normal children's,NC)的粪便标本。根据卫生部颁布的《手足口病诊疗指南(2010年版)》临床分类标准[6]。入组标准:①近1月内无使用抗生素、益生菌或益生元等制品;②近1月内无腹泻、肠道感染等肠道疾病。本项目经本院伦理委员会批准,患儿及健康儿童家长均签署知情同意书。
1.2 方法 (1)标本采集及资料收集:收集相关临床资料。粪便样本采用一次性无菌杯收集,密封后冷链1 h内运送至实验室-80℃ 冰箱,备用;待收集一定量样本后于冷链条件下送至基因公司进行肠道菌群检测。(2)肠道菌群总DNA提取:参照试剂说明书步骤,使用Power Soil®DNA分离试剂盒(MOBIO,美国)从粪便样品中提取菌群总DNA。在1%琼脂糖凝胶上检测DNA浓度和纯度。根据浓度,用灭菌用水稀释DNA至1 ng/μL,备用。(3)16S rDNA扩增及测序:对微生物基因组16S rDNA V3V4高变行扩增,引物为F341(5’-CCTAYGGGRBGCASCAG-3’)和R806(5’-GGACTACNNGGGTATCTAAT-3’)。所有PCR反应均使用Phusion®高保真PCR预混液(new england biolabs,英国)进行处理。每个样品用30μL反应体系扩增三份,该反应体系包含15μL Phusion预混液(2×)、3μL引物(2 μm最终浓度)、10 μL基因组DNA(1 ng/μL)和2 μL MOBIO PCR液。扩增条件为:98℃变性30次10 s,50℃退火30 s,72℃延长30 s,72℃延长5 min,将相同体积的1×缓冲液(含SYB-green)与PCR产物混合,在2%琼脂糖凝胶上电泳检测。选择主带亮度在400~450 bp之间的样品进行下一步实验。PCR产物以等密度比混合,用Qiagen Gel Extraction Kit(Qiagen,德国)试剂盒对混合PCR产物进行纯化,使用Truseq®DNA无PCR样品制备试剂盒(Illumina公司,美国),并根据厂商的建议生成测序库、添加索引代码。文库质量通过Qubit@2.0荧光计(Thermo Scientific)和安捷伦生物分析仪2100系统进行评估。最后由杭州市中翰金诺医学检验所有限公司采用Illumina HiSeq 2500测序仪(Illumina公司,美国)进行测序。
1.3 统计学方法 检测样本共产生5,806个操作分类单元(operational taxonomic units,OTU),其中98.7%属于门级。为了规范化每个样本的测序深度,随机选择3,100个序列进行进一步分析。采用QIIME方法计算多样性指数,包括Shannon指数、观察物种和系统发育多样性。采用SPSS 16.0统计软件。计量资料以(±s)表示,多组间比较用单因素方差分析(ANOVA)。选择优势菌科(至少在一个样本中相对丰度>1%)进行细菌分类,并用最小判别分析(LDA)确定肠道菌群的显著性。采用在线网站工具(http://enterotypes.org)完成细菌肠型的属水平分类计算。采用基于距离加权UniFrac的主坐标分析法(PCoA)评价肠道菌群结构的差异,采用mantel检验对细菌β多样性进行显著性分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组临床表现的相关性分析 手足口病患者咽峡部、手足部和臀部伴有不同程度的疱疹,且部分还伴有呕吐、发热、惊厥等症状,见表1。37例手足口病患儿病毒核酸检测结果显示:人肠道病毒71 型(EV-A71)22例(59.5%),均为HE;柯萨奇病毒A16型(CVA16)2例(5.4%),其它肠道病毒13例(35.1%),均为HD。HE组患者粪便病毒载量、脑脊液细胞数、脑脊液蛋白和白细胞计数均高于HD组,见表2。
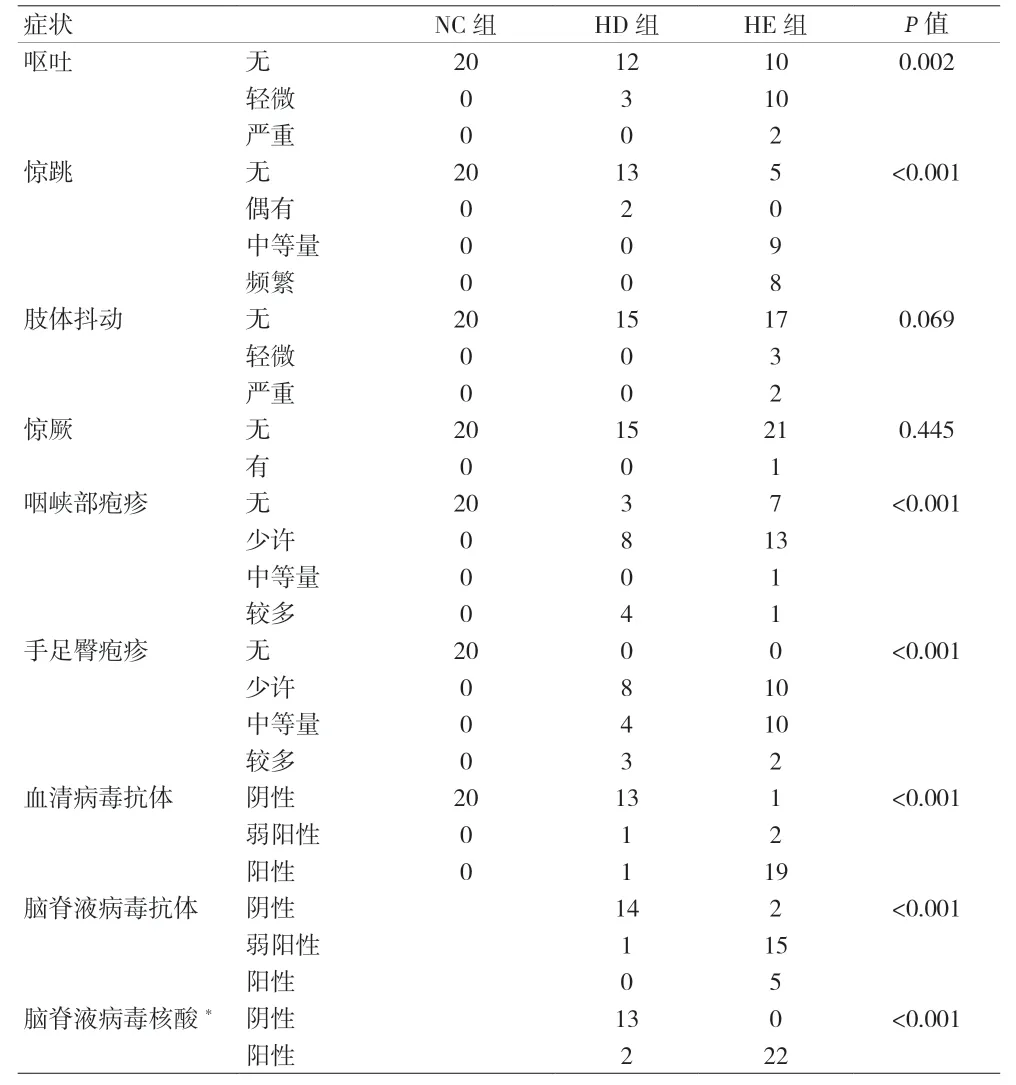
表1 三组临床表现的相关性分析(n)
表2 HD组与HE组临床指标比较(±s)
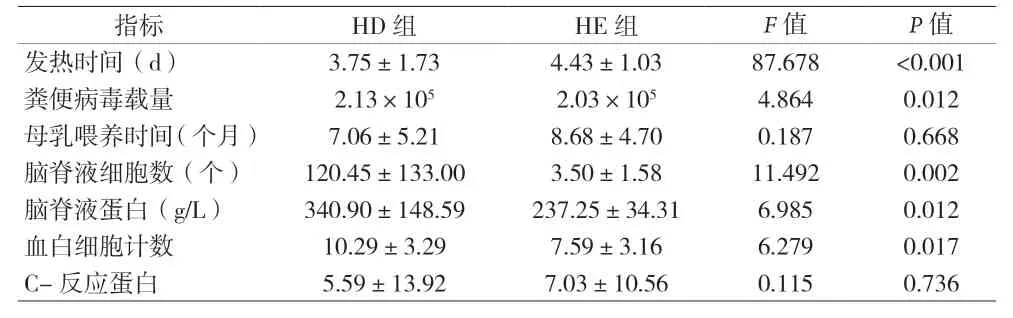
表2 HD组与HE组临床指标比较(±s)
指标 HD组 HE组 F值 P值发热时间(d) 3.75±1.73 4.43±1.03 87.678 <0.001粪便病毒载量 2.13×105 2.03×105 4.864 0.012母乳喂养时间(个月) 7.06±5.21 8.68±4.70 0.187 0.668脑脊液细胞数(个) 120.45±133.00 3.50±1.58 11.492 0.002脑脊液蛋白(g/L) 340.90±148.59 237.25±34.31 6.985 0.012血白细胞计数 10.29±3.29 7.59±3.16 6.279 0.017 C-反应蛋白 5.59±13.92 7.03±10.56 0.115 0.736
2.2 细菌群落α多样性分析 NC组shannon指数明显高于HD组(P<0.05),而HE组shannon指数与HD组差异无统计学意义(P>0.05)。而观察物种、系统发育多样性三组比较差异均无统计学意义(P>0.05)。肠道菌群shannon指数与发热天数、咽峡部疱疹、手足臀部疱疹、粪便病毒载量和血液病毒抗体阳性呈相关性(P<0.05),见表3。

表3 肠道细菌α多样性与各因素的相关系数
2.3 细菌群落的分类群分布 优势科(平均相对丰度>1%)为双歧杆菌科(15.0%,放线菌门)、科氏菌科(1.4%,放线菌门)、类杆菌科(20.6%,拟杆菌门)、卟啉单胞菌科(2.1%,拟杆菌门)、肠杆菌科(14.6%,变形菌门)、巴氏杆菌科(1.3%,变形菌门)、 疣状杆菌科(1.1%,疣微菌门)、毛螺旋菌科(14.0%,厚壁菌门)、瘤球菌科(13.7%,厚壁菌门)、丹毒杆菌科(3.7%,厚壁菌门)、梭菌科(2.6%,厚壁菌门)、链球菌科(2.1%,厚壁菌门)、维管菌科(1.1%,厚壁菌门),占细菌总序列的 93.25%。单因素方差分析显示,NC组中双歧杆菌科的相对丰度显著降低,而瘤球菌 科、梭状芽孢杆菌科的相对丰度则显著升高,HD组中链球菌科的相对丰度高于HE(P<0.05),见表4。瘤球菌科、梭状芽孢杆菌科和链球菌科的相对丰度与发热天数、咽峡部疱疹、手足臀部疱疹、粪便病毒载量和血液病毒抗体阳性显著相关,此外,双歧杆菌科的相对丰度与母乳喂养时间显著相关(P<0.05),瘤球菌科相对丰度与惊跳显著相关,梭菌科的相对丰度与呕吐、惊跳和肢体抖动显著相关(P<0.05),见表5。在属级,最小判别分析(LDA)揭示优势菌属和三个群之间的关系,即粪杆菌属、罗斯氏菌属、粪球菌属、布氏杆菌属和梭状芽孢杆菌属(厚壁菌门),以及NC中的梭状芽孢杆菌属和梭状芽孢杆菌属(厚壁菌门),气味杆菌属(拟杆菌门),HD中的双歧杆菌(放线杆门)、嗜血杆菌(变形菌门)和HE中的厌氧杆菌、假分枝杆菌和真杆菌(厚壁菌门)、普雷沃杆菌(拟杆菌门)。所有样本可分为三种肠型:ET-P、ET-F和ET-B。仅3例儿童肠道菌群属于ET-P肠型,24例儿童肠道菌群属于ET-F肠型,30例属于ET-B肠型,见表6。
表4 细菌相对丰度的单因素方差分析(±s)

表4 细菌相对丰度的单因素方差分析(±s)
分类 NC组 HD组 HE组 F值 P值拟杆菌科 0.215±0.162 0.192±0.162 0.211±0.163 0.090 0.914双歧杆菌科 0.037±0.039 0.257±0.039 0.155±0.137 10.068 <0.001肠杆菌科 0.154±0.143 0.140±0.143 0.146±0.162 0.030 0.970毛螺菌科 0.156±0.098 0.120±0.098 0.144±0.125 0.484 0.619瘤胃球菌科 0.216±0.170 0.075±0.170 0.118±0.132 5.184 0.009消化链球菌科 0.027±0.030 0.017±0.030 0.066±0.113 2.437 0.097梭状芽孢杆菌科 0.057±0.058 0.011±0.058 0.009±0.005 12.026 <0.001紫单孢菌科 0.009±0.007 0.042±0.007 0.012±0.017 1.154 0.323链球菌科 0.020±0.035 0.035±0.035 0.008±0.007 2.814 0.069红蝽菌科 0.012±0.016 0.010±0.016 0.021±0.034 1.120 0.334巴斯德氏菌科 0.013±0.035 0.024±0.035 0.002±0.004 0.992 0.377疣微菌科 0.008±0.025 0.022±0.025 0.004±0.008 0.775 0.466韦荣氏球菌科 0.007±0.011 0.010±0.011 0.017±0.027 1.437 0.246

表5 临床特征与细菌相对丰度的相关性
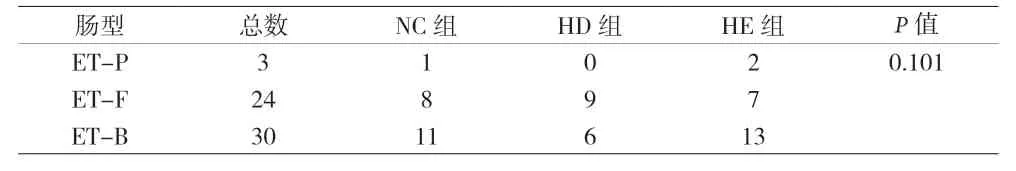
表6 不同类型肠道菌群的相关性
2.4 细菌群落结构 HD组和 HE组肠道菌群相似,NC组肠道菌群与HD组和HE组不同。见图1。

图1 微生物群落主坐标分析(PCoA)
3 讨论
微生物群多样性受年龄、环境、遗传学、饮食的影响,微生物群多样性低与易受各种疾病影响有关,包括对病原菌的抵抗力降低[7]。EV-A71是儿童手足口病的主要病原体,可通过传感器接合机制改变血液和肠道环境[8],如血管过敏和炎症。生态选择的作用允许适合环境生长的微生物繁殖和不适宜微生物的丰度下降[9],从而导致微生物相对丰度的变化。HE组微生物群落的不平衡导致Shannon指数下降,而群落的抵抗力和恢复力在一定程度上造成这种不平衡[10],导致观察到的物种和系统发育多样性无明显变化。
学龄前儿童肠道菌群组成随年龄变化而变化,新生儿肠道菌群以肠球菌科、链球菌科、乳杆菌科、梭状芽孢杆菌科、双歧杆菌科为主[11],断奶和/或固体食物引起类杆菌、梭状芽孢杆菌、瘤胃球菌的数量增加,和双歧杆菌和肠杆菌科的数量减少[12],然后逐渐演变成富含瘤胃球菌科、毛螺菌科、类杆菌科和普雷沃杆菌科的类似成人样肠道菌群结构[13]。双歧杆菌是一种常见的益生菌,可以通过竞争性抑制有害细菌维持肠道健康[14]。双歧杆菌与EV-A71的关系尚不清楚。母乳和乳制品的摄入可以增加双歧杆菌的丰度[15],这可能解释HD组和HE组双歧杆菌的相对丰度与母乳喂养时间呈正相关,NC组双歧杆菌含量低于HD组,HE组可能与母乳喂养时间以及与他们的饮食习惯有关。瘤胃球菌与肠道健康有关[16],普氏栖粪杆菌曾被报道通过丁酸作为结肠细胞的首选能源以及对细胞凋亡、炎症和氧化应激的多重影响,在肠黏膜中发挥有益作用,此外,在克罗恩病中,当宿主免疫能力降低,肠道功能紊乱时,普氏栖粪杆菌的相对丰度降低[17]。EV-A71病毒在血液和肠道的侵袭使宿主功能紊乱,这就解释了手足口病患者瘤胃球菌数量显著减少的原因。至于梭状芽孢杆菌科、罗斯氏菌科的丰度可能与体重下降有关[18],粪球菌可能是儿童肠道健康的潜在生物标志物,布劳特氏菌也与宿主的生理状态有关,因此,作者推测手足口病患者食欲下降和疾病易感性与梭菌科减少有重要关系。
筛选指示菌并监测其绝对丰度有助于手足口病的临床诊断和治疗。HD组占优势的细菌属,紫单孢菌科,非典型病原体,通常是互为影响且对人类有益的,但其有时可能导致疾病,如在某些条件下的人类腹部脓肿[19]。HD组另一个优势菌属是流感嗜血杆菌属。据报道,流感嗜血杆菌是机会性病原体,通常生活在宿主体内而不致病,只有当其他因素(如病毒感染、免疫功能下降或慢性炎症、过敏等)下才会引起疾病。流感嗜血杆菌通过三聚体自转运粘附素粘附在宿主细胞上,感染宿主并导致幼儿败血症和细菌性脑膜炎[20]。HE组厌氧菌、假分枝杆菌、真杆菌和普雷沃菌是优势菌属,厌氧菌是常见的肠道共生菌[21]。普雷沃菌在成人肠道中含量丰富,在高纤维膳食儿童肠道中含量丰富。半乳假分枝杆菌是一种易导致牙髓病的病原体,可导致不同形式的根周病[22]。肠型有助于疾病状态的识别,可作为风险或易感性的指标,是疾病进展过程中发生变化的有用生物标志物,具有潜在的临床应用价值[23]。而本资料中,57个样本是ET-B型和ET-F型,不同组间差异无统计学意义。根据以上结果,作者认为嗜血杆菌和假分枝杆菌可能是潜在的疾病指标,监测其绝对丰度可能有助于找到手足口病肠道类型的模型。
