变应性鼻炎患者血清ECP、ICAM⁃1、Eotaxin水平与其疾病状态及症状的关系
2022-09-03李红娟张珂蔡文杰
李红娟 张珂 蔡文杰
变应性鼻炎(Allergic rhinitis,AR)是临床耳鼻喉科较为常见的一种疾病,病情可反复发作,具有较高的发病率。据相关数据调查显示,AR 发病率可达30%,且半数患者伴有变应性哮喘[1]。AR 是由Th2 细胞介导、诸多炎症因子及趋势因子等所参与的Ⅰ型变态反应,以嗜酸性粒细胞(Eosino⁃phils,EOS)的浸润、活化等为主要病理学特征[2]。嗜酸细胞阳离子蛋白(Eosinophil cationic protein,ECP)、细胞间黏附分子⁃1(Intercellular adhesion molecule⁃1,ICAM⁃1)及趋化因子Eotaxin 等因子与EOS 局部浸润、活化存在紧密联系[3]。已有研究表明,Th1/Th2 失衡、EOS 在变应性疾病进展中具有重要作用,但与AR 持续状态的相关性尚未十分明确[4]。本研究通过分析AR 患者的临床资料,拟通过研究ECP、ICAM⁃1 及Eotaxin 水平在不同病情、类型AR 患者中的表达,并分析上述指标与AR 疾病状态、症状的相关性,以探讨ECP、ICAM⁃1 及Eotaxin 水平在AR 发病中的临床意义。
1 资料与方法
1.1 一般资料
分析本院2020年1月至2022年4月门诊收治的156 例AR 患者的临床资料。其中男性72 例,女性84 例,平均年龄(42.18±3.19)岁;体质量指数平均(22.36±1.14)kg/m2;持续性AR 患者87 例,间歇性AR 患者69 例。将156 例AR 患者纳入AR 组,另同期选取在本院进行健康体检的83 名健康者作为对照组,男性35 例,女性48 例,平均年龄(43.54±4.12)岁;体质量指数平均(23.11±1.16)kg/m2。两组性别、年龄、体质量资料比较差异无统计学意义(P>0.05)。
纳入标准:①均经AR 相关诊断标准[5];②皮肤点刺、血清特异性免疫球蛋白结果均为阳性;③近期无抗免疫、组胺等药物治疗;④患者知情,并自愿签署同意书。排除标准:①伴脑、心等脏器恶性疾病者;②伴鼻窦炎、哮喘等疾病者;③伴全身感染性疾病者;④癫痫、痴呆等特殊人群,无法配合本次研究。本研究已经医院伦理委员会批注。
1.2 方法
1.2.1 血清ECP、ICAM⁃1 及Eotaxin 水平检测
清晨空腹抽取两组受检者3 mL 外周静脉血,注入一次性真空管内,3 000 r/min 的速率离心10 min,离心半径为8 cm,分离上层血清,将血清置于Eppendorf 管中,置于-80℃低温保存。采用酶联免疫吸附法检测ECP、ICAM⁃1 及Eotaxin 水平,试剂盒均由美国R&D 公司提供。实验步骤严格按照试剂盒说明书执行。最后采用酶标仪在450 nm 波长下测量各孔OD 值。按标准物浓度及OD 值计算出标准曲线的线性回归方程式,将样品OD 值代入方程式,算出待检样品浓度,乘以5,即为待测样品的实际浓度。以上操作均由同一名经验丰富的检验科技术人员完成。
1.2.2 AR 疾病类型[6]
持续性AR:症状发生的天数>4 d/周与病程>4周(持续性AR 组,n=69);间歇性AR:症状发生天数<4 d/周或病程<4 周(间歇性AR 组,n=87)。
1.2.3 症状评分
采用AR 症状评分(Score for allergic rhinitis,SFAR)[7]评估AR 病情,该评分包括喷嚏、鼻塞、流涕及鼻痒四个项目,各项评分范围1~3 分。根据SFAR 评分将AR 患者分为0~2 分组(n=50),3~4分组(n=58),≥5 分组(n=48)。
1.3 统计学方法
本研究采用SPSS 22.0 软件进行分析,计数资料以n(%)表示,行χ2检验。计量资料以()描述,两组间行t检验,多组间行方差检验;ECP、ICAM⁃1及Eotaxin 水平与AR 患者SFAR 评分相关性采用Pearson 分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组ECP、ICAM⁃1 及Eotaxin 水平比较
AR 组ECP、ICAM⁃1 及Eotaxin 水平均明显高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 1 Comparison of ECP,ICAM⁃1 and Eotaxin levels between the two groups(±s)

表1 两组ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 1 Comparison of ECP,ICAM⁃1 and Eotaxin levels between the two groups(±s)
组别对照组AR 组t 值P 值n 83 156 ECP(ng/mL)265.45±25.14 456.04±111.09 15.408<0.001 ICAM⁃1(ng/mL)5.97±1.21 7.26±2.52 4.377<0.001 Eotaxin(pg/mL)89.44±10.52 170.02±18.08 37.362<0.001
2.2 不同疾病状态AR 患者ECP、ICAM⁃1 及Eotaxin 水平比较
持续性AR 组患者ECP、ICAM⁃1 及Eotaxin 水平均明显高于间歇性AR 组,差异有统计学意义(P<0.05)。见表2。
表2 不同疾病状态AR 患者ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 2 Comparison of ECP,ICAM⁃1 and Eotaxin levels in AR patients with different disease states(±s)
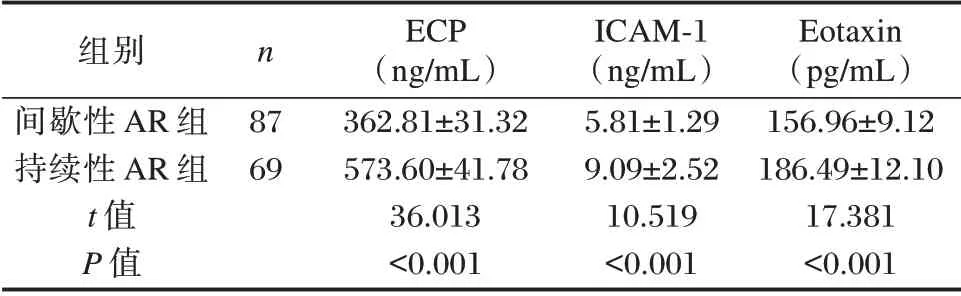
表2 不同疾病状态AR 患者ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 2 Comparison of ECP,ICAM⁃1 and Eotaxin levels in AR patients with different disease states(±s)
组别间歇性AR 组持续性AR 组t 值P 值n 87 69 ECP(ng/mL)362.81±31.32 573.60±41.78 36.013<0.001 ICAM⁃1(ng/mL)5.81±1.29 9.09±2.52 10.519<0.001 Eotaxin(pg/mL)156.96±9.12 186.49±12.10 17.381<0.001
2.3 不同症状评分AR 患者ECP、ICAM⁃1 及Eo⁃taxin 水平比较
不同症状评分AR 患者ECP、ICAM⁃1 及Eotax⁃in 水平比较:0~2 分组<3~4 分组<≥5 分组,差异有统计学意义(P<0.05)。见表3。
表3 不同症状评分AR 患者ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 3 Comparison of ECP,ICAM⁃1 and Eotaxin levels in AR patients with different symptom scores(±s)
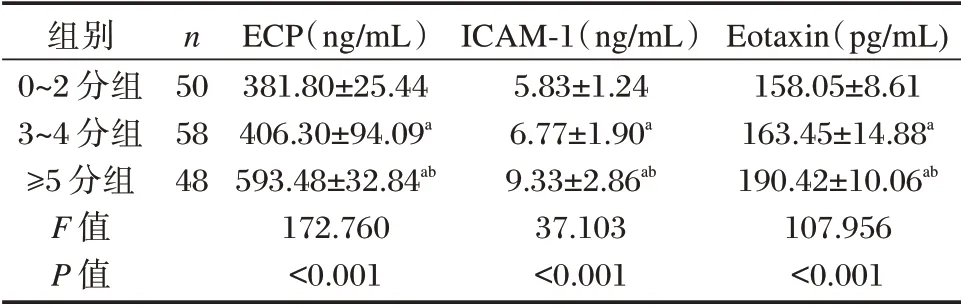
表3 不同症状评分AR 患者ECP、ICAM⁃1 及Eotaxin 水平比较(±s)Table 3 Comparison of ECP,ICAM⁃1 and Eotaxin levels in AR patients with different symptom scores(±s)
注:与0⁃2 分组比较,aP<0.05;与3⁃4 分组比较,bP<0.05。
组别0~2 分组3~4 分组≥5 分组F 值P 值n 50 58 48 ECP(ng/mL)381.80±25.44 406.30±94.09a 593.48±32.84ab 172.760<0.001 ICAM⁃1(ng/mL)5.83±1.24 6.77±1.90a 9.33±2.86ab 37.103<0.001 Eotaxin(pg/mL)158.05±8.61 163.45±14.88a 190.42±10.06ab 107.956<0.001
2.4 ECP、ICAM⁃1 及Eotaxin 水平与AR 患者SFAR 评分相关性分析
ECP、ICAM⁃1 及Eotaxin 水平与间歇性AR 患者SFAR 评分呈负相关,与持续性AR 患者SFAR评分呈正相关(P<0.05)。见表4。

表4 ECP、ICAM⁃1 及Eotaxin 水平与AR 患者SFAR 评分相关性分析Table 4 Correlation analysis of ECP,ICAM⁃1 and Eotaxin levels and SFAR score in AR patients
3 讨论
AR 是较为常见的呼吸道疾病,具有病程长、反复发作等特征,其病理过程主要表现为局部T细胞活化及各类细胞因子长期作用所致的鼻腔黏膜发生炎症改变,同时Th2 细胞分泌的多种细胞因子、趋化因子及黏附分子共同协调介导EOS 浸润,故EOS 趋化聚集是AR 发生的中心环节[8]。AR 对患者生命威胁虽不大,但其持续存在的鼻腔与黏膜不适会给患者生活质量造成严重影响,可能诱发心理障碍,导致其生活质量降低。故寻找有效生化指标,评估AR 患者病情具有重要作用。
AR 病理过程中EOS 的局部浸润、活化与趋化因子Eotaxin 的相互作用密切相关,Eotaxin 属于已发现的具有EOS 趋化因子中作用最强的一类,可促进EOS 从血管中向鼻黏膜局部趋化,同时还可促进募集至组织中的EOS 活化,释放EOS 阳离子蛋白(ECP)等有毒氧化物[9]。动物实验证明Eotaxin 在大鼠上皮细胞胞质中表达最高,提示其主要源于鼻黏膜上皮细胞[10]。ECP 则是由于EOS 活化释放的毒性蛋白,已被证实在AR 发生、发展中具有重要作用。国内外相关研究表明,Eotaxin、ECP 在AR 患者鼻黏膜局部呈高表达,而血清中的含量目前尚未获取一致意见[11⁃12]。沈林峰等[13]发现,AR 患者血清Eotaxin、ECP 水平与健康受试者比较无差异,但亦有研究指出,AR 患者、健康受试者Eotaxin、ECP 水平比较有差异[14]。本研究中,与对照组相比,AR 患者Eotaxin、ECP 水平明显增高。众多研究结果表明AR 患者外周血中Eotaxin、ECP 的作用尚未完全阐明,提示Eotaxin、ECP 在外周血中表达情况较为复杂,可能与AR 患者病情、疾病状况及采集时间点等因素有关[15⁃16]。本研究通过分析不同疾病状况,症状评分AR 患者Eotaxin、ECP 水平发现,随AR 患者症状评分增高,其Eotaxin、ECP 水平亦会逐渐增高,且相关性分析结果示,上述因子与AR 疾病状况、症状评分存在一定相关性。提示,Eotaxin、ECP 有可能作为评估AR 患者疾病状况、症状的早期生化检测指标。考虑其原因可能是由于Eotaxin 还可趋化活化EOS,释放ECP 及有毒氧化物,而AR 持续发作患者EOS 与上皮细胞黏附及激活作用后释放的毒性蛋白可能更高。
AR 与哮喘同属Ⅰ型变态反应,具有变应性炎症和异常免疫应答两个特点。就其变应性炎症这一病理学特点而言,已有研究证实,ICAM⁃1 在炎症细胞的趋化、聚集、浸润中起重要作用[17]。ICAM⁃1 是黏附分子免疫球蛋白超家族成员之一,在气道发生变应性炎症的4~24 h 内,气道上皮组织中ICAM⁃1浓度增高;用ICAM⁃1 的单克隆抗体可减少嗜酸粒细胞浸润并抑制气道高反应性。亦有相关研究表明,鼻黏膜微血管内皮细胞可通过调节ICAM⁃1 表达,促进EOS 通过内皮细胞间隙,增强EOS 与鼻黏膜微血管内皮细胞的黏附作用,从而使鼻黏膜中EOS 浸润、黏附及聚集,加重患者病情[18]。既往研究指出,ICAM⁃1 与AR 患者病情相关,轻度AR 患者ICAM⁃1 水平较中重度患者明显降低,且中度AR患者ICAM⁃1 水平明显增高[19⁃20]。本研究中,AR 患者ICAM⁃1 明显高于对照组,尤其是持续性AR 患者,且随患者SFAR 评分增加,ICAM⁃1 水平亦会随之增高;相关性分析结果显示,ICAM⁃1 与AR 疾病状况、症状评分亦存在一定相关性。表明ICAM⁃1 水平与AR持续状态有关,ICAM⁃1水平升高可能是导致AR 症状持续存在、迁延难愈的原因之一。通过拮抗ICAM⁃1可能成为临床治疗持续性AR的有效手段。
综上所述,血清ECP、ICAM⁃1 及Eotaxin 水平在AR 患者中呈高表达,且与其疾病状态、症状存在一定相关性。
