类泛素蛋白FAT10通过Nrf2/HO⁃1通路对心肌细胞缺血缺氧修复损伤的保护作用
2022-09-03陈天德曹玉芳
陈天德 曹玉芳
缺血性心肌病是心血管疾病中最严重的一类,致死率较高[1]。缺血心肌组织恢复血供后发生再灌注损伤是缺血性心肌病发生的重要原因之一[2]。心肌再灌注损伤的发病机制目前尚未完全明确。有研究显示,心肌缺血早期的心肌细胞损伤以凋亡为主,而晚期以坏死为主[2]。探讨缺血再灌注损伤心肌细胞凋亡的机制有重要意义。类泛素蛋白人类白细胞抗原F 介导转录因子10(Human HLA⁃F ad⁃jacent transcript 10,FAT10)在人类各种组织中广泛表达,在靶蛋白降解、细胞周期调控、免疫调控等过程中发挥重要作用[3⁃5]。近年来研究显示,FAT10 与细胞凋亡密切相关[3]。核因子E2 相关因子2(nu⁃clear factor erythroid2⁃related factor 2,Nrf2)是机体重要的抗氧化分子,可以靶向调控血红素氧化酶1(heme oxygenase 1,HO⁃1),影响心肌细胞凋亡[6],在心肌缺血再灌注损伤的发病过程中起到重要作用[7]。FAT10 与Nrf2/HO⁃1 通路的关系尚不清楚,本研究采用小干扰RNA(siRNA)沉默FAT10 蛋白,检测心肌细胞凋亡情况,旨在探讨FAT10 在心肌缺血再灌注损伤中的作用,现将结果报道如下。
1 材料与方法
1.1 细胞与试剂
H9C2 大鼠心肌细胞购于通派(上海)生物科技有限公司,胎牛血清、DMEM 培养基和胰蛋白酶购于上海卧宏生物科技有限公司,细胞活力检测试剂盒(cell cuounting kit 8,CCK⁃8)和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购于武汉卡诺斯科技有限公司,BCA 蛋白定量试剂盒和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodec⁃yl sulfate polyacrylamide gel electrophoresis,SDS⁃PAGE)凝胶制备试剂盒购于北京索莱宝科技有限公司,siRNA 转染试剂购于美国Sigma 公司,An⁃nexin V⁃FITC/PI 细胞凋亡检测试剂盒购于上海翊圣生物科技有限公司,FAT10 抗体、Nrf2 抗体、HO⁃1抗体、GAPDH 抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔抗体均购于美国bioxcell 公司,混合气体购于上海恒远生物科技有限公司,FAT10 沉默序列由上海吉玛制药技术有限公司设计并提供,序列为:5′⁃GCCCTTACC⁃GTTCCAAGGCC⁃3′。
1.2 方法
1.2.1 细胞培养
将H9C2 细胞置于含有10%胎牛血清、1%青霉素/链霉素双抗混合液的DMEM 培养基中,进行传代培养,培养条件为5% CO2、37℃。待细胞生长至80%时,用胰蛋白酶消化进行传代。
1.2.2 心肌细胞缺氧复氧模型的构建
将细胞(密度为2×105/孔)接种于6 孔板中,在5% CO2、37℃条件下培养48 h。将95%氮气和5%CO2充入Concept 400M 厌氧培养箱,构建缺氧复氧模型。将细胞分为对照组、缺氧4 h 组、复氧2 h组及复氧4 h 组。对照组正常培养。缺氧前首先将DMEM 培养基更换为无糖无血清培养基,进行同步化处理3 h,随后将缺氧组及复氧组细胞放入厌氧培养箱,冲入混合气体,缺氧4 h 后取出。复氧组将培养基更换为DMEM 培养基,在5% CO2、37℃条件下进行复氧处理2、4 h。
1.2.3 CCK⁃8 法检测心肌细胞活力
将心肌细胞(密度为8×103/孔)接种于96 孔板,对照组正常培养,其余组缺氧复氧处理后,加入CCK⁃8 溶液,孵育1 h,操作步骤严格按照试剂盒说明书进行。使用BK⁃EL10C 酶标仪在450nm处检测光密度值。实验重复4 次。
1.2.4 微量酶标法检测LDH
建立心肌细胞缺氧复氧模型后,取细胞上清液,使用LDH 试剂盒以微量酶标法检测LDH,操作步骤严格按照试剂盒说明书进行。实验重复4 次。
1.2.5 Annexin V⁃FITC/PI 法检测心肌细胞凋亡
将细胞制成1×106个/mL 的悬液,加入5 μL 异硫氰酸荧光素,孵育10 min,随后加入2.5 μL 碘化丙啶,孵育5 min。最后使用美国Orflo 流式细胞仪检测凋亡率。实验重复4 次。
1.2.6 细胞转染
将心肌细胞(密度为2×105/孔)加入6 孔板,用120 μL riboFECT CP Buffer(v2)转染试剂稀释10 μL 的siRNA 储备液,随后加入12 μL ribo⁃FECT CP Buffer(v4),温室孵育10 min。随后将混合物加入1 858 μL 的DMEM 培养基中。用脂质体转染法将阴性对照RNA 序列(si⁃CON)和FAT10 沉默序列转入心肌细胞。将心肌细胞分为对照组、缺氧4 h+si⁃CON 组(阴性对照)、缺氧4 h+siRNA 组、复氧4 h+si⁃CON 组(阴性对照)、复氧4 h+siRNA 组。
1.2.7 Western⁃blot 检测心肌细胞FAT10、Nrf2、HO⁃1 蛋白表达水平
用RAPI 裂解液提取心肌细胞中的总蛋白,用BCA 试剂盒检测蛋白浓度,10% SDS⁃PAGE 电泳分离蛋白,用半干转移法将蛋白转至PVDF 膜上。随后用5%脱脂奶粉封闭1 h,加入FAT10 抗体(稀释500 倍)、Nrf2 抗体(稀释1 000 倍)、HO⁃1 抗体(稀释1 000 倍),4℃过夜孵育,次日除去一抗,用TBST 缓冲液洗涤3 次后加入二抗。用ECL 发光仪成像,Image J 软件分析灰度值。
1.3 统计学方法
采用SPSS 20.0 统计软件进行统计处理。计量资料以()表示,多组间比较采用单因素方差分析,组内两两比较用LSD⁃t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 缺氧复氧模型的建立
细胞活性检测结果显示,随时间延长,心肌细胞存活率下降,在复氧4 h 后最低。复氧4 h 组细胞存活率低于对照组,差异有统计学意义(P<0.05)。LDH 检测结果显示,随时间延长,心肌细胞损伤加重,在复氧4 h 后最严重。复氧4 h 组LDH 活性高于对照组,差异有统计学意义(P<0.05)。流式细胞术检测结果显示,在复氧4 h 后心肌细胞凋亡率最高。复氧4 h 组细胞凋亡率高于对照组,差异有统计学意义(P<0.05)。见表1、图1。
表1 各组细胞存活率、LDH 活性和细胞凋亡率比较(±s)Table 1 Comparison of cell survival rate,LDH activity and apoptosis rate in each group(±s)
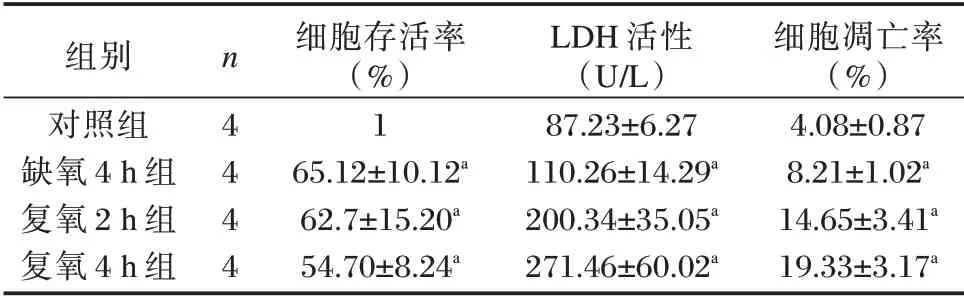
表1 各组细胞存活率、LDH 活性和细胞凋亡率比较(±s)Table 1 Comparison of cell survival rate,LDH activity and apoptosis rate in each group(±s)
注:与对照组比较,aP<0.05。
组别对照组缺氧4 h 组复氧2 h 组复氧4 h 组n 4 4 4 4细胞存活率(%)1 65.12±10.12a 62.7±15.20a 54.70±8.24a LDH 活性(U/L)87.23±6.27 110.26±14.29a 200.34±35.05a 271.46±60.02a细胞凋亡率(%)4.08±0.87 8.21±1.02a 14.65±3.41a 19.33±3.17a
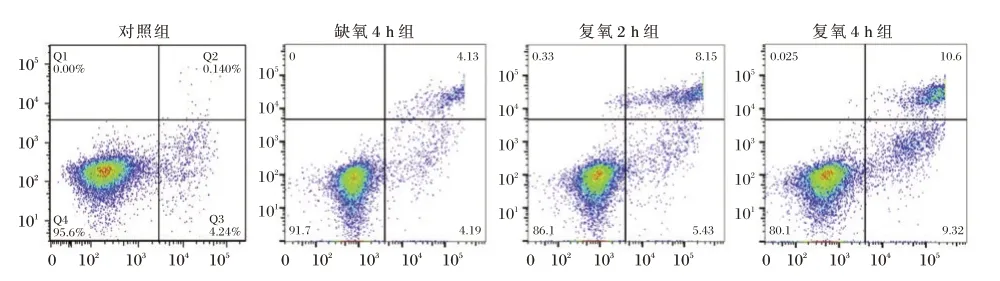
图1 流失细胞术检测的代表性图片Figure 1 Representative images of drain cytometry assays
2.2 缺氧复氧对FAT10 蛋白表达的影响
FAT10 蛋白表达水平:复氧4 h+si⁃CON 组>缺氧4 h+si⁃CON 组>对照组,差异均有统计学意义(P<0.05)。见表2、图2。
表2 各组FAT10 蛋白相对表达量及细胞凋亡率比较(±s)Table 2 Comparison of the relative expression of FAT10 protein and cell apoptosis rate in each group(±s)

表2 各组FAT10 蛋白相对表达量及细胞凋亡率比较(±s)Table 2 Comparison of the relative expression of FAT10 protein and cell apoptosis rate in each group(±s)
注:与对照组比较,aP<0.05;与缺氧4h+si⁃CON 组比较,bP<0.05;与对应的阴性对照组比较,c P<0.05。
组别对照组缺氧4h+si⁃CON 组缺氧4h+siRNA 组复氧4h+si⁃CON 组复氧4h+siRNA 组n4 4 4 4 4蛋白相对表达量1 1.67±0.23a 1.12±0.20c 2.02±0.31ab 1.03±0.17c细胞凋亡率(%)3.67±1.50 7.43±2.03 14.04±3.15c 12.00±2.32 16.46±1.29c

图2 Western⁃blot 检测的代表性条带Figure 2 Representative bands detected by Western⁃blot
2.3 沉默FAT10 表达对心肌细胞凋亡的影响
FAT10 蛋白表达水平:复氧4 h+siRNA 组<缺氧4 h+siRNA 组<缺氧4 h+si⁃CON 组,见表2、图2。沉默FAT10 后细胞凋亡率升高(P<0.05)。见表2、图3。
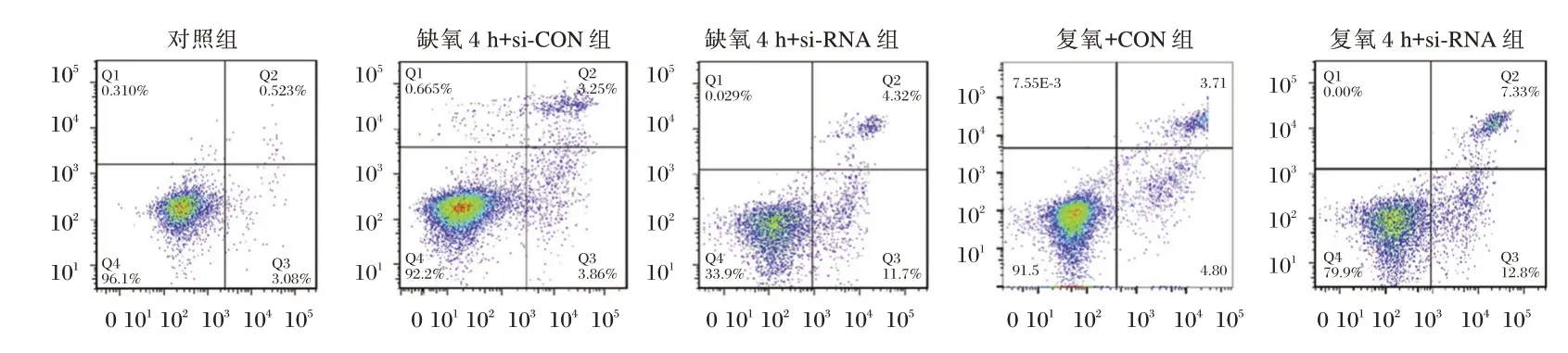
图3 流失细胞术检测的代表性图片Figure 3 Representative images of drain cytometry assays
2.4 沉默FAT10 表达对Nrf2、HO⁃1 蛋白表达水平的影响
缺氧复氧损伤使FAT10 蛋白表达水平增加,Nrf2、HO⁃1 蛋白表达水平也增高。沉默FAT10后,Nrf2、HO⁃1 蛋白表达水平降低(P<0.05)。见表3和图4。
表3 各组FAT10、Nrf2、HO⁃1 蛋白表达水平比较(±s)Table 3 Comparison of protein expression levels of FAT10,Nrf2 and HO⁃1 in each group(±s)
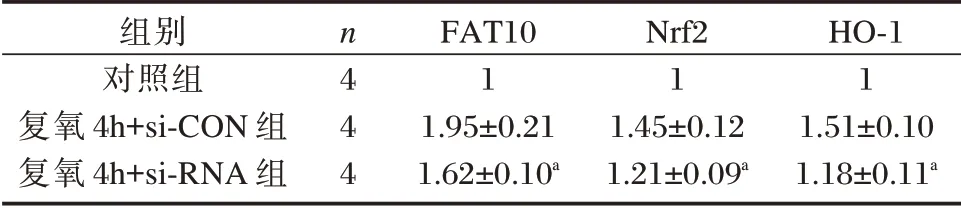
表3 各组FAT10、Nrf2、HO⁃1 蛋白表达水平比较(±s)Table 3 Comparison of protein expression levels of FAT10,Nrf2 and HO⁃1 in each group(±s)
注:与复氧4h+si⁃CON 组比较,aP<0.05。
组别对照组复氧4h+si⁃CON 组复氧4h+si⁃RNA 组n4 4 4 FAT10 1 1.95±0.21 1.62±0.10a Nrf2 1 1.45±0.12 1.21±0.09a HO⁃1 1 1.51±0.10 1.18±0.11a
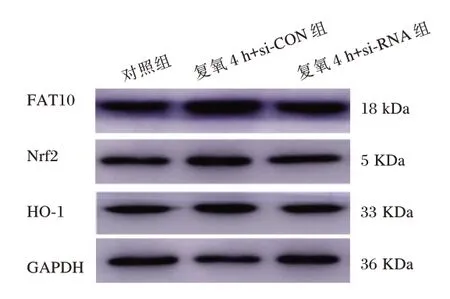
图4 Western⁃blot 检测的代表性条带Figure 4 Representative bands detected by Western⁃blot
3 讨论
心肌缺血再灌注损伤会造成一系列并发症,如心律失常、心衰等,对疾病预后造成不良影响[8]。心肌缺血再灌注损伤的发病机制目前尚未完全明确,可能与氧化应激损伤、钙离子超载、能量代谢障碍、免疫炎症损伤等有关[9⁃10]。心肌缺血再灌注损伤过程中存在心肌细胞凋亡现象,如何减少心肌细胞凋亡已成为疾病研究热点[11⁃12]。FAT10 是泛素样蛋白家族成员之一,由165 个氨基酸组成,其基因位于6 号染色体上。既往FAT10在肿瘤疾病中被研究的较多,FAT10 与细胞增殖、细胞周期、凋亡和免疫反应密切相关[13]。研究发现,FAT10 可以通过稳定caveolin⁃3 缓解缺氧诱导的心肌细胞凋亡[14]。另外,FAT10 可以抑制沉默信息调节因子1(silent information regulator 1,SIRT1)改善心肌细胞自噬,进而对缺血心肌组织起到保护作用[15]。
FAT10 与心肌缺血再灌注损伤的关系,既往未见报道。本研究将95%氮气和5% CO2充入Concept 400M 厌氧培养箱,构建缺氧复氧模型。细胞活性检测结果显示,随时间延长,心肌细胞存活率下降,在复氧4 h 后最低。复氧4 h 组细胞存活率低于对照组。LDH 检测结果显示,随时间延长,心肌细胞损伤加重,在复氧4 h 后最严重。复氧4 h 组LDH 活性高于对照组。流式细胞术检测结果显示,在复氧4 h 后心肌细胞凋亡率最高。复氧4 h 组细胞凋亡率高于对照组。结合上述结果,本研究选择缺氧4 h、复氧4 h 为模型建立的时间进行后续研究。缺氧4h、复氧4h 为模型建立的最佳时间,与既往报道一致[16]。在心肌细胞缺氧复氧过程中,心肌细胞FAT10 表达水平升高。
本研究中,缺氧4 h+si⁃CON 组FAT10 蛋白相对表达水平高于对照组,复氧4 h+si⁃CON 组FAT10 蛋白相对表达水平高于对照组,复氧4 h+si⁃CON 组FAT10 蛋白相对表达水平高于缺氧4 h+si⁃CON 组,提示FAT10 参与了缺氧复氧损伤过程,可能是保护心肌细胞损伤的因子。此外,沉默FAT10 后细胞凋亡率升高,说明FAT10 激活与心肌细胞凋亡有关,可能起到保护作用。Nrf2 是抗氧化应激损伤的重要分子,受到刺激后,Nrf2 进入细胞核,与氧化应答元件结合后被激活,进而靶向作用于HO⁃1,发挥抗氧化作用[17]。既往研究显示,Nrf2/HO⁃1 通路与心肌细胞凋亡有关[17]。本研究发现,沉默FAT10 基因后Nrf2 和HO⁃1 蛋白表达水平降低,提示FAT10 可能通过激活Nrf2/HO⁃1通路对心肌细胞缺氧复氧损伤起到保护作用。
综上所述,FAT10 可能通过Nrf2/HO⁃1 通路抗心肌细胞凋亡,进而对缺氧修复损伤起到保护作用,FAT10 可能成为缺血再灌注损伤的潜在靶点。然而本研究仅分析了FAT10 对心肌细胞存活及凋亡的影响,未分析心肌细胞免疫炎症损伤、氧化应激损伤等的变化,而这些变化与缺血再灌注损伤密切相关。未来需要开展细胞和动物研究,进一步明确FAT10 在缺血再灌注中的作用及机制。
