杨树菇凝集素在乳腺癌血浆中检测 GlcNAc修饰蛋白的应用
2022-09-02陈丽琼关鑫黄壮霖曾淑娴张文鑫梁一
陈丽琼,关鑫,2,黄壮霖,曾淑娴,张文鑫,梁一*
(1.广东医科大学医学技术学院检验医学研究所临床免疫学教研室,广东省医学分子诊断重点实验室,广东东莞 523808)(2.天津市滨海新区疾病预防控制中心,天津 300450)
乳腺癌(Breast cancer,BC)是全球女性高发且死亡率高的恶性肿瘤之一,早期诊断对降低死亡率意义重大。目前临床诊断手段主要是乳腺造影、超声、病理组化等,检测到的依然是晚期阶段。因此,寻找早期更高效的分子标志物是临床诊断及疾病监控亟需解决的重要问题[1]。
糖基化是一种重要的蛋白翻译后修饰,糖基化蛋白水平的检测被认为是一种新型肿瘤标志物,可提高单纯检测蛋白水平的临床诊断效能[2,3]。乳腺癌中被报道存在异常唾液酸化sialylation、岩藻糖修饰fucosylation、O-Glycosylation、末端β-N-acetylglucosamine(GlcNAc)修饰(包括O-GlcNAcylation)[4-8]。多项研究发现,末端GlcNAc的修饰出现在睾丸细胞表面[9,10]、人白血病细胞[11]、结肠癌相关抗原[12]、及前列腺癌患者血清中[13],且这种修饰在多种恶性肿瘤(包括乳腺癌)患者血清中出现,被认为是一种肿瘤相关糖基抗原[8]。然而,由于缺少特异性的抗体,这种糖基结构目前研究甚少。
凝集素可与不同糖基结构有高亲和力的作用,被广泛用于糖生物学的研究[14,15]。检测GlcNAc常用的凝集素主要有麦胚凝集素(wheat germ agglutinin,WGA)[16]、加纳籽凝集素(Griffonia simplicifolialectin-II,GSL-II)[17]和杨树菇凝集素(Agrocybe aegeritalectin 2,AAL2)[18],其中,AAL2被认为是结合末端GlcNAc糖修饰亲和力和特异性最高的凝集素[18,19]。因此,本文将检测健康人(Healthy volunteers, HE)和乳腺癌患者(BC)血浆中三种候选肿瘤标志物血浆蛋白酶C1抑制剂(plasma protease C1 inhibitor,C1Inh)、Serpin B4和血清转铁蛋白(serotransferrin,TF)的蛋白表达水平,并用反向凝集素(AAL2)ELISA法检测三种候选标志物的GlcNAc修饰的糖蛋白表达水平,探讨其蛋白表达和糖蛋白表达水平的诊断效能差别,为糖蛋白在疾病诊断中的意义及凝集素的应用提供数据。
1 材料与方法
1.1 临床血浆样本采集
53例血浆标本来自广东省中山市小榄医院乳腺癌患者,所有患者均经术后病理检查确诊,根据美国癌症划分联合委员会(American Joint Commission for Cancer Staging,AJCC)的第七版乳腺癌临床分期标准,分为Stage0:TisN0M0;StageⅠ:T1N0M0;StageⅡA:T0N1M0,T1N1M0,T2N0M0;StageⅡB:T2N1M0,T3N0M0;StageⅢA:T0N2M0,T1N2M0,T2N2M0,T3N1-2M0;StageⅢB:T4N0-2M0;StageⅢC:任何TN3M0;StageⅣ:任何T任何NM1。其中Tis是原位癌,T代表原发性肿瘤,N即为区域淋巴结,M表示远处转移。分组为Breast cancer 1(BC1)组:26例Stage I和Stage IIa;BC2组:9例Stage IIb;BC3组:14例Stage IIIa和Stage IIIb;BC4组:4例Stage IV。同期在东莞市第六人民医院体检科收集21例健康女性体检者血浆为对照。所有参与者均通过书面知情同意并通过广东医科大学和样本来源医院伦理委员会论证。患者标本信息列于表1。
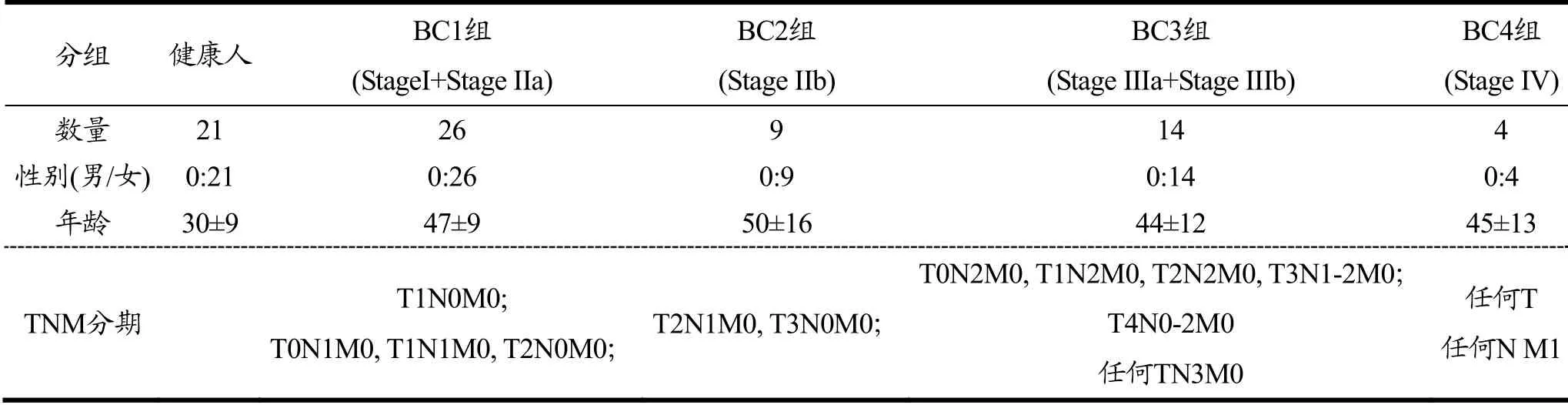
表1 乳腺癌患者和健康者临床统计信息 Table 1 Clinical and demographic characteristics of breast cancer patients and healthy volunteers
标本收集真空抗凝管中,4 ℃,400 g,离心10 min,离心后血浆分装于冷冻管中,保存在-80 ℃低温冰箱中,每支冻存管内的血浆标本不得反复冻融超过3次。
1.2 凝集素的制备
杨树菇凝集素的制备参考之前的方法[18-20]。杨树菇干粉通过浸泡、过滤和离心方式收集滤液。在滤液中加入硫酸铵至饱和度为40%,搅拌20 min,离心收集上清。在上清中加入硫酸铵至80%饱和度,沉淀60 min后离心收集沉淀。用PBS重悬沉淀,透析除盐得到总蛋白。用0.45 μm的滤膜过滤总蛋白,安装GlcNAc-Sepharose 6B亲和层析柱,用TBS(20 mmol/L Tris-Cl,pH 7.4,0.5 mol/L NaCl,1 mmol/L CaCl2,1 mmol/L MnCl2)平衡柱子30 min,调节流速为1 mL/min。将总蛋白溶液上样到亲和层析柱,TBS溶液洗脱杂蛋白,用200 mmol/L GlcNAc的TBS缓冲液洗脱,收集目的蛋白AAL2,透析真空干燥后于-20 ℃保存。
1.3 免疫印迹
经BCA试剂盒定量,取50 μg~100 μg血浆蛋白,使用12%的SDS-PAGE电泳完成蛋白分离,依据目的蛋白分子量大小以250 mA进行转膜60 min,用3% BSA在室温封闭1 h。将一抗anti-serpin B4、anti-serotransferrin、anti-plasma protease C1 inhibitor(ProteinTech,武汉)用封闭液稀释(1:1000),4 ℃孵育过夜。用TBST室温洗涤三次,每次10 min。加入HRP-羊抗兔IgG稀释液(1:2000),室温孵育2 h,用TBST洗脱三次,每次10 min。蛋白条带使用化学发光法ECL系统(Thermo)检测,用凝胶图象处理系统(imageJ)分析目标条带的相对灰度值。
1.4 反向凝集素ELISA
用4 μg/mL的AAL2(溶于15 mmol/L碳酸钠缓冲溶液,pH 9.6)包被96孔ELISA板,4 ℃过夜,PBST清洗一次,使用5%脱脂奶粉封闭液4 ℃封闭5 h,洗涤五次。每孔加入100 μL的1:20稀释的血浆标本,室温孵育1 h,洗涤五次,加入生物素标记的目的糖蛋白抗体(1:1500)室温孵育1 h,洗涤五次,加入HRP-链霉亲和素(1:1000)孵育1 h,洗涤五次,加入TMB反应15~30 min,加入终止液,于酶标仪波长450 nm下检测。
1.5 统计学方法
免疫印迹和反向lectin-ELISA数据使用GraghPad Prism软件的nonparametric unpaired t-test做统计分析,p<0.05表示有统计学差异。使用SPSS统计学软件(15.0版本)分析ROC曲线下面积,多元方差分析通过逻辑回归完成。
2 结果与讨论
2.1 乳腺癌与健康人群血浆候选肿瘤标志物的蛋白水平比较
在之前的研究当中,我们通过凝集素富集结合质谱鉴定到53种差异表达蛋白,从中选择C1Inh、Serpin B4和TF这三个蛋白,通过免疫印迹和ROC曲线进一步验证其表达差异。
如图1a~1d所示,与HE组相比,C1Inh的蛋白表达水平在BC3、BC4和扩散期疾病组(extensive stage disease,ED)显著降低(图1a~1d)。与BC1组相比,C1Inh的蛋白表达水平在BC4组显著降低(p<0.05)。与BC2组相比,C1Inh的蛋白表达水平在BC4组也显著降低(p<0.01)(图1a~1d)。由此可见,C1Inh的蛋白表达水平在乳腺癌患者中明显降低,且随着病情的加重其表达越低。HE/BC1、HE/局限性疾病组(limited stage disease,LD)、HE/ED分别的ROC线下面积(area under curve,AUC)分别为0.66、0.58和0.80。
Serpin B4也叫鳞状细胞癌抗原(squamous cell carcinoma antigen 2,SCCA2),被报道在多种肿瘤(包括宫颈癌、肺癌、肝癌等)中高表达[21-23],我们的结果中也发现,与HE组相比,serpin B4的蛋白表达水平在BC2组显著升高(p<0.05)(图1e~1h),与BC1组相比,serpin B4的蛋白表达水平在BC2组也显著升高(p<0.05)(图1e~1h),这与在其他肿瘤中的研究是一致的。同时结果表明serpin B4在HE/BC1、HE/LD、HE/ED组的AUC值分别为0.62、0.64和0.68。TF蛋白是血清和脑脊液中通过转运调控铁含量的糖蛋白,它还是负向调节的急性期蛋白,其蛋白表达水平在不同病理状态下不同[24],例如,在胃癌[25]、宫颈癌[26]、卵巢癌[27,28]中降低,在胰腺癌中升高[29]。我们的结果中与HE相比,TF蛋白的表达水平在BC1、BC2、BC4和LD显著降低(图1i~1l),这与大多数肿瘤中的表达是一致的。同时,与BC1组相比,TF的蛋白表达水平在BC4组显著降低(p<0.05)(图1i~1l)。另外,TF蛋白在HE/BC1、HE/LD和HE/ED组的AUC值分别为0.73、0.74和0.81。
2.2 乳腺癌与健康人群血浆候选肿瘤标志物的GlcNAc修饰蛋白水平比较
研究表明,反向凝集素ELISA可用于检测糖基化修饰的蛋白[30-32]。因此为了检测样本中GlcNAc修饰的C1Inh、serpinB4和TF的表达水平,建立了一种基于AAL2的反向凝集素ELISA技术。用凝集素AAL2包被ELISA板,利用凝集素与相应糖基特异性结合的特点富集样品中带有N-乙酰葡萄糖胺的糖蛋白后,再用肿瘤标志物对应的生物素化的抗体检测,进而评估样品中糖蛋白水平的差异。如图2a~2d,与健康对照组相比,GlcNAc修饰的C1Inh的表达在BC1、BC2、BC3、BC4、LD和ED组显著升高,且与LD组相比,GlcNAc修饰的C1Inh的表达在ED组显著升高,与BC1组相比,GlcNAc修饰的C1Inh的表达在BC2、BC4组均升高。与健康对照组相比,GlcNAc修饰的serpin B4在BC1、BC3、BC4、LD和ED组均显著降低,且与LD组相比,GlcNAc修饰的serpin B4的表达在ED组中显著降低(图2e~2h),与BC1组相比,GlcNAc修饰的serpin B4的表达在BC4组中显著降低(图2e~2h)。与健康对照组相比,GlcNAc修饰的TF表达在BC1、BC2、BC3、BC4、LD和ED组显著升高。值得注意的是,三个候选肿瘤标志物的糖蛋白表达水平和蛋白表达水平均不一致。大量蛋白质被发现具有糖基化修饰,研究表明这种糖基化的异常表达与肿瘤的进程有着重要的作用,同时糖基化修饰可以调节细胞过程,如信号转导、转录、翻译和蛋白质降解[33,34]。本实验结果发现,这三种蛋白的GlcNAc修饰水平在健康组和乳腺癌患者中的表达不同,提示GlcNAc修饰可能通过不同方式影响这三种蛋白的表达以及功能,进而影响其在乳腺癌中发挥不同的作用,其中的分子机制仍待进一步的探索。
研究表明,异常糖基化修饰的SCCA2会影响免疫检测反应[35],提示临床标本中存在糖基化serpin B4并且具有临床检测价值。像许多急性期蛋白[36],TF糖基化程度很高[24,37]。唾液酸化的TF在胃癌中高表达[38],而岩藻糖化的TF在肝癌中高表达[39],但在乳腺癌中低表达[40]。另外,tetrasialotransferrin(糖基化TF)在胰腺癌中高表达[24],而trisialotransferrin在肝癌中低表达[41]。本研究结果发现GlcNAc修饰的TF在乳腺癌中高表达,这说明TF上有多种类型糖基修饰,不同疾病模型中不同糖基修饰蛋白表达水平的检测值得进一步的探讨。
ROC曲线用于分析糖基化修饰蛋白在健康人和肿瘤患者之间的诊断价值。在健康组和BC1组,GlcNAc修饰的C1Inh、serpin B4和TF的AUC值分别是0.69、0.76和0.83。在健康组和LD组,GlcNAc修饰的C1Inh、serpin B4和TF的AUC值分别是0.75、0.74和0.84。在健康组和ED组,修饰的C1Inh、serpin B4和TF的AUC值分别是0.82、0.82和0.93(图2)。从表2中可见,糖基化蛋白表现出比检测总蛋白水平更好的诊断价值,GlcNAc修饰的TF在对BC1、LD和ED对健康人的诊断中,AUC值最高。
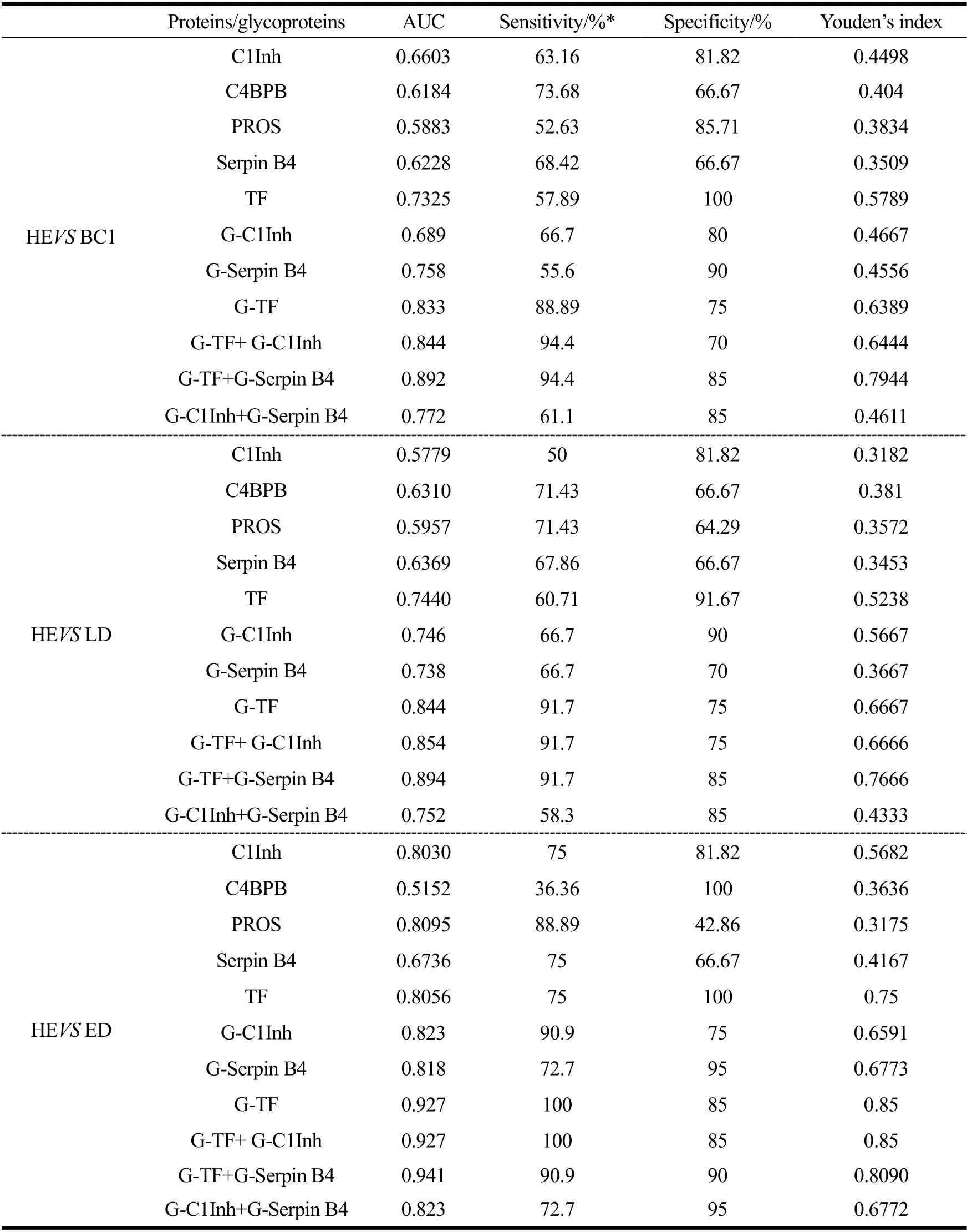
表2 候选蛋白及糖蛋白在乳腺癌中的临床诊断表现 Table 2 Performance of candidate proteins or glycoproteins in distinguishing breast cancer
大约有75种标志物被食品药品管理局Food and Drug Administration(FDA)批准,但绝大多数都只是用于辅助疾病的诊断[42]。而越来越多的研究表明,仅基于蛋白水平的生物标志物检测无法提供足够的特异性和敏感性[43-45]。一个最著名的例子就是core fucosylated alpha-fetoprotein(AFP-L3),比单独检测AFP具有更高的诊断价值[44],因此被FDA批准为肝细胞癌的诊断标志物。扁豆凝集素Lens culinarisagglutinin(LCA)常作为富集和检测AFP-L3的工具[46,47]。末端GlcNAc修饰蛋白在许多肿瘤中出现异常表达[8],而AAL2与末端GlcNAc结合亲和力很高,因此,可以用于GlcNAc修饰蛋白的检测。本研究发现C1Inh、serpin B4和TF蛋白水平和糖基化水平在乳腺癌患者血浆中的变化不一致,且糖蛋白的临床诊断价值均高于总蛋白的检测,这也进一步提示我们检测糖基修饰蛋白在疾病诊断中的重要意义[48]。
2.3 联合检测糖基化修饰蛋白的诊断价值评估
最后,使用ROC曲线评估联合检测糖基化蛋白的诊断价值(图3和表2)。HE组和BC1组之间,联合检测GlcNAc修饰的TF和GlcNAc修饰的serpin B4的AUC值是0.89,特异性和敏感性分别是85%和94%,比单独检测GlcNAc修饰的TF的特异性和敏感性都高。HE和LD组之间,联合检测GlcNAc修饰的TF和GlcNAc修饰的serpin B4的AUC值是0.89,特异性和敏感性分别是85%和91.7%,比单独检测GlcNAc修饰的TF的特异性高。HE和ED组之间,联合检测GlcNAc修饰的TF和GlcNAc修饰的serpin B4的AUC值是0.94,特异性和敏感性分别是90%和91%,比单独检测GlcNAc修饰的TF的特异性高。
3 结论
糖基修饰蛋白作为疾病标志物引起越来越多的关注,本文使用杨树菇凝集素AAL2结合GlcNAc修饰蛋白,通过反向凝集素ELISA检测末端GlcNAc修饰的C1Inh、serpin B4和TF,发现糖基化蛋白的水平与总蛋白表达水平在乳腺癌患者和健康人群中的变化不一致,且糖基化蛋白的诊断效能更高。其中GlcNAc修饰的TF和serpin B4可作为潜在的候选标志物,未来需要在大量标本中进一步验证凝集素在检测GlcNAc修饰蛋白的诊断应用。
