多环芳烃和镉土壤复合暴露条件下黑麦草的氧化应激指标变化
2022-09-02李程姚义鸣李逍逍成杰民孙红文
李程,姚义鸣,李逍逍,成杰民,孙红文
(1.山东师范大学地理与环境学院,济南 250358;2.南开大学环境科学与工程学院,教育部环境污染过程与基准教育部重点实验室,天津 300071)
镉(Cd)是一种剧毒重金属元素,是植物非必需元素,土壤中Cd的来源包括自然来源与人为来源,如肥料、灌溉水、动物粪便和大气沉降等。然而即使在非常低的浓度状态下,Cd也会强烈抑制植物的生长发育,甚至导致死亡。作为典型传统有机污染物,多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)主要来源于煤的不完全燃烧和其他化学产品的回收和加工。由于其具有易在环境中积累、远距离运输迁移转化以及极易进入生物体内等特性,对环境、生物和人类的健康带来潜在的威胁。随着工业化和城市化的不断推进,多数大中城市面临着工业企业搬迁,遗留污染场地增加,且场地土壤中的污染物种类复杂,目前国内外研究发现的场地Cd 和PAHs 复合污染主要分布于矿区、电子垃圾回收场地、油田基地、冶炼厂及钢铁厂等附近的土壤中。因此,场地中Cd与PAHs的复合污染问题受到广泛关注。
植物是生态系统的基本且关键的生物成分,当土壤环境受到污染时,也会不可避免地对植物造成毒性损害。Cd具有极强的生物积累性,土壤是植物暴露于Cd 的主要途径。有研究表明,大气中的Cd沉积到土壤中,使得土壤中Cd的生物可利用性提高,导致水稻中Cd 积累增加。同时,有研究发现当土壤中Cd 浓度达到125 mg·kg时,Cd 会在野生高粱(L.)和小花鬼针草(Willd.)这两种植物的地上部富集,且富集系数均大于1。植物吸收PAHs的来源复杂,除可以从根部吸收土壤中PAHs 以外,还可能通过叶面从大气中直接吸收。金发草(Lam.)暴露在芘(Pyrene,Pyr)浓度范围为20~322 mg·kg土壤中,其茎叶部中Pyr 的累积浓度最高能达到176 mg·kg。因此,土壤中重金属以及有机污染物会在植物体内累积,从而对植物造成伤害。
植物的抗氧化酶活性和氧化应激产物表达是植物毒性的常见指标。活性氧(Reactive oxygen species,ROS)的过度产生是植物对重金属和有机污染物应激的早期反应之一,过量的ROS 可能导致膜脂质、蛋白质和核酸氧化,进而导致细胞损伤。然而植物的抗氧化酶体系以及氧化应激产物可以减弱这些有害影响。有研究报道,植物可以通过调节多酚氧化酶(Polyphenol oxidase,PPO)和磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC)等抗氧化酶来应对体内氧化应激反应。同时,还原性谷胱甘肽(Reduced glutathione,GSH)和脯氨酸(Proline,Pro)可以缓解Cd 或者PAHs 对植物的胁迫反应。在植物受到胁迫的过程中,抗氧化酶活性以及氧化应激产物的浓度均会发生变化。因此,植物体内的抗氧化酶活性以及氧化应激指示物浓度的变化可以作为植物受到Cd和PAHs胁迫程度的指标,但目前仍未有针对这两类典型污染物复合污染条件下植物氧化应激效应的研究。
黑麦草(L.)是污染场地中普遍存在的植物之一,其生长周期较短且对有机和无机复合污染均具有较高的耐受性。模拟染毒试验中,黑麦草可以在PAHs 浓度为400 mg·kg的土壤中生长,同时在Cd 浓度为50~400 mg·kg的土壤中也具有一定的耐受性,因此可以作为指示Cd 和PAHs 复合污染效应的模式生物。本研究以黑麦草作为模式植物,开展盆栽试验,分别研究Cd 和PAHs 单一暴露下黑麦草氧化应激指标的剂量-效应关系;同时,考虑到PAHs 的面源污染特征,本研究拟以PAHs 的高、低浓度为背景值,研究不同土壤Cd 浓度暴露对黑麦草氧化应激效应的影响,并阐明土壤PAHs和Cd共同暴露条件下影响植物氧化应激的联合作用机制,以期为场地土壤PAHs 和Cd 复合污染指示物的筛选和复合污染的风险评价提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试土壤与种子
供试土壤为山东滨州典型土壤类型潮土,其基本理化性质如表1 所示。供试黑麦草种子由浙江杭州金阳光种业提供。

表1 供试土壤基本理化性质Table 1 Physical and chemical properties of the experimental soil
1.1.2 主要试剂
试供试剂 萘(Naphthalene,Nap)、菲(Phenanthrene,Phe)、蒽(Anthracene,Ant)、Pyr、苗屈(Chrysene,Chr)、苯并[a]芘(Benzo[a]pyrene,BaP)和水合氯化镉(CdCl·2.5HO)均购自中国上海麦克林生化科技有限公司,丙酮(色谱纯)购自中国上海安谱实验科技股份有限公司。PPO 试剂盒(微量法)、PEPC 试剂盒(微量法)、Pro 试剂盒(微量法)和GSH 试剂盒(微量法)均购自北京索莱宝科技有限公司。
1.2 试验设计
盆栽试验于2021年4—6月在天津市南开大学综合实验楼温室进行。选取土壤环境中普遍存在的具有不同苯环数的6 种PAHs(Nap、Phe、Ant、Pyr、Chr 和BaP)和Cd 作为供试污染物。PAHs 和Cd 浓度设置如表2 所示,设置依据为葫芦岛场地Cd 和PAHs 浓度,场地土壤中Cd 浓度范围为0.19~114.00 mg·kg,16种优先控制PAHs 总浓度范围为316~492 mg·kg。根据此浓度范围进行人工模拟染毒。土壤单一暴露Cd 和PAHs 的染毒方法如下:取6 种PAHs 标品各500 mg溶于100 mL丙酮中,并将其与1 kg空白土混匀,配制PAHs 单体浓度均为500 mg·kg的染毒土1 kg,然后与空白土逐级混合,分别配制出名义单体浓度梯度为0、10(C1)、20(C2)、50(C3)、100(C4)mg·kg的PAHs 染毒土;取CdCl·2.5HO 标品2 500 mg 溶于100 mL 水中,并将其与5 kg 空白土混匀,配制500 mg·kg的染毒土5 kg,然后与空白土逐级混合,分别配制出名义浓度梯度为0、10(T1)、20(T2)、50(T3)、100(T4)mg·kg的Cd 染毒土。土壤复合暴露Cd 和PAHs 的染毒方法如下:将Cd 染毒梯度的土壤分成3组,其中一组用于单一暴露试验,另外两组土壤中分别加入丙酮配制的PAHs 染毒液。使其名义单体浓度分别达到10 mg·kg和100 mg·kg。将对照组(CK)土壤和各组染毒土壤装于内径12 cm、高15 cm的花盆中,再向花盆中加入等量去离子水调节土壤含水量为60%。根据前人对重金属和PAHs 的研究,确定重金属和PAHs 染毒土壤老化时间为两周。选择饱满、大小均匀的黑麦草种子,用3% HO溶液表面灭菌20 min,种植在空白土中,14 d 后,待黑麦草长至20 cm 左右高度,选取长势相同的黑麦草移植到装有染毒土的花盆当中,生长21 d。温室条件:温度20 °C/15 °C(昼/夜),光周期16 h/8 h(昼/夜)。21 d 后收集植物样品。将所有样品叶片用PBS 缓冲溶液清洗后,称量黑麦草地上部生物量,分析其抗氧化酶活性和氧化应激指示物的浓度。

表2 土壤Cd和PAHs处理的试验设计(mg·kg-1)Table 2 Experimental design of Cd and PAHs soil treatment(mg·kg-1)
1.3 黑麦草地上部生物量的测定
将黑麦草植株从盆栽中取出,分离茎叶和根,将茎叶分别用自来水、蒸馏水冲洗后,用滤纸吸干,用万分之一天平分别称量每个处理组中黑麦草茎叶质量。
1.4 植物抗氧化酶活性和氧化应激产物的测定
取新鲜的叶片,分别用自来水、蒸馏水和PBS 缓冲液冲洗后,在液氮中均匀磨成细粉,利用试剂盒(微量法)提供的说明书中的方法处理植物,提取植物的抗氧化酶以及氧化应激产物,使用酶标仪(SPARK20M,TECAN,瑞士)测定其抗氧化酶活性以及氧化应激产物的浓度。
1.5 数据统计
用Microsoft Excel 和Origin 2018 进行统计分析,用SPSS 26 进行单因素ANOVA 分析,采用LSD 和沃勒邓肯法进行差异显著性检验。
2 结果与分析
2.1 单一Cd 染毒、单一PAHs 染毒和复合染毒对黑麦草生长的影响
不同处理组黑麦草的地上部生物量如图1 所示。与对照组相比,各处理组黑麦草的生物量在单一和复合暴露条件下均显著降低,但在复合污染与单一污染之间,黑麦草的生物量并无显著差异;且在各染毒组内,随染毒浓度增加黑麦草生物量变化普遍不显著。上述结果说明Cd 和PAHs 的单一或复合暴露对黑麦草的生长状态有一定负面影响,但仍在耐受范围内。
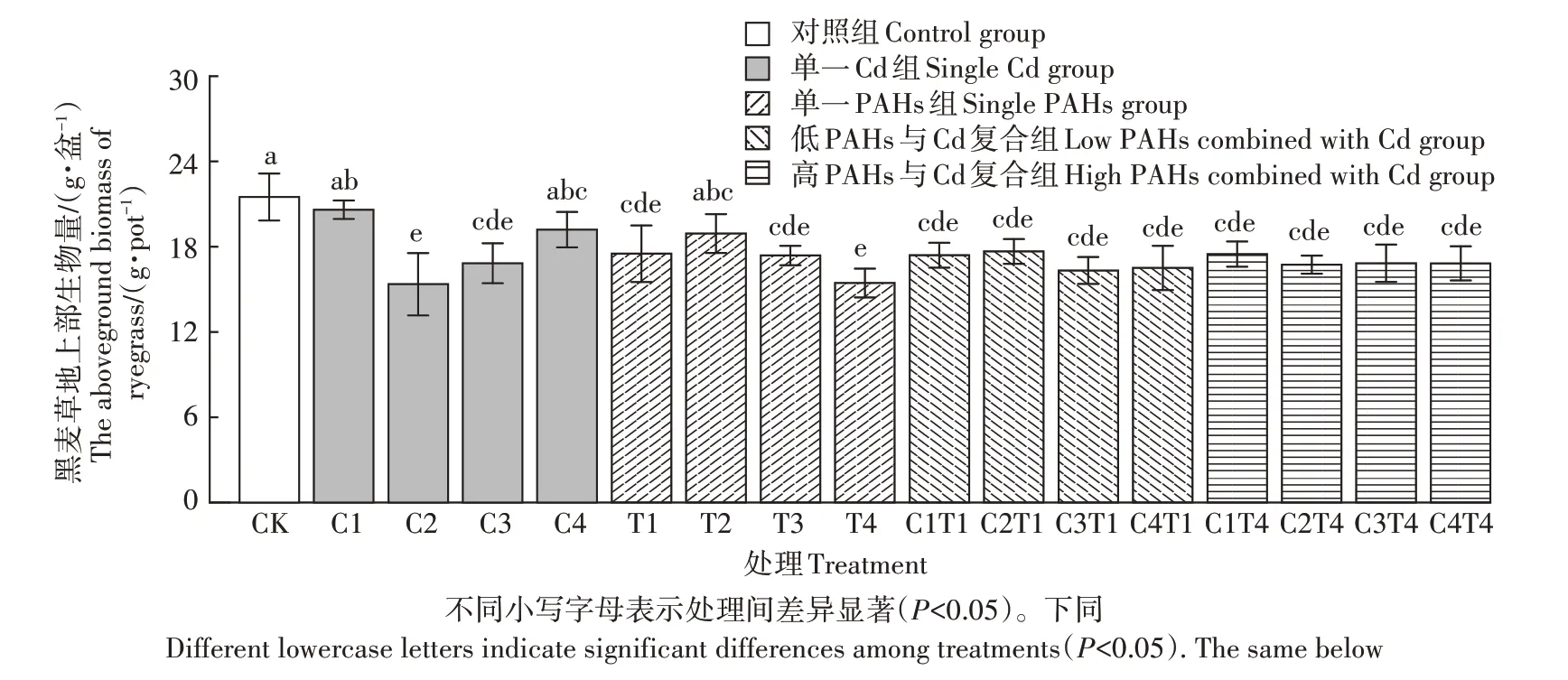
图1 21 d培养后黑麦草地上部生物量Figure 1 The aboveground biomass of ryegrass after 21 days of cultivation
2.2 单一Cd 染毒下黑麦草抗氧化酶以及氧化应激产物的变化趋势
Cd 胁迫导致黑麦草体内抗氧化酶活性和氧化应激产物浓度均发生了显著变化。如图2 所示,随着土壤中Cd 浓度的升高,PEPC 的活性和Pro 的浓度均呈现先升高后下降的趋势,在Cd浓度为50 mg·kg时均达到最大值;而GSH 浓度呈现递增趋势,PPO 活性呈现递减趋势。
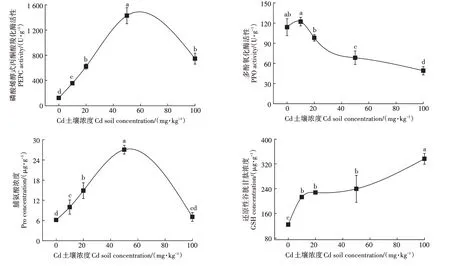
图2 Cd染毒黑麦草抗氧化酶活性和氧化应激产物变化趋势Figure 2 The change trend of antioxidant enzyme activities and oxidative stress products in ryegrass under exposure of Cd
2.3 单一PAHs染毒下黑麦草抗氧化酶以及氧化应激产物的变化趋势
PAHs胁迫导致了黑麦草体内抗氧化酶活性和氧化应激产物浓度均发生了显著变化。由图3可知,随着土壤中PAHs浓度的升高,PEPC的活性和GSH、Pro的浓度均呈现先升高后下降的趋势,在PAHs单体浓度为50 mg·kg时达到最大值,PEPC的活性和Pro浓度的变化与Cd染毒条件下的变化趋势一致;PPO活性呈现显著下降趋势,但在PAHs单体浓度达到20 mg·kg以上时,抑制水平趋于稳定,不再有显著变化。
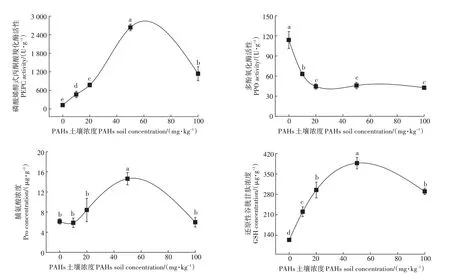
图3 PAHs染毒黑麦草抗氧化酶活性和氧化应激产物变化趋势Figure 3 The change trend of antioxidant enzyme activities and oxidative stress products in ryegrass under exposure of PAHs
2.4 Cd-PAHs 复合染毒下黑麦草抗氧化酶以及氧化应激产物的变化趋势
为了探究PAHs 高低两个浓度与Cd 复合染毒对黑麦草抗氧化酶以及氧化应激产物的影响,分别将PAHs 高低两个浓度与Cd 复合染毒下黑麦草的4 种指标变化与单一Cd 染毒下黑麦草的4 种指标变化进行对比。如图4和图5所示,红线分别代表高低PAHs浓度与Cd 复合染毒下黑麦草4 种指标的变化趋势。由图4 可知,对于低浓度PAHs 与Cd 复合染毒组,随着Cd 浓度升高,黑麦草PEPC 活性整体呈上升趋势;PPO 活性呈先上升后下降趋势,在Cd 浓度为10 mg·kg时达到最大值;Pro 浓度未发生显著变化,但在Cd浓度为100 mg·kg时显著上调;GSH 浓度呈先上升后下降趋势,在Cd 浓度为50 mg·kg时达到最大值。由图5 可知,对于高浓度PAHs 与Cd 复合染毒组,随着Cd浓度升高,黑麦草PPO活性和Pro浓度均呈现先上升后下降趋势,在Cd浓度为20 mg·kg左右时达到最大值;PEPC 活性显著降低,当Cd 浓度达到20 mg·kg时抑制水平趋于稳定,不再有显著变化;而GSH浓度仅在Cd浓度为50 mg·kg时呈显著上升。
同时为了探究复合染毒的剂量效应关系,将单一Cd 染毒下黑麦草的抗氧化酶活性以及氧化应激产物浓度分别与10 mg·kg和100 mg·kg两个PAHs 染毒浓度下黑麦草的抗氧化酶活性以及氧化应激产物浓度直接加和,产生理论加和效应曲线,如图4和图5中蓝色虚线所示。无论PAHs 染毒浓度高低,Cd 和PAHs 复合染毒时,Pro、GSH 的浓度和PEPC、PPO 的活性均普遍显著低于理论加和效应的水平,说明Cd和PAHs 复合暴露对黑麦草的毒性作用表现为显著的拮抗效应,然而在高浓度的PAHs 条件下,Pro 浓度在Cd 浓度50 mg·kg以下时表现为协同效应,随着Cd浓度升高而转变为拮抗效应。
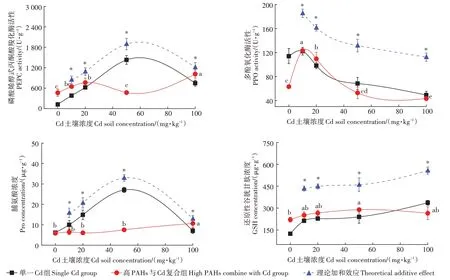
图4 低浓度PAHs与Cd复合染毒黑麦草抗氧化酶活性和氧化应激指示物变化趋势Figure 4 The change trend of antioxidant enzyme activity and oxidative stress products in ryegrass under exposure of low concentrations of PAHs and Cd

图5 高浓度PAHs与Cd复合染毒黑麦草抗氧化酶活性和氧化应激指示物变化趋势Figure 5 The change trend of antioxidant enzyme activity and oxidative stress products in ryegrass under exposure of high concentrations of PAHs and Cd
3 讨论
3.1 不同染毒组对黑麦草地上部生物量的影响
黑麦草的生物量是判断植物生长状况的一个重要指标,植物在Cd 与PAHs 胁迫作用下,生长会受到抑制,导致生物量下降。本研究发现,与对照组相比,所有染毒组生物量均有不同程度的减少(图1)。说明由于Cd和PAHs的胁迫作用,阻碍了黑麦草根系对营养物质的吸收,从而抑制了根系向地上部运输营养物质,影响了黑麦草的生长,导致其地上生物量降低,但并未表现出明显剂量-效应关系。
3.2 单一Cd 染毒对黑麦草抗氧化酶以及氧化应激产物的影响
当植物受到Cd 胁迫时,黑麦草的4 种指标均发生了显著变化,这说明Cd胁迫下,黑麦草体内会产生大量的ROS,激活植物体内的酶促系统和非酶促系统,从而产生氧化应激反应来进行自我保护。其中,PEPC的活性在一定Cd浓度内呈升高趋势(图1)。有研究表明PEPC 在大麦、小麦等单子叶植物中有重要的补给功能,并调节参与三羧酸循环(TCA 循环)的有机酸的合成。植物在受到Cd 胁迫时,体内有机酸也会参与缓解胁迫这一过程,因此随着Cd 浓度的增加,PEPC 的活性逐渐增大,缓解了Cd 对黑麦草的胁迫。PPO 活性降低是因为Cd 直接抑制了PPO基因的表达,从而抑制了其活性。GSH 和Pro 作为典型的非酶抗氧化剂,其浓度也随Cd 浓度增加而增加。GSH 是植物抗Cd 的重要物质之一,是以与重金属结合的植物螯合肽的前体,还可以在谷胱甘肽转移酶的作用下与重金属离子形成复合物,维持细胞内的离子平衡;GSH 还能通过谷胱甘肽-抗坏血酸循环(GSH-AsA 循环),对植物体内产生的ROS 进行清除。Pro 是植物调节细胞渗透压的重要物质,随着Cd 浓度的增加,Pro 通过调节细胞渗透压来提高其渗透吸水的能力,从而增加黑麦草对Cd 的耐受能力。而当Cd 浓度增大至100 mg·kg后,除GSH 浓度上升外,PPO、PEPC 活性和Pro 浓度均呈下降趋势,这是由于植物对Cd 的氧化应激引起了黑麦草生长障碍,随着Cd浓度的增加,酶活性抑制剂增加。GSH浓度增加也是由这一原因引起的。
3.3 单一PAHs染毒对黑麦草抗氧化酶以及氧化应激产物的影响
在PAHs 暴露条件下,黑麦草可通过调节各种抗氧化酶活性和氧化应激产物水平来缓解显著增加的ROS。有研究表明,PAHs 胁迫会影响植物的三羧酸循环,植物通过加快CO的运送、加速丙酮酸转化成乙酰辅酶A促进三羧酸循环来释放更多能量,从而积极调控植物相关防御基因的表达来应对PAHs 胁迫,因此PEPC 活性随着PAHs 浓度增加而升高,在单体浓度为50 mg·kg时达到最大值,而PPO 活性随着PAHs 浓度的增加逐渐降低,其原因可能是土壤PAHs毒性较高,超出了PPO的防御范围,从而产生了酶活性抑制剂,PPO 活性逐渐下降。有研究表明,在PAHs 胁迫下,拟南芥蛋白鸟嘌呤核苷酸结合蛋白(G 蛋白)和核苷二磷酸激酶(NDPK)的表达基因上调,激活体内丝裂原活化蛋白激酶(MAPK)途径和活性氧信号途径,使得谷胱甘肽还原酶(Glutathione reductase,GR)相关表达基因上调,因此GSH 浓度增大。在PAHs 胁迫下,植物渗透压升高,导致Pro浓度升高。当PAHs 单体浓度达到100 mg·kg时,毒性较大,导致植物机体受损,因此抗氧化系统受到破坏,所以PPO、PEPC 活性和GSH、Pro 浓度均呈下降趋势。
3.4 Cd-PAHs 复合染毒对黑麦草抗氧化酶以及氧化应激产物的影响
低浓度PAHs 与Cd 复合染毒下,黑麦草的PEPC活性和Pro 浓度的变化趋势与Cd 单一染毒相比有明显差异,而PPO 活性和GSH 浓度与Cd 单一染毒较为一致;高浓度PAHs 与Cd 复合染毒下,PEPC、PPO 活性和Pro、GSH 浓度与Cd 单一染毒相比均有明显差异。这说明复合染毒对黑麦草的胁迫与单一染毒存在显著不同。与单一染毒相比,复合染毒下4 种指标发生不同的变化,推测是由于黑麦草体内的氧化应激反应程度不同,同时植物的每个指标对过氧化伤害防御的阈值不同,且控制4 种指标相关的基因受到了不同程度的抑制。因此,PEPC 和PPO 的活性以及Pro和GSH 浓度的显著下调是土壤高浓度Cd和PAHs复合污染重要的植物生物效应指示物,这为场地复合污染风险评价提供了理论支撑。
本研究结果表明,高低浓度的PAHs与Cd的复合暴露条件下,黑麦草中PEPC、PPO、GSH 和Pro 4 种指标均普遍低于理论加和效应,这说明PAHs与Cd复合暴露对黑麦草的氧化应激效应不是简单的加和,而是呈现拮抗效应。通过分析发生拮抗效应的机理,推测低浓度PAHs的存在改变了黑麦草对Cd的吸收过程,影响了植物的三羧酸循环,同时影响了植物的氧化应激。有学者对羊头鱼的急性毒性反应进行研究,发现Phe 与锌(Zn)的拮抗作用可能是因为Phe 改变了羊头鱼的溶酶体膜稳定性及其功能,从而缓解了Zn 的毒害作用;ZHANG 等也报道了低浓度的Phe能够缓解Cd 对湿地植物的毒害作用,并推测土壤中的PAHs 可以作为一种碳源被微生物吸收,这对植物根部微生物的生长发育及其结构调整具有重要意义。低浓度的PAHs可能缓解Cd对黑麦草的氧化损伤,但同时也改变了其酶活性,这与前人的研究相符。高浓度PAHs 与Cd 的共存可能刺激了黑麦草体内的保护机制,PAHs 与Cd 可以使ROS 在植物体内积累增加,逆境胁迫下植物的抗氧化机制是植物自我保护的一种适应性反应,一定程度上可以减轻胁迫作用,但这种调节能力是有限的,一旦高浓度的染毒物胁迫强度远超过了黑麦草自身的防御能力,植物的抗氧化系统会遭到破坏,使植物清除ROS 的能力减弱,从而在细胞水平上造成损伤,植物体内的酶活性和氧化应激产物均受到抑制。有研究发现,高浓度Zn 与PAHs 在菠菜(L.)体内呈现拮抗作用,同时有研究表明高浓度的Pyr 与铜(Cu)复合污染对玉米幼苗的胁迫表现为拮抗作用,这种拮抗作用也可能是黑麦草的氧化指标与单一污染相比发生显著变化的原因,使黑麦草4 种指标在高浓度复合染毒下普遍呈现拮抗效应。
此外,有研究发现在硒(Se)和汞(Hg)污染体系中也存在着拮抗作用,Se 可以降低大蒜()体内Hg 与GSH 的结合,从而降低Hg 在植物体内的转运、积累和毒性,这说明氧化应激指标是复合污染暴露联合作用的关键靶点;同时也有研究发现在Cu 和盐的胁迫下白桦茸()的抗氧化系统发生了变化,Cu 离子可能与细胞膜蛋白结合从而改变盐离子的通道,使盐胁迫引起的GSH、过氧化氢酶(Catalase,CAT)和GR 的水平下降,表现为拮抗效应。但目前尚未有将PEPC、PPO 和Pro 作为生物效应靶点的复合污染暴露研究,推测在PAHs 和Cd 复合污染体系中可能存在类似的拮抗作用,使PAHs和Cd复合暴露条件下黑麦草的PEPC和PPO 的活性以及Pro 和GSH 浓度与理论单一暴露的加和效应相比显著下降。
4 结论
(1)单一Cd染毒和单一PAHs染毒胁迫均会引起黑麦草氧化应激反应,但两种染毒引起的氧化应激反应程度不同。
(2)在PAHs 与Cd 复合染毒下,PEPC、PPO、GSH和Pro 4种指标普遍呈现拮抗效应。
(3)PEPC 和PPO 的活性以及Pro 和GSH 浓度的显著下调可能是场地土壤高浓度PAHs 和Cd 复合污染的重要指征。