近江牡蛎C型凝集素CRD结构域PAMPs结合谱及抑菌活性
2022-09-02王翠丽
王翠丽
(1.南宁师范大学地理与海洋研究院,广西南宁 530000;2.北部湾环境演变与资源利用教育部重点实验室,广西南宁 530000)
近江牡蛎()属无脊椎()双壳纲()贝类,自身缺乏获得性免疫,单纯依靠固有免疫系统防御疫害。C型凝集素(C-type lectin,CTL)是固有的免疫重要因子,可通过糖识别域(carbohydrate recognition domain,CRD)中Ca结合位点2氨基酸残基的侧链羰基与微生物表面N-氨基半乳糖或甘露糖等结合形成复合体,激活下游信号传递,促进机体对外来入侵病原微生物清除,因此Ca结合位点2氨基酸基序可决定CTL的糖结合活性和特异性。
已有研究显示,脊椎动物CTL中Ca结合位点2第1位氨基酸基序为EPN(谷氨酸-脯氨酸-天冬酰胺)或QPD(谷氨酰胺-脯氨酸-天冬氨酸),而无脊椎动物除了以上2种,还可以是EPD(谷氨酸-脯氨酸-天冬氨酸)、QPG(谷氨酰胺-脯氨酸-甘氨酸)、QPS(谷氨酰胺-脯氨酸-丝氨酸)和YPD(酪氨酸-脯氨酸-天冬氨酸)等;其第2位关键氨基酸基序也不局限于脊椎动物的WND(色氨酸-天冬酰胺-天冬氨酸),而可以是WHD(色氨酸-组氨酸-天冬氨酸)、WSD(色氨酸-丝氨酸-天冬氨酸)、WID(色氨酸-异亮氨-天冬氨酸)和WRD(色氨酸-精氨酸-天冬氨酸)等。推测无脊椎动物Ca结合位点 2 氨基酸基序的多样性将赋予其更广泛和更多样化的糖结合活性。因此,笔者以近江牡蛎为研究对象,开展了CTL的CRD病原相关分子模式(pathogen associated molecular patterns,PAMPs)结合谱及抑菌活性研究,试验首先克隆其CTL基因,明确CRD结构域及Ca结合位点2氨基酸基序;其次通过体外重组CTL的CRD结构域蛋白,揭示其PAMPs结合谱及抑菌活性;研究结果将为深入了解CTL在无脊椎动物近江牡蛎固有免疫防御机制中的重要作用提供参考数据。
1 材料与方法
实验动物。近江牡蛎成贝(约2年龄)采自广西钦州湾茅尾海的2个养殖区(108°35′08″E,21°43′00″N和108°51′ 58″E,21°39′ 21″N),养殖海水条件:温度分别为31.5 ℃和31.7 ℃,盐度分别为17.7‰和17.9‰,pH分别为7.72和7.81,电导率分别为28.86和29.17 μs/cm。样品采集完毕立即送回实验室处理。
主要试剂。Trizol试剂,购自MRC公司;氯仿、异丙醇、乙醇,购自中国医药集团有限公司;DEPC水,购自北京索莱宝科技有限公司;QIA quick Gel Extraction 试剂盒,购自QIAGEN公司;rE、10×PCR Buffer、2.5 mmol/L dNTP、DNA Marker 2000、PMD19-T Vectors,购自TaKaRa公司;DH5α感受态细胞、X-gal、IPTG、氨苄青霉素,购自北京全式金公司;TIAN Script RT cDNA第一链合成试剂盒,购自康为试剂公司;SYBR®Select Master Mix试剂盒,购自ABI公司;Anti-6x His tag antibody一抗、Goat Anti-Rabbit lgG(HRP)二抗,购自Abcam公司;毕赤酵母、耶罗维亚酵母、金黄色葡萄球菌、鳗弧菌、大肠杆菌及所用扩增引物,购自Invitrogen公司。
主要仪器。涡旋振荡仪(型号为QL-902),购自海门市其林贝尔仪器制造有限公司;酶标仪(型号为Bio-Rad iMark)、电泳仪(型号为Powerpac HV 164-5056)、梯度热循环仪(型号为T100TM),购自Bio-Rad公司;高速离心机(型号为5415D)、离心机(型号为mini spin plus)、紫外分光光度计(型号为Bio Photometer),购自Eppendorf公司;超微量紫外分光光度计(型号为NanoDrop-1 000),购自NanoDrop公司;全自动凝胶成像系统(型号为Syngene Genius),购自Syngene公司;低温恒温槽(型号为DC-1006),购自无锡沃信仪器有限公司;荧光定量PCR仪(型号为7500 FAST),购自IBM公司;生物安全柜(型号为HF Safe 760S),购自Heal Force公司;电热恒温鼓风干燥箱(型号为DHG-9070A),购自上海精宏设备有限公司。
基因克隆。依据GenBank数据库中已登录的长牡蛎基因组(登录号:CGI_10009560)中查询获得其CTL基因序列,利用在线生物信息学软件设计近江牡蛎CTL基因RT-PCR引物(表1)。Trizol提取近江牡蛎组织样本中总RNA,超微量紫外分光光度计测定总RNA质量和浓度,琼脂糖凝胶电泳检测总RNA完整性;TIAN Script RT cDNA第一链合成试剂盒进行反转录,操作按产品说明书进行;PCR扩增,琼脂糖凝胶电泳检测扩增产物。
表达谱分析。运用Trizol法分别提取近江牡蛎成贝肝胰腺、外套膜、血细胞、鳃、肌肉柱、卵巢和唇瓣组织样品总RNA,分别取1.0 μg总RNA分别进行反转录制备cDNA模板,各组织样品设置6个平行样品。根据笔者克隆所得近江牡蛎CTL的CDS区序列(登录号:MZ411536)和GenBank数据库已登录β-actin(登录号:AF026063)序列,设计Q-PCR引物(表1),采用7500 FAST荧光定量PCR检测系统(Applied Bio systems)进行分析,2法计算近江牡蛎CTL mRNA相对表达结果。
体外重组CTL的CRD结构域蛋白。将CTL/pMD19-T和pET30a载体用NdeⅠ和HindⅢ双酶切,将近江牡蛎CTL的CRD结构域目的片段与pET30a载体连接并转化至感受态细胞BL21中,重组质粒鉴定阳性表达克隆子(CTL/pET30a);鉴定完毕将质粒二次转化至感受态细胞BL21中,分时间段IPTG诱导表达,收集菌体,诱导表达产物SDS-PAGE检测,考马斯亮蓝染色确定最佳诱导时间;在最佳诱导时间大量诱导表达,分离包涵体,过镍柱,尿素透析蛋白复性;BSA标准品加入考马斯亮蓝染色液,测定不同浓度BSA标准品的595 nm的光吸收值,绘制标准曲线;测定CTL的CRD结构域重组蛋白在595 nm的光吸收值,依据所建标准曲线计算蛋白浓度。

表1 近江牡蛎CTL引物Table 1 Primers for CTL in C.rivularis
CRD结构域重组蛋白PAMPs结合谱。CRD结构域重组蛋白PAMPs识别谱检测方法参照文献[11]的方法:将PGN、LPS和glucan溶解于pH 9.8 NaCO中,酶标仪每孔含10 μg溶质,4 ℃包被过夜,PBST洗板3次;酶标仪每孔加入3% BSA 100 μL,37 ℃封闭30 min,PBST洗板1次;酶标仪每孔加入不同稀释浓度的CRD重组蛋白,18 ℃孵育3 h,PBST洗板1次;酶标仪每孔加入Anti-6x His tag antibody一抗(稀释比例1∶1 000),37 ℃孵育1 h,PBST洗板1次;酶标仪每孔加入Goat Anti-Rabbit lgG(HRP)二抗(稀释比例1∶2 000),37 ℃孵育1 h;酶标仪每孔加入100 μL HRP底物TMB溶液,避光37 ℃反应10 min,加入2 mol/L硫酸50 μL终止反应;读取酶标仪OD值。依据ELISA试剂盒说明书规定:样品OD吸光度值/阴性对照OD吸光度值≥2.1判定为阳性,该试验中阴性对照OD吸光度值平均为0.04,则0.04×2.1=0.084,该值即为阴性和阳性分界点值,样品值≥0.084,即判为阳性。
CRD结构域重组蛋白菌结合活性。CRD结构域重组蛋白菌结合活性检测方法参照Lee等的方法:革兰氏阳性菌金黄色葡萄球菌,革兰氏阴性菌大肠杆菌和鳗弧菌,毕赤酵母和耶罗维亚酵母,分别挑菌接种到LB液体培养基中,毕赤酵母和耶罗维亚酵母28 ℃ 200 r/min过夜培养,金黄色葡萄球菌、鳗弧菌和大肠杆菌37 ℃ 200 r/min 过夜培养;离心收集菌体,PBS缓冲液调整浓度为1×10CFU/mL;吸取1 mL各菌液悬浊液分别与100 μg CRD结构域重组蛋白混合,室温旋转孵育;离心收集菌体,PBS缓冲液洗涤菌体,无菌水重悬;各菌体加入蛋白电泳缓冲液,95 ℃水浴10 min,进行SDS-PAGE电泳;电泳后凝胶转NC膜,PBST缓冲液漂洗1次;NC膜5%脱脂奶粉室温封闭2 h,PBST漂洗1次;NC膜Anti-6x His tag antibody一抗(稀释比例1∶1 000)室温孵育1 h,PBST漂洗1次;NC膜Goat Anti-Rabbit lgG(HRP)二抗(稀释比例1∶2 000)室温孵育1 h,TBST漂洗1次;ECL显影,拍照记录结果。
CRD结构域重组蛋白抑菌活性。CRD重组蛋白抑菌活性检测方法参照Zhou等的方法:10 mmol/L磷酸钠缓冲液稀释革兰氏阳性菌金黄色葡萄球菌、革兰氏阴性菌大肠杆菌和鳗弧菌、毕赤酵母和耶罗维亚酵母,使得光密度达0.001 8。按照1∶1比例将细菌稀释液与CRD结构域重组蛋白混合在96孔培养板中培养。培养12 h后,以无菌超纯水代替CRD结构域重组蛋白作为空白对照,与等量培养液混合培养基设为阴性对照,测试最小抑菌浓度(MIC)和最小杀菌浓度(MBC)。
2 结果与分析
克隆获得1种CTL基因(图1),测序分析显示:CTL基因CDS区共1 350 bp(包括终止密码),编码449个氨基酸。Signa IP软件预测其多肽链N-端含有1段24个氨基酸的信号肽;SMART网站预测其多肽链包含1个胞外段110个氨基酸CRD结构域;CRD结构域含Ca结合位点2氨基酸基序QPS/WHD及3个保守的半胱氨酸残基(图2)。
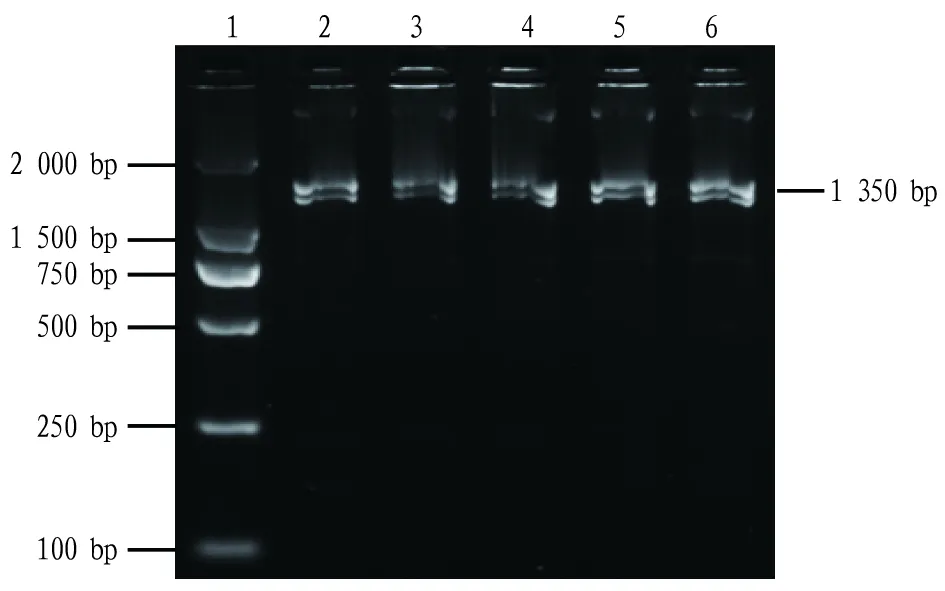
注:泳道1.DNA Mark;泳道2~6.目标DNA Note:Lane 1.DNA Mark;Lane 2-6.Target DNA图1 近江牡蛎CTL基因琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis of CTL in C.rivularis

注:信号肽由斜体标识;CRD结构域用下滑线标识;Ca2+结合位点2氨基酸基序用矩形框标识;CRD结构域内保守Cys用斜体红色字母“C”标识 Note:The signal peptide was identified by italics;CRD domain was identified by slide lines;amino acid sequences of Ca2+ binding site 2 were identified by rectangular box;conservative Cys of CRD domain was identified by italic red letter “C”图2 近江牡蛎CTL基因部分序列Fig.2 Partial sequences of CTL in C.rivularis
荧光定量PCR检测,2法计算近江牡蛎CTL mRNA相对表达谱,结果显示:CTL mRNA在肝胰腺、外套膜、鳃、唇瓣、血细胞、卵巢、肌肉柱组织中均有表达,并呈组织差异分布。肝胰腺、外套膜和血细胞中表达量多,其次为鳃、肌肉柱和卵巢,唇瓣表达量最少(图3)。

注:不同小写字母表示组间差异显著(P<0.05) Note:Different lowercase letters indicate significant difference between groups(P<0.05)图3 近江牡蛎CTL基因组织表达谱Fig.3 CTL relative mRNA levels in tissue of Crassostrea rivularis
近江牡蛎CTL胞外段的CRD结构域重组蛋白被诱导表达,分子量约为27.45 kD,利用Ni-NTA对重组蛋白进行纯化,结果表明:蛋白纯度较高,尿素浓度梯度对变性蛋白进行复性(图4、5),保存于-80 ℃备用。
近江牡蛎CTL胞外段的CRD结构域重组蛋白PAMPs识别谱结果如图6所示。当CRD结构域重组蛋白浓度为55 μg/mL时,具有LPS、PGN和glucan 3种PAMPs结合活性,其中对LPS的结合能力最强,差异显著(<0.05)。
近江牡蛎CTL胞外段的CRD结构域重组蛋白能够结合2种真菌:毕赤酵母(图7泳道2)和耶罗维亚酵母(图7泳道3);1种革兰氏阳性菌:金黄色葡萄球菌(图7泳道4);2种革兰氏阴性菌:鳗弧菌(图7泳道5)和大肠杆菌(图7泳道6)。
近江牡蛎CTL胞外段的CRD结构域重组蛋白抑菌活性结果见表2。分析表2可知,C型凝集素CRD结构域重组蛋白能抑制和杀死革兰氏阳性菌中的金黄色葡萄球菌、革兰氏阴性菌中的大肠杆菌和鳗弧菌;能抑制但不能杀死毕赤酵母和耶罗维亚酵母。
3 讨论
笔者在无脊椎贝类近江牡蛎中克隆获得一种CTL分子,

图4 近江牡蛎CTL胞外段的CRD结构域重组蛋白氨基酸序列 Fig.4 Amino acid sequences of CRD domain recombinant protein of CTL in C.rivularis

注:A.SDS-PAGE;B.Western blot;M1.蛋白Marker(Cat.No.M00516);M2.蛋白Marker(Cat.No.M00521);泳道1.BSA(2 μg);泳道2、3.目标蛋白 Note:A.SDS-PAGE;B.Western blot;M1.Protein Marker(Cat.No.M00516);M2.Protein Marker(Cat.No.M00521);Lane 1.BSA(2μg);Lane 2,3.Target protein图5 近江牡蛎CTL胞外段的CRD结构域重组蛋白Fig.5 CRD domain recombinant protein of CTL in C.rivularis

注:*表示组间差异显著(P<0.05) Note:* indicates significant difference between groups(P<0.05)图6 近江牡蛎CTL胞外段的CRD结构域重组蛋白PAMPs识别谱 Fig.6 PAMPs binding spectrum of CRD domain recombinant protein of CTL in C.rivularis
其CRD结构域Ca结合位点2第一氨基酸基序为QPS,这有别于脊椎动物,但在其他贝类中出现过类似现象。如脊椎动物第一氨基酸基序EPN的第三位氨基酸天冬酰胺被天冬氨酸所取代时,则成为EPD基序,这在栉孔扇贝()和热带蛤()中研究发现;脊椎动物另一个第一氨基酸基序QPD的第三位氨基酸天冬氨酸被丝氨酸所取代时,则成为QPS基序,这在紫贻贝()中发现过。上述氨基酸的直接取代将导致Ca结合位点2质子供体和质子受体之间发生变化,可能会影响糖结合活性和抑菌特异性。近江牡蛎CRD结构域Ca结合位点2第二氨基酸基序是WHD,同样有别于脊椎动物保守的WND,这一变化同样在其他贝类中有过报道。对于脊椎动物第二氨基酸基序WND的研究已证实其作用是当CRD与配体结合时起辅助作用,对于无脊椎贝类中多种多样的第二氨基酸基序更多人则认为其可能参与决定糖结合活性和特异性。

注:1.阳性对照;2.毕赤酵母;3.耶罗维亚酵母;4.金黄色葡萄球菌;5.鳗弧菌;6.大肠杆菌 Note:1.Positive control;2.Pichia pastoris;3.Yarrowia lipolytica;4.Staphylococcus aureus;5.Vibrio anguillarum;6.Bacillus coli图7 近江牡蛎CTL胞外段的CRD结构域重组蛋白菌结合谱Fig.7 Bacterial binding spectrum of CRD domain recombinant protein of CTL in C.rivularis
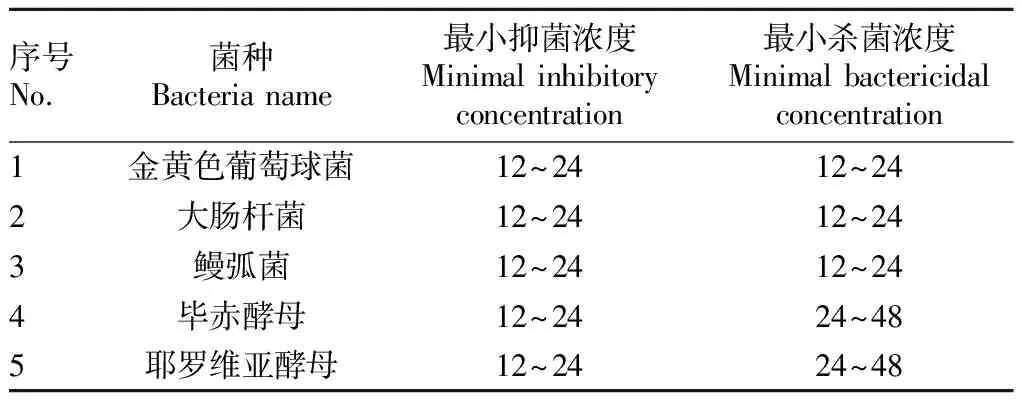
表2 近江牡蛎CTL胞外段的CRD结构域重组蛋白抑菌活性Table 2 Antibacterial activities of CRD domain recombinant protein of CTL in C.rivularis μmol/L
利用近江牡蛎CTL的CRD结构域体外重组蛋白检测其PAMPs结合谱,结果显示:其体外重组蛋白浓度为55 μg/mL时,具有LPS、PGN和glucan 3种PAMPs结合活性。脊椎动物大鼠()的相关研究发现,第一氨基酸基序为EPN或QPD时,均表现为D-mannose和D-galactose结合活性。而在无脊椎贝类中,不同的氨基酸基序组合可表现出多种多样的糖结合活性。如长牡蛎()QPS/WHD氨基酸基序组合时,表现出了LPS、PGN、mannan和glucan 4种PAMPs结合活性,这与笔者所得结果相近;在栉孔扇贝的研究中发现EPN/LND和EPN/YND 2类Ca结合位点2氨基酸基序组合时,则同时表现出了LPS、mannan、PGN和glucan 4种PAMPs结合活性;而当第一氨基酸基序均为EPN,第二氨基酸基序分别为FAD和LND时,则一个表现为LPS和mannan 2种PAMPs结合活性,另一个表现为LPS、mannan、PGN和glucan 4种PAMPs结合活性。若按照脊椎动物中已证实的第一氨基酸基序决定糖结合活性和特异性,而第二氨基酸基序为辅助作用的原理定义无脊椎贝类显然是不合适的,推测无脊椎贝类决定糖结合活性和特异性不仅取决于第一氨基酸基序,还取决于第二氨基酸基序。
笔者利用近江牡蛎CTL的CRD结构域体外重组蛋白检测菌结合谱及抑菌活性,结果显示,其能结合、抑制和杀死革兰氏阳性菌中的金黄色葡萄球菌、革兰氏阴性菌中的大肠杆菌和鳗弧菌,能结合、抑制但不能杀死毕赤酵母和耶罗维亚酵母。这与前人在海湾扇贝中所得结果较一致,当CTL的CRD结构域体外重组蛋白表现出PGN、LPS和glucan 3种PAMPs结合活性时,其可结合革兰氏阳性菌、革兰氏阴性菌和酵母,具有多种抑菌和杀菌活性。
笔者利用荧光定量PCR技术检测近江牡蛎CTL mRNA相对表达谱,结果显示,其在肝胰腺、外套膜和血细胞中的相对表达量显著高于其他组织中的表达量(<0.05)。在无脊椎贝类中,肝胰腺是合成固有免疫相关蛋白的重要器官,血细胞是机体清除入侵病原微生物的直接参与者,而外套膜和鳃是外界环境直接接触最多的器官,这些器官较多分布免疫相关基因CTL,可帮助机体快速识别、结合和清除入侵外源微生物,符合贝类的生理和生活环境特点。
综上,该研究证实CTL在无脊椎贝类近江牡蛎固有免疫防御机制中可发挥识别、结合、抑制和杀死多种有害菌的重要作用。
