血浆sRAGE、Nampt水平与呼吸机相关性肺炎患者病情程度和预后的关系
2022-09-01张新月陈明茜白巧红查王健吉宁飞
张新月,陈明茜,白巧红,查王健,吉宁飞
1 南京市第二医院呼吸与危重症医学科,南京 210000;2 江苏省人民医院呼吸与危重症医学科
呼吸机相关性肺炎(VAP)是我国医院获得性肺炎的常见类型,易造成脱机困难,从而延长住院时间,严重者甚至威胁生命[1-2]。目前普遍认为,炎症反应是VAP发生的重要机制之一[2]。晚期糖基化终末产物受体(RAGE)为多配体膜受体,能够通过与其配体结合启动多条信号通路,参与细胞内炎症反应和氧化应激反应。可溶性RAGE(sRAGE)是其异构体,可竞争性结合RAGE 配体,从而阻断RAGE 的生物学作用[3]。烟酰胺磷酸核糖转移酶(Nampt)是一种脂肪因子,可参与细胞能量代谢、自噬、凋亡等生命活动,与免疫炎症反应密切相关[4]。但目前血浆sRAGE、Nampt 水平与VAP 患者病情程度和预后的关系尚不清楚。为此,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2020 年1 月—2021 年5 月在南京市第二医院行机械通气后发生VAP患者143例(观察组)。纳入标准:①符合《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018 年版)》[2]中的诊断标准;②机械通气时间≥48 h;③年龄≥18 岁;④临床资料完整。排除标准:①机械通气前已存在肺部或其他部位感染者;②机械通气48 h内死亡者;③长期使用激素或免疫抑制剂者;④合并血液或免疫系统疾病者;⑤合并支气管扩张、急性呼吸窘迫综合征、肺水肿等其他肺部疾病者;⑥合并严重肝肾功能损害者;⑦妊娠期或哺乳期妇女。其中,男87例、女56例,年龄31~78(58.54±9.32)岁。同期选择在南京市第二医院体检健康的志愿者50例(对照组),男30 例、女20 例,年龄27~76(57.16 ±9.47)岁。两组性别、年龄具有可比性。本研究经南京市第二医院医学伦理委员会批准(审批文号:NJEY202108090423),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 血浆sRAGE、Nampt检测 VAP 患者入重症监护室时,健康志愿者体检当日,采集肘静脉血3 mL,3 000 r/min 离心10 min、离心半径10 cm,分离血浆,-80 ℃冰箱保存。采用ELISA 法检测血浆sRAGE、Nampt。
1.3 VAP 病情程度和预后评估 确诊VAP 后,采用急性生理学与慢性健康状况评估Ⅱ(APACHEⅡ)评分[5]评估VAP病情程度。APACHEⅡ评分总分0~71 分,评分越高,病情程度越重。根据APACHEⅡ评分将VAP 患者分为重度(APACHEⅡ评分>20 分)38 例、中度(APACHEⅡ评分10~20 分)49 例、轻度(APACHEⅡ评分<10 分)56 例。对VAP 患者随访28 d,期间死亡41例、存活102例。
1.4 资料收集分析 收集VAP 患者临床资料,包括性别、年龄、BMI、基础疾病(糖尿病、高血压、冠心病、脑血管病),机械通气方式、通气时间及通气体位,抗菌药物使用、病灶累及肺叶,入重症监护室时体温、心率、平均动脉压以及APACHEⅡ评分和血浆sRAGE、Nampt水平。比较VAP患者临床资料,将有统计学差异的指标纳入多因素Logistic回归模型,分析VAP患者预后不良的影响因素。
1.5 统计学方法 采用SPSS26.0 统计软件。正态分布的计量资料以±s 表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,两组间比较采用独立样本t 检验;偏态分布的计量资料以M(P25,P75)表示,两组间比较采用Z检验。计数资料比较采用χ2检验。相关性分析采用Spearman 相关分析法。影响因素分析采用多因素Logistic 回归模型。预测效能分析采用受试者工作特征(ROC)曲线,曲线下面积(AUC)比较采用Z 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血浆sRAGE、Nampt水平比较 观察组与对照组血浆sRAGE 水平分别为(2.25 ± 0.50)、(1.66±0.28)ng/L,血浆Nampt 水平分别为(2.94±0.32)、(2.37 ± 0.26)ng/mL。观察组血浆sRAGE、Nampt 水平均显著高于对照组(t 分别为10.045、11.488,P均<0.01)。
2.2 不同病情程度VAP 患者血浆sRAGE、Nampt水平比较 见表1。
表1 不同病情程度VAP患者血浆sRAGE、Nampt水平比较(±s)
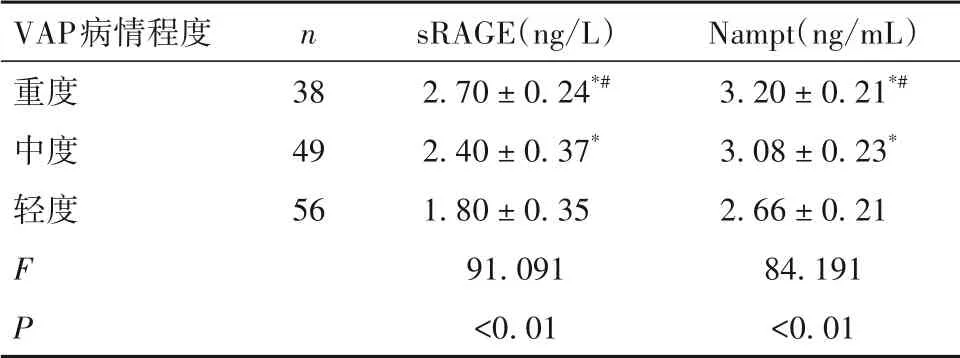
表1 不同病情程度VAP患者血浆sRAGE、Nampt水平比较(±s)
注:与轻度比较,*P<0.05;与中度比较,#P<0.05。
VAP病情程度重度中度轻度F P n 38 49 56 sRAGE(ng/L)2.70±0.24*#2.40±0.37*1.80±0.35 91.091<0.01 Nampt(ng/mL)3.20±0.21*#3.08±0.23*2.66±0.21 84.191<0.01
2.3 VAP患者血浆sRAGE、Nampt水平与APACHEⅡ评分的关系 VAP 患者APACHEⅡ评分为13.00(6.00,21.00)分。Spearman 相关分析显示,VAP 患者血浆sRAGE、Nampt 水平与APACHEⅡ评分均呈正相关关系(r分别为0.745、0.793,P均<0.01)。
2.4 VAP患者预后不良的影响因素分析结果 VAP患者死亡者与存活者临床资料比较见表2。以VAP患者预后(死亡=1,存活=0)为因变量,以年龄、机械通气时间、糖尿病史、通气方式、平均动脉压、抗菌药物、通气体位、病灶累及肺叶、APACHEⅡ评分、sRAGE、Nampt 为自变量,纳入多因素Logistic 回归模型。结果显示,年龄≥60 岁、机械通气时间≥72 h、糖尿病史、气管切开、病灶累及肺叶≥2个、APACHEⅡ评分、sRAGE、Nampt为VAP患者预后不良的独立危险因素,而平均动脉压≥65 mmHg 则为其独立保护因素(P均<0.05),见表3。
2.5 血浆sRAGE、Nampt 水平对VAP 患者预后不良的预测价值 ROC 曲线分析显示,血浆sRAGE 水平预测VAP患者预后不良的AUC 为0.802(95%CI:0.727~0.864),其cut off 值为2.40 ng/L,此时其预测VAP 患者预后不良的灵敏度、特异度分别为68.29%、73.53%;血浆Nampt 水平预测VAP 患者预后不良的AUC 为0.799(95%CI:0.724~0.861),其cut off 值为3.03 ng/mL,此时其预测VAP 患者预后不良的灵敏度、特异度分别为73.17%、71.57%;血浆sRAGE、Nampt 水平联合预测VAP 患者预后不良的AUC 为0.870(95% CI:0.804~0.921),其预测VAP患者预后不良的灵敏度、特异度分别为85.37%、79.41%。血浆sRAGE、Nampt 水平联合预测VAP 患者预后不良的AUC 显著高于血浆sRAGE、Nampt 水平单独(Z分别为2.056、2.199,P均<0.05)。
3 讨论
流行病学调查显示,我国VAP 的发生率为4.7%~55.8%,全因病死率为19.4%~51.6%[6-7]。本研究143 例VAP 患者病死率为28.67%,与国内VAP 总体病死率接近,说明VAP 患者病死率较高。因此,准确评估VAP 病情程度并及时干预其危险因素对提高患者生存率意义重大。
病原体到达支气管远端和肺泡,突破宿主防御机制,在肺部繁殖并引起侵袭性损害,是导致VAP发生的主要原因。因此,炎症反应是VAP 发生、发展的重要机制[2]。RAGE为免疫球蛋白超家族成员,广泛分布于单核巨噬细胞、淋巴细胞、内皮细胞等表面,通过与其配体结合引起细胞持续活化,并通过核因子κB 信号通路促进炎症细胞募集和扩大炎症反应[8]。sRAGE 由 内 源 性 裂 解 型RAGE 和 分 泌 型RAGE 组成,可竞争性结合RAGE 配体,因其不具备胞内区和跨膜区结构,故其与配体结合后能够阻断RAGE 信号传导[9]。有研究报道,肺炎小鼠肺组织RAGE 表达上调,阻断RAGE 信号则能抑制肺部炎症反应[10]。本研究结果显示,观察组血浆sRAGE 水平显著高于对照组,说明sRAGE可能参与VAP的发生、发展。究其原因,血浆sRAGE 水平升高为机体的代偿性反应,通过竞争性结合RAGE 配体抑制和阻断RAGE 引起的炎症反应。近年有研究报道,在急性呼吸窘迫综合征、重症肺炎等肺部损伤或感染患者外周血sRAGE 水平升高,并且其水平可用于评估患者病情程度[11-12]。本研究结果显示,随着病情程度加重,VAP 患者血浆sRAGE 水平逐渐升高,且其水平与APACHEⅡ评分呈正相关关系。提示血浆sRAGE 水平与VAP 病情程度密切相关。本研究结果还发现,高血浆sRAGE水平VAP患者预后不良的概率增加1.561 倍,提示sRAGE 可作为预测VAP 患者预后不良的生物标志物;ROC 曲线分析显示,血浆sRAGE 水平预测VAP 患者预后不良的AUC 为0.802。结果表明,血浆sRAGE 水平可用于VAP 患者病情程度和预后评估。Nampt为NAD合成的限速酶,生理状态下水平较低,而在炎症状态下迅速升高。虽然Nampt不具备促炎症细胞拥有的出胞信号肽序列,但其释放到细胞外后能够激活促分裂原活化蛋白激酶、磷脂酰肌醇3 激酶、核因子κB、STAT3等信号通路,从而激活炎症反应[13]。本研究结果显示,观察组血浆Nampt 水平显著高于对照组,提示Nampt 可能参与VAP 的发生、发展,这与Nampt 能够通过多种信号途径参与炎症反应有关。在脂多糖诱导的急性炎症性肺损伤模型中,肺组织Nampt mRNA 表达上调,敲除Nampt 后肺部炎症损伤显著改善[14]。本研究结果显示,随着病情程度加重,VAP患者血浆Nampt 水平逐渐升高,且其水平与APACHEⅡ评分呈正相关关系。提示血浆Nampt 水平与VAP 病情程度密切相关。本研究结果还发现,高血浆Nampt 水平VAP 患者预后不良的概率增加1.345 倍;ROC 曲线分析显示,血浆Nampt 水平预测VAP 患者预后不良的AUC 为0.799。结果表明血浆Nampt 水平可用于VAP 患者病情程度和预后评估。本研究结果发现,血浆sRAGE、Nampt水平联合预测VAP 患者预后不良的AUC 显著高于血浆sRAGE、Nampt 水平单独。提示血浆sRAGE、Nampt 水平联合能够更准确地评估VAP患者病情程度和预后。
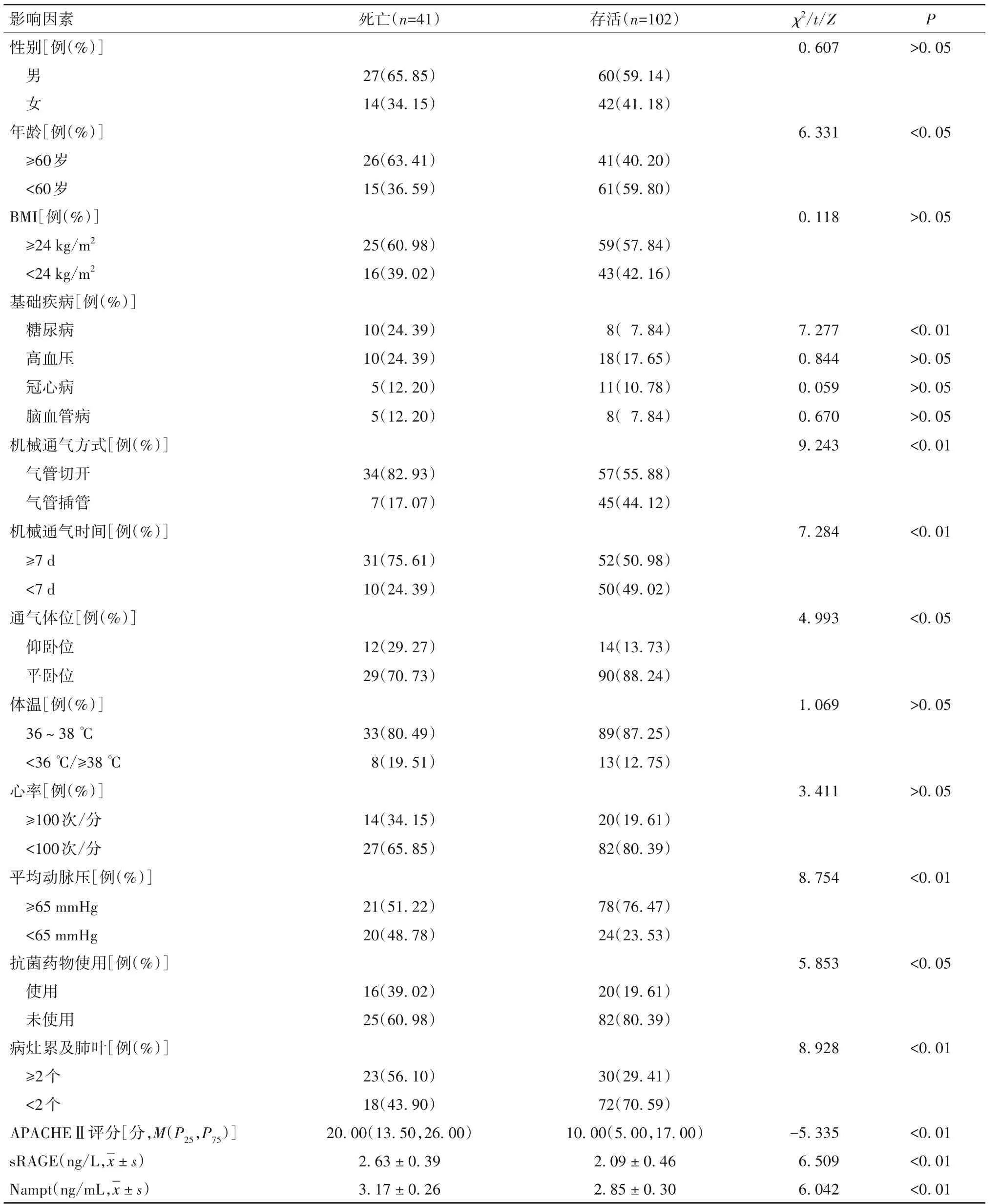
表2 VAP患者死亡者与存活者临床资料比较
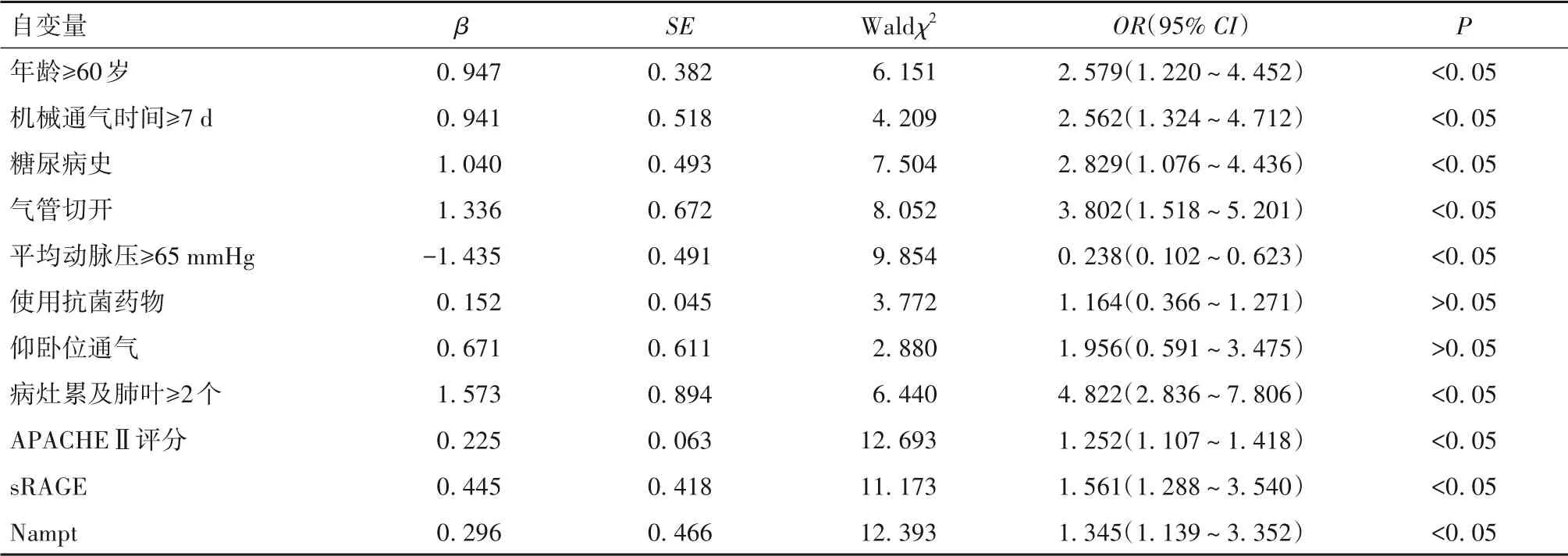
表3 VAP患者预后不良影响因素的多因素Logistics回归分析结果
本研究结果还发现,年龄≥60岁、机械通气时间≥72 h、糖尿病史、气管切开、平均动脉压<65 mmHg、病灶累及肺叶≥2 个、APACHEⅡ评分为VAP 患者预后不良的独立危险因素。究其原因:重症监护室的老年患者病情往往更加危重,且基础疾病较多,发生VAP 后机体状况更差;VAP 主要是由致病菌侵入肺部引起,随着机械通气时间延长,致病菌侵入越来越多,且随着治疗日久,耐药性不断升高,导致患者预后不良[15];代谢紊乱不仅会影响患者免疫功能,还会引起营养不良,加重感染程度,从而影响患者预后[16];严重感染可导致循环功能减退,引起持续性低血压,导致组织器官灌注不足,还可引起脓毒症休克,进而影响患者预后;病灶累及肺叶越多,患者病情越重,预后越差[17]。
综上所述,VAP患者血浆sRAGE、Nampt水平显著升高,其水平变化与病情程度和预后密切相关;血浆sRAGE、Nampt水平升高是VAP患者预后不良的独立危险因素,并可作为预测VAP患者预后不良的生物标志物。
