甲状腺乳头状癌组织miR-144-5p、FN1表达变化及其与临床病理特征和预后的关系
2022-09-01李卫王猛刘杰
李卫,王猛,刘杰
河北省沧州中西医结合医院头颈甲状腺外科,河北沧州 061000
甲状腺癌是内分泌系统最常见的恶性肿瘤,也是全球发病率增长最快的恶性肿瘤。据统计,2020年全球新发甲状腺癌58.6万例[1]。而甲状腺乳头状癌(PTC)最为常见,恶性程度最低,约占甲状腺癌总数的85%。目前,大多数PTC 患者在手术切除后接受131碘治疗可达到临床治愈,但仍有23%患者治疗后会出现复发或转移[2-3]。因此,寻找预测PTC 预后的生物标志物具有重要意义。微小RNA(miRNA)是一类长度18~25 nt的非编码RNA,可通过调控癌基因或抑癌基因表达参与肿瘤的发生、发展[4]。miR-144-5p 是一种高度保守的miRNA。有研究报道,miR-144-5p能够调控胃癌、脑胶质瘤等实体肿瘤细胞的增殖、侵袭、迁移[5-6]。纤连蛋白1(FN1)是在各种组织或体液中广泛存在的一种高分子糖蛋白,可参与细胞增殖、黏附、迁移以及组织修复等生物学过程。近年研究报道,FN1与肝细胞癌、胃癌等恶性肿瘤细胞的增殖、侵袭、迁移以及化疗耐药等密切相关[7-8]。但目前PTC 组织miR-144-5p、FN1 表达变化及其与临床病理特征和预后关系的报道较少。为此,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2017 年1 月—2018 年5 月在河北省沧州中西医结合医院接受甲状腺全切除术或次全切除术的PTC 患者78 例。纳入标准:①符合《甲状腺微小乳头状癌诊断与治疗中国专家共识(2016 版)》[2]中的诊断标准;②初诊;③接受甲状腺全切除术或次全切除术,术前未接受任何抗肿瘤治疗;④年龄≥18 岁;⑤临床病理资料完整。排除标准:①合并其他部位肿瘤者;②合并全身感染性疾病者;③既往有甲状腺手术史者;④术前口服甲状腺激素制剂者。其中,男14 例、女64 例,年龄21~73(45.01 ± 10.32)岁;肿瘤直径:≥5 cm 41 例,<5 cm 37例;TNM 分期:Ⅰ、Ⅱ期41例,Ⅲ、Ⅳ期37例;多灶性22 例,侵及被膜4 例,有淋巴结转移14 例。本研究经河北省沧州中西医结合医院医学伦理委员会审核通过[审批编号:2020010(申)],患者或其家属知情同意并签署书面知情同意书。
1.2 miR-144-5p、FN1 表达检测 取术中切除的PTC 组织及其配对的癌旁组织(距肿瘤组织边缘≥5 cm并经病理检查证实为正常甲状腺组织),液氮中磨碎,采用TRIzol 法提取组织总RNA,经NanoDrop 2000C 超微量分光光度计鉴定,提取的总RNA 浓度和纯度合格。按TaKaRa 逆转录试剂盒说明将总RNA 逆转录为cDNA。逆转录条件:42 ℃1 h,95 ℃5 min。以cDNA 为模板,按RT-qPCR 试剂盒说明进行PCR扩增。所有引物序列由苏州金唯智生物科技有限公司设计合成。引物序列:miR-144-5p 上游引物5′-GGGGGGCATCATATACTGTAAG-3′、下游引物5′-GAGCTATTGACAAGTGACCGAC-3′,U6 上游引物5′-TCGCTTCGGCAGCACATATAC-3′、下游引物5′-GCGTGTCATCCTTGCGCAG-3′;FN1上游引物5′-GCTCCTCACTGTTGTTCTACG-3′、下游引物5′-CGGGCCGCTGAAAGTCATT-3′,GAPDH 上游引物5′-GGAGCGAGATCCCTCCAAAAT-3′、下游引物5′-GGCTGTTGTCATACTTCTCATGG-3′。PCR 反应体系共20 μL:cDNA 模板1 μL,上下游引物各1.5 μL,SYBR Green Master Mix 10 μL,ddH2O 6 μL;反应条件:95 ℃预变性30 s,95 ℃变性15 s、62 ℃退火30 s、72 ℃延伸20 s 共40 个循环。扩增反应结束,绘制熔解曲线,收集循环阈值(CT)数。以U6 或GAPDH 为 内参,采 用2-ΔΔCT法计 算目 的 基因 相对表达量。
1.3 随访 通过门诊或电话形式定期随访3 年,随访截至2021 年5 月。以患者入院日为起点,以患者死亡或至随访截至日期为终点,统计患者生存情况。
1.4 统计学方法 采用SPSS27.0 统计软件。正态分布的计量资料以±s 表示,结果比较采用t 检验;偏态分布的计量资料以M(P25,P75)表示,结果比较采用Z 检验。计数资料比较采用χ2检验或Fisher 确切概率检验。相关性分析采用Spearman 相关分析法。生存分析采用Kaplan-Meier 法,生存率比较采用Log-Rank检验。危险因素分析采用多因素Cox回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 PTC 组织与癌旁正常组织miR-144-5p、FN1 表达比较 PTC组织与癌旁正常组织miR-144-5p相对表达量分别为0.66(0.45,0.88)、1.69(1.29,1.89),FN1相对表达量分别为15.29±4.42、10.51±2.61。PTC组织miR-144-5p相对表达量低于癌旁正常组织(Z=-9.220,P<0.01),FN1 相对表达量高于癌旁正常组织(t=8.216,P<0.01)。
2.2 PTC 组织miR-144-5p 表达与FN1 表达的关系 Spearman相关分析显示,PTC组织miR-144-5p表达与FN1表达呈负相关关系(r=-0.772,P<0.01)。
2.3 PTC 组织miR-144-5p、FN1 表达与临床病理特征的关系 见表1。
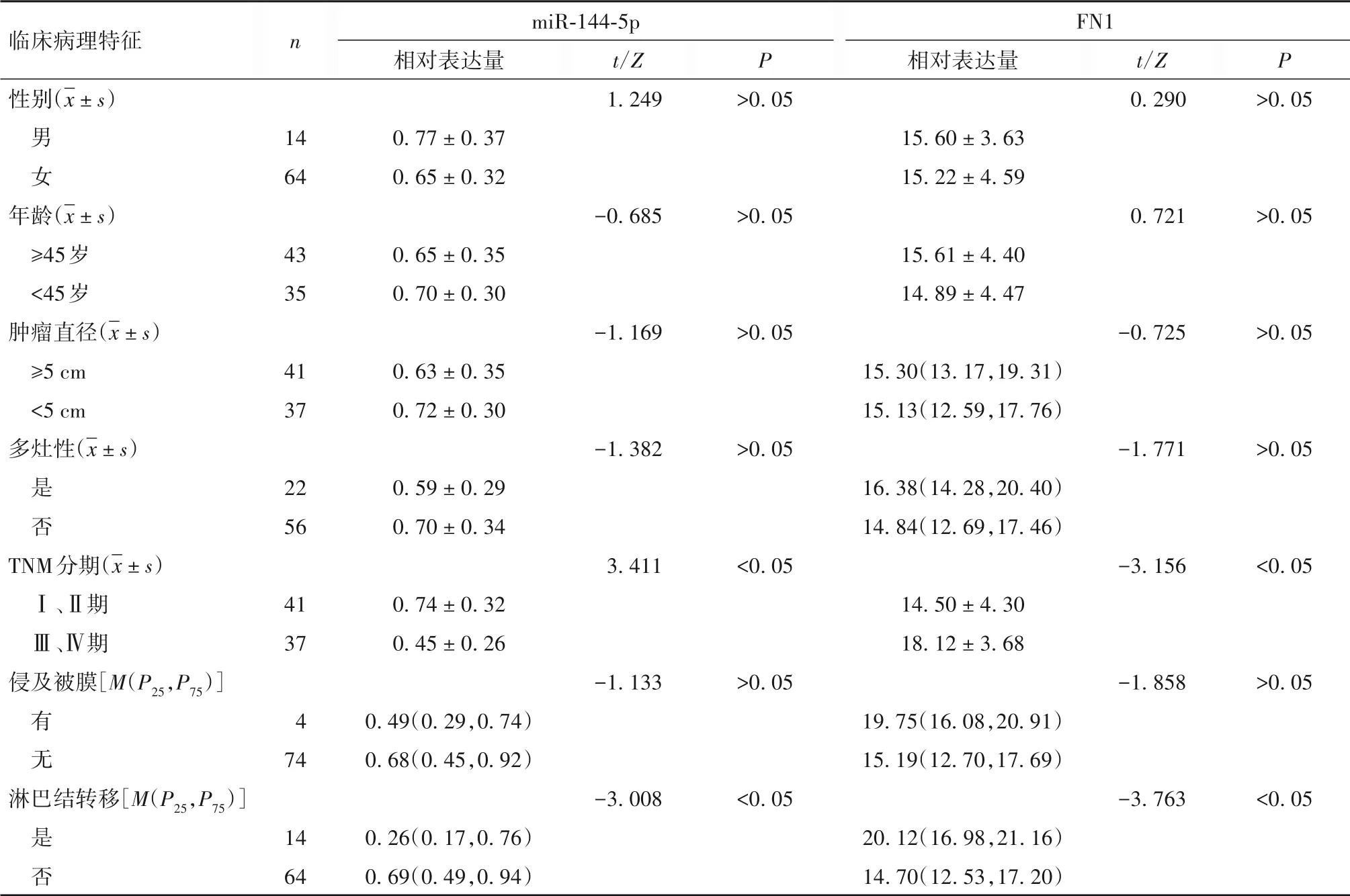
表1 PTC组织miR-144-5p、FN1表达与临床病理特征的关系
2.4 PTC 组织miR-144-5p、FN1 表达与患者预后的关系 随访4~36个月,中位随访27个月,随访期间死亡14 例,术后3 年总生存率为82.05%(64/78)。以miR-144-5p、FN1 相对表达量的均值为界,将PTC患者分为miR-144-5p 高表达者(miR-144-5p 相对表达量≥0.67,39 例)与低表达者(miR-144-5p 相对表达量<0.67,39例)、FN1高表达者(FN1相对表达量≥15.29,40 例)与低表达者(FN1 相对表达量<15.29,38 例)。miR-144-5p 高表达者与低表达者术后3 年总生存率分别为92.31%(36/39)、71.79%(28/39),FN1 高表达者与低表达者术后3 年总生存率分别为72.50%(29/40)、92.11%(35/38)。miR-144-5p 高表达者术后3 年总生存率高于其低表达者,FN1 低表达者术后3 年总生存率高于其高表达者(χ2分别为4.783、4.204,P均<0.05)。
2.5 PTC 患者预后不良的影响因素分析 单因素分析显示,多灶性、TNM 分期、侵及被膜、淋巴结转移、miR-144-5p 表达、FN1 表达可能与PTC 患者预后不良有关(P 均<0.05),见表2。以随访时间为时间变量,以多灶性(是=1,否=0)、TNM 分期(Ⅲ、Ⅳ期=1,Ⅰ、Ⅱ期=0)、侵及被膜(是=1,否=0)、淋巴结转移(有=1,无=0)、miR-144-5p 表达(≥0.67=1,<0.67=0)、FN1 表达(≥15.29=1,<15.29=0)为自变量,以预后为因变量(死亡=1,存活=0),纳入多因素Cox回归模型。结果显示,TNM 分期Ⅲ、Ⅳ期及有淋巴结转移、FN1 表达≥15.29 为PTC 患者预后不良的独立危险因素,而miR-144-5p 表达≥0.67 则为其独立保护因素(P均<0.05),见表3。

表2 PTC患者预后不良影响因素的单因素分析结果[例(%)]
3 讨论
据全国肿瘤登记中心数据,我国甲状腺癌以每年20%的速度持续增长,是全球甲状腺癌发病例数最多的国家[1]。PTC 是甲状腺癌最常见的病理类型,因在一定程度上保留了甲状腺滤泡上皮细胞功能,又被称为分化型甲状腺癌。大部分分化型甲状腺癌进展缓慢,但部分PTC 在治疗过程或自然病程中,肿瘤细胞形态和功能会出现退行性改变,丧失了碘浓聚能力,发展为碘难治性分化型甲状腺癌,平均生存期仅3~5 年,10 年生存率不足10%[3,9]。目前,对于这类PTC的临床评估、多学科治疗、随访策略等尚存在争议,各类靶向药物相对缺乏。因此,亟需进一步探索PTC 发病的分子机制,寻找理想的治疗靶点,进而指导临床制定最佳的治疗方案。
肿瘤的形成是一个多因素作用、多基因参与、多阶段演变的生物学过程。有研究报道,表观遗传在恶性肿瘤异质性形成和维持中发挥重要作用[10]。miRNA 在表观遗传学修饰中扮演重要角色,能够通过与靶基因mRNA 的3′非翻译区结合调控靶基因的表达,从而发挥癌基因或抑癌基因的作用[4]。miR-144-5p 是一种高度保守的miRNA,定位于人染色体17q11.2,其靶基因富集于环磷酸腺苷、cGMP依赖性蛋白激酶Ⅰ等肿瘤相关信号通路。近年研究证实,miR-144-5p 能够参与多种恶性肿瘤进展。CHEN 等[11]研究报道,miR-144-5p 在卵巢癌细胞中低表达,并且miR-144-5p能够通过靶向抑制La相关蛋白1 抑制卵巢癌细胞增殖、侵袭和迁移。HUA等[12]研究发现,miR-144-5p在胃癌细胞中低表达,能够通过靶向抑制14-3-3β 抑制胃癌细胞增殖、侵袭和迁移。上述研究提示,miR-144-5p 在多种恶性肿瘤中扮演抑癌基因作用。本研究结果显示,PTC 组织miR-144-5p 表达低于癌旁正常组织,并且其表达与TNM 分期、淋巴结转移有关。结果表明,miR-144-5p 在PTC 中亦发挥抑癌基因作用。目前,miR-144-5p 参与PTC 的具体机制尚不清楚。有研究报道,miR-144-5p是由miR-144的5′端臂加工而来,而miR-144能够靶向抑制ZEB1、ZEB2表达进而抑制上皮间质转化,从而抑制甲状腺癌细胞侵袭和迁移[13]。余明军等[14]研究报道,miR-144 能够通过抑制细胞周期蛋白D1 而抑制PTC 细胞增殖和细胞周期进展。由此,我们推测miR-144-5p 亦能通过这些途径参与PTC 的发生、发展。本研究结果还发现,miR-144-5p 高表达者术后3 年总生存率明显高于其低表达者,说明miR-144-5p 高表达PTC 患者能够获得更长的生存期。多因素Cox 回归分析发现,miR-144-5p 高表达是PTC 患者预后不良的独立保护因素。表明miR-144-5p 可作为PTC 患者预后评估的生物标志物。
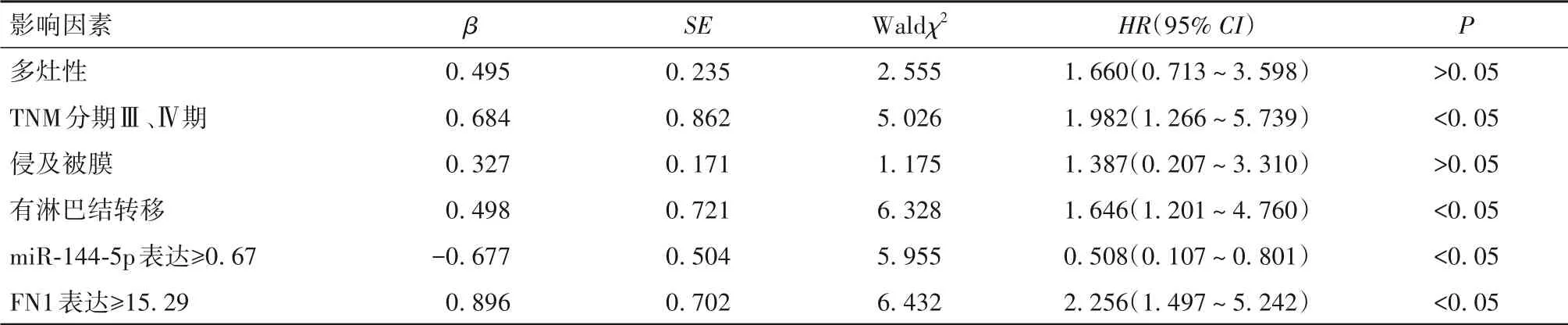
表3 PTC患者预后不良影响因素的多因素Cox回归分析结果
细胞外基质是所有组织器官的核心组成部分。在肿瘤的发生、发展过程中,细胞外基质的结构与组成、生物化学、生物力学等会发生相应改变。FN1是细胞外基质中的一种主要非胶原糖蛋白,能够调节细胞极性、黏附、分化和生长等生物学行为[15]。有研究报道,在胃癌、弥漫性大B细胞淋巴瘤等肿瘤组织中FN1 高表达,并且其表达与肿瘤细胞增殖、侵袭、迁移等密切相关[8,16]。本研究结果显示,PTC 组织FN1 表达高于癌旁正常组织,并且其表达与TNM 分期、淋巴结转移有关。结果表明,FN1在PTC 中发挥癌基因作用,其机制可能与FN1 能够促进PTC 免疫浸润和抑制p53 信号通路有关。肿瘤浸润淋巴细胞是肿瘤发生、发展的重要组成部分。PTC组织FN1高表达与B 细胞、CD4+T 细胞、CD8+T 细胞、树突状细胞、中性粒细胞、自然杀伤细胞等淋巴细胞激活密切相关,并且与PTC 免疫浸润呈正相关关系;p53 是与人类肿瘤发生相关性最高的抑癌基因,FN1共表达的基因富集于p53 信号通路,可抑制p53 信号通路激活[18]。本研究结果还发现,FN1高表达者术后3年总生存率明显低于其低表达者,并且FN1高表达是PTC患者预后不良的独立危险因素。结果提示,FN1表达与PTC 患者预后密切相关,有可能成为PTC 患者预后评估的生物标志物。本研究还发现,PTC 组织miR-144-5p 表达与FN1 表达呈负相关关系,提示二者可能共同参与PTC 的发生、发展。上皮间质转化与肿瘤的发生、发展密切相关。FN1是促进甲状腺癌细胞上皮间质转化的重要分子[19]。既往研究发现,miR-144 能够抑制甲状腺癌细胞上皮间质转化[14]。上述研究提示,miR-144、FN1均与甲状腺癌细胞上皮间质转化有关。因此,我们推测miR-144-5p 与FN1共同参与PTC 发生、发展的机制可能与上皮间质转化有关,但其靶向关系还需进一步研究。
综上所述,PTC 组织miR-144-5p 低表达、FN1 高表达,二者表达与肿瘤TNM 分期、淋巴结转移和患者预后密切相关。
