电针对AD模型幼鼠学习记忆功能和海马突触可塑性的影响*
2022-09-01张松江李龙洋高剑峰
张松江,李龙洋,高剑峰
(河南中医药大学医学院,河南郑州 450046)
阿尔茨海默病(Alzheimer disease,AD)是与年龄相关的神经退行性疾病,其早期的主要病理变化是皮层和海马部位神经元外的β-淀粉样蛋白(amyloid β-protein,Aβ)沉淀(Aβ 老年斑)和神经元内高度磷酸化的tau蛋白形成的纤维缠结[1-2]。研究显示,AD 的病理机制与Aβ 导致的神经元突触可塑性下降有密切关系[3-5]。电针(electroacupuncture,EA)刺激AD 模型动物相关穴位可以有效改善皮层和海马的突触数量、结构和功能[6-8]。目前EA治疗对突触可塑性的研究所用的动物模型基本是成年鼠,缺乏对幼年AD 模型鼠预防性电针刺治疗的突触可塑性机制探索。因此,本研究以6周龄APP/PS1转基因小鼠为AD 模型,EA 刺激“百会”“风府”和双侧“肾俞”,探索EA 刺激穴位对AD 模型幼鼠突触可塑性的影响及其机制。
材料与方法
1 实验动物和分组
SPF级6周龄雄性APP/PS1转基因小鼠24只,体质量20~22 g,自由摄食和饮水,12 h/12 h 明暗交替,环境温度为(24±1)℃,相对湿度55%~65%。将AD模型幼鼠随机分为EA 组(12 只)和AD 模型组(AD组,12 只),另以同月龄的正常C57BL/6J 小鼠作为正常对照组(CO 组,12只)。实验动物均由北京华阜康生物科技股份有限公司提供,动物使用许可证号:SYXK(豫)2015-0005。本研究经过河南中医药大学伦理委员会审查(伦理编号:DWLL2018030019)。
2 主要仪器和试剂
华佗牌电针仪(型号SDZ-Ⅲ)和华佗牌针刺针(0.25 mm×13 mm)购自苏州医疗用品厂有限公司;StepOnePlus™荧光定量PCR 仪(Applied Biosystems);电泳仪、电转仪和蛋白显影仪(Bio-Rad);冰冻切片机(Leica);快速Golgi 染色试剂盒(PK401,FD Neuro-Technologies);RNA 提取液和引物(武汉赛维尔生物科技有限公司);脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、N-甲基-D-天冬氨酸受体2B 亚 基(N-methyl-D-aspartate receptor subunit 2B,NR2B)及突触小泡蛋白(synaptophysin,SYN)单克隆抗体(Immunoway);其它基础试剂均为国产。
3 电针干预
适应性饲养1 周后,开始对EA 组小鼠进行EA干预治疗。方法同文献[6]:参考《实验针灸学》[9]对小鼠进行穴位定位,于顶骨正中(“百会”)向后斜刺2 mm,枕骨顶嵴后枕寰关节背凹陷中(“风府”)向后下方斜刺2 mm,第2 腰椎后两旁凹陷中(双侧“肾俞”)直刺2 mm。“百会”和左侧“肾俞”为一对正负极,“风府”和右侧“肾俞”为一对正负电极。断续波刺激频率为10 Hz,刺激强度为2 mA。AD组和CO组在同样的时间仅给予同样的抓取和固定。EA 刺激每天1次,每次20 min,每周休息1 d,疗程为16周。
4 检测指标及方法
4.1 Morris 水迷宫检测各组小鼠的学习和记忆功能 水迷宫为直径1.2 m 的圆形水槽,水深25 cm,保持水温22 ℃左右,水槽内壁饰以固定图案,作为标志物。小鼠每天在固定的时间游泳,保持周围环境不变。
4.1.1 定位航行实验 实验时在一个象限内放置直径为8 cm 的平台,平台隐藏于水下1.5 cm。实验训练期为4 d,每天1次,分别从平台之外的三个象限放入水中,每次间隔休息2 min。记录小鼠从不同的象限下水开始到找到水下平台所用的时间,最大时间为120 s,超过120 s 没有找到时,按120 s 计,人工引导小鼠到平台。
4.1.2 空间搜索实验 定位航行实验后,第5 天撤去平台,从一固定入水点将小鼠放入水中,记录小鼠2 min 内在原平台所在象限停留时间及穿越原平台所在位置的次数。
4.2 组织取材 水迷宫实验结束后,各组小鼠用10%水合氯醛(0.3 mg/kg)腹腔注射麻醉,无菌条件下用pH 7.4 的0.9% NaCl 溶液100 mL 对所有小鼠从左心室灌流,冲洗脑组织血液后,每组随机选6只,快速取出左侧海马置于Golgi 染色浸泡液中,进行Golgi染色。每组随机选6只小鼠的左侧海马置于4%多聚甲醛PBS 缓冲液中固定,用于透射电镜检测。在无菌环境下冰上快速取出右侧海马,置于液氮,再置于-80 ℃超低温冰箱,用于mRNA 和蛋白检测。
4.3 Golgi 染色观察海马CA1 区锥体细胞树突结构 取浸泡于Golgi 染色液中的左侧海马组织进行冰冻切片,厚度100 µm,按快速Golgi 染色试剂盒说明书进行染色、封片,并置于高倍显微镜下观察。每组小鼠从同一水平的脑区切片上选取20~30 个神经元进行统计分析。使用Image-Pro Plus 7.0 图像分析软件统计小鼠海马CA1区神经元树突棘数目。
4.4 透射电镜观察海马CA1 区超微结构 左侧海马经含4%多聚甲醛的PBS 固定2 h 后,用0.1 mol/L PBS 漂洗三次;1%四氧化锇(锇酸)后固定1 h;同样漂洗三次;丙酮逐级(50%→70%→90%→100%)脱水;Epon812 环氧树脂包埋剂与100%丙酮1∶1 比例浸泡2~4 h,包埋,切片厚度70 nm;醋酸铀和硝酸铅双重染色;每例观察3 张铜网,每张铜网随机拍摄5张照片。
4.5 实时荧光定量PCR 检测海马区SYN、NR2B 和BDNF 的mRNA 表达水平 每组随机选取6 只小鼠的右侧海马进行组内合并,液氮研磨。用Trizol试剂提取总RNA;进行浓度和纯度验证后,将RNA 反转录为cDNA 并进行PCR 扩增。反应体系(25 µL)包括:2× qPCR Mix 12.5 µL,7.5 µmol/L 引物2.0 µL,反转录产物2.5 µL,ddH2O 8.0 µL。引物序列见表1。扩增条件:95 ℃预变性10 min;95 ℃15 s→60 ℃60 s,40 次循环;熔解曲线60 ℃→95 ℃,每15 s 升温0.3 ℃。以GAPDH 为内参照,采用2-ΔΔCt法进行相对定量分析。ΔΔCt=ΔCt实验组-ΔCt对照组,ΔCt=Ct目的基因-CtGAPDH。

表1 引物序列Table 1.Sequences of the primers
4.6 Western blot 检测海马区SYN、NR2B 和BDNF的蛋白表达水平 每组随机选取6 只小鼠的右侧海马样本进行组内合并,液氮研磨后用组织裂解液进行蛋白抽提;蛋白浓度测定后进行SDS-PAGE,恒压90 V 电泳30 min,换压至120 V 90 min;转PVDF 膜,用1∶200 抗体稀释液(3%脱脂奶粉的PBST 溶液)稀释Ⅰ抗(BDNF、SYN 和NR2B 和β-actin 抗体),4 ℃孵育过夜;洗涤后用同样稀释液稀释Ⅱ抗,37 ℃摇动孵育1 h;洗涤后在显影仪中用ECL 显影液显影。采用Image-Pro Plus 6.0 软件分析,以目的蛋白与内参照β-actin灰度的比值表示目的蛋白的相对表达水平。
5 统计学分析
采用SPSS 22.0 软件进行统计学分析。所有数据均以均数±标准差(mean±SD)表示。所有数据符合正态分布,方差齐,组间比较用单因素方差分析,重复测量资料采用重复测量的方差分析,两两比较用LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 Morris水迷宫检测各组小鼠学习和记忆功能
从图1 可以看出,EA 刺激AD 模型幼鼠“百会”、“风府”和双侧“肾俞”16 周后,经过4 d 的水迷宫训练,与CO 组相比,AD 组定位航行实验潜伏期显著延长(P<0.05),穿越平台次数和平台滞留时间显著缩短(P<0.05);与AD组相比,EA组小鼠的定位航行实验潜伏期显著缩短(P<0.05),穿越平台次数和平台滞留时间显著增加(P<0.05)。
2 各组小鼠海马CA1区神经元树突棘比较
Golgi染色显示,CO组小鼠海马CA1区神经元树突棘清晰,呈树状,且数目较多;与CO 组比较,AD 组小鼠海马神经元树突棘部分丢失,数目显著减少(P<0.05);与AD 组比较,EA 组小鼠海马神经元树突棘数目增多(P<0.05),见图2。
3 各组小鼠海马CA1区透射电镜结果
与CO 组比较,AD 组小鼠海马CA1 区突触数目减少,前膜活化区和后膜致密带变细,突触末梢内递质小泡数量稀疏,境界不清;与AD 组比较,EA 组可见大量突触,突触前后成分境界清楚,轮廓完整,突触前末梢内突触小泡分布密集均匀,清晰可见,突触后膜致密带变厚、密度增高,活性区变厚、较长,见图3。
4 各组小鼠海马SYN、NR2B 和BDNF 的mRNA 表达水平
实时荧光定量PCR 结果显示,与CO 组相比,AD组小鼠海马BDNF、SYN 和NR2B 的mRNA 表达水平显著降低(P<0.01);与AD 组相比,EA 组小鼠海马BDNF、SYN 和NR2B 的mRNA 表达水 平显著升高(P<0.01),见图4。

Figure 1.Morris water maze test results of the mice in each group after electroacupuncture(EA)treatment.A:escape latency;B:number of platform crossing;C:time spent in target quadrant.Mean±SD. n=12.*P<0.05 vs control(CO)group;#P<0.05 vs AD group.图1 电针治疗后各组小鼠的水迷宫检测结果

Figure 2.Comparison of dendritic structure and number of dendritic spines in hippocampal CA1 region of the mice in each group(Golgi staining,×600).Mean±SD. n=6.*P<0.05 vs control(CO)group;#P<0.05 vs AD group.图2 各组小鼠海马CA1区树突结构及树突棘数目比较
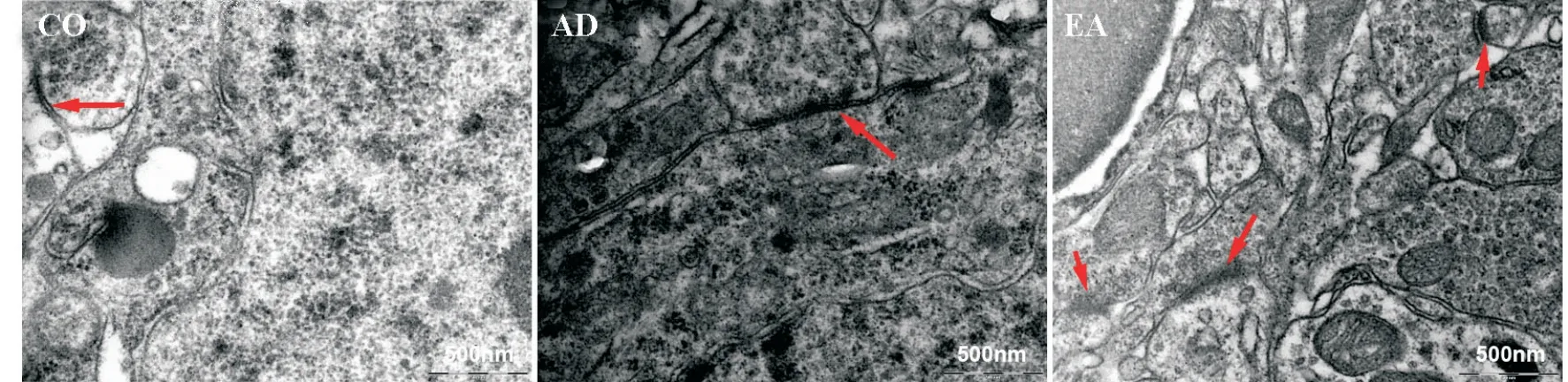
Figure 3.Transmission electron microscopy showed synapses in the hippocampus(as indicated by red arrows;scale bar=500 nm).图3 透射电镜显示海马区突触
5 各组小鼠海马BDNF、SYN和NR2B的蛋白表达
从图5 可以看出,与CO 组相比,AD 组小鼠海马BDNF、SYN 和NR2B 的蛋白表达水平显著降低(P<0.05);与AD 组相比,EA 组小鼠海马BDNF、SYN 和NR2B的蛋白表达水平显著升高(P<0.05)。
讨 论
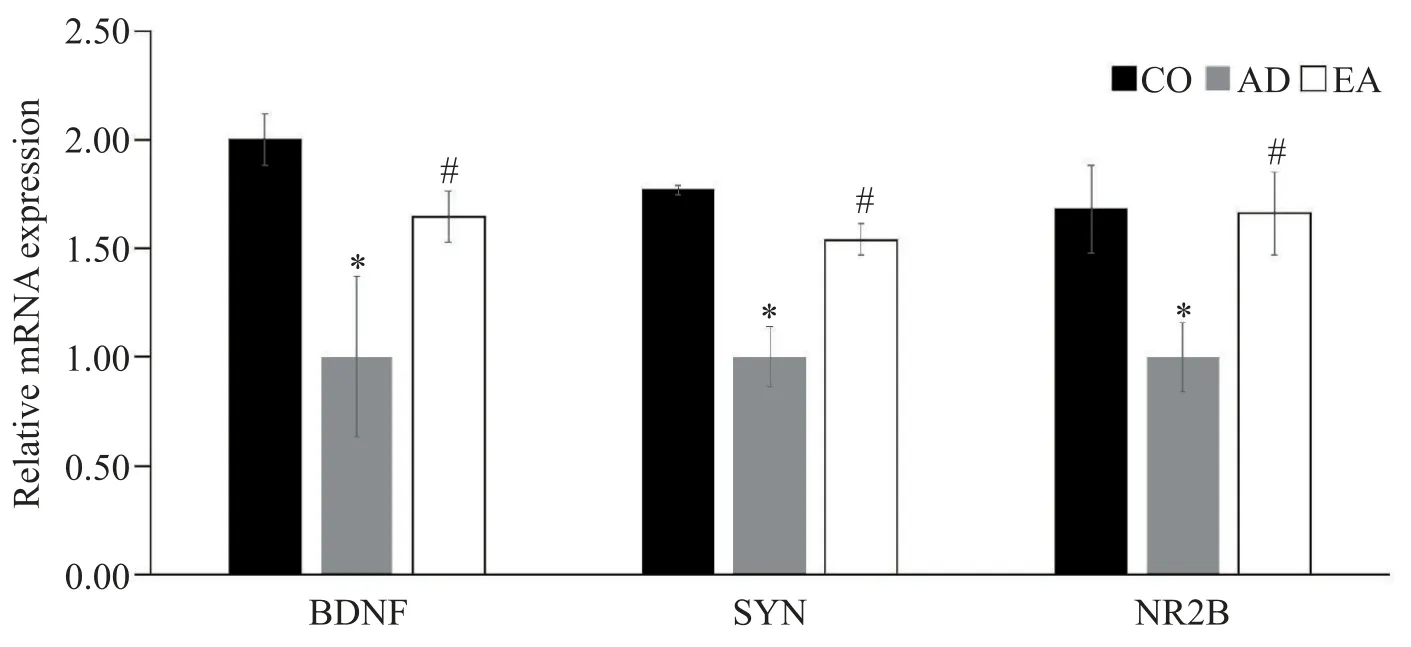
Figure 4.Relative mRNA levels of BDNF,SYN and NR2B in hippocampal tissues of the mice.Mean±SD. n=6.*P<0.01 vs control(CO)group;#P<0.01 vs AD group.图4 BDNF、SYN和NR2B mRNA表达相对量

Figure 5.Western blot results of BDNF,SYN and NR2B.Mean±SD. n=6.*P<0.05 vs control(CO)group;#P<0.05 vs AD group.图5 BDNF、SYN和NR2B的Western blot结果
很多研究证实EA 刺激可以改善AD 病人和模型小鼠的学习和记忆功能[10-12]。本研究的水迷宫检测结果也显示,经过16 周的电针“百会”“风府”和双侧“肾俞”后,与AD 模型小鼠相比,EA 组小鼠的学习和记忆功能明显增强。虽然EA 对其他原因造成的突触损伤和学习记忆障碍有改善作用[13-14],但是,我们认为EA 对AD 模型小鼠的防治作用具有独特的影响。Aβ 老年斑是AD 的早期特征性病理表现[2]。APP/PS1转基因小鼠在5 月龄(22 周左右)开始出现老年斑。在我们前期的研究中,6周龄APP/PS1转基因AD 模型小鼠经过16 周的继续饲养后,大脑皮层和海马出现大量Aβ 老年斑,而经过16 周的EA 干预组小鼠老年斑数量明显减少,同时学习记忆功能得到明显改善[15-16]。
本研究对海马CA1 区神经元树突Golgi 染色也显示,与CO 组比较,AD 组小鼠海马神经元树突棘部分丢失,数目减少;与AD 组比较,EA 组小鼠海马神经元树突棘数目明显增多。通过透射电镜观察发现,AD 模型小鼠海马区突触数目减少,前膜和后膜结构稀疏不清;经过16 周的EA 刺激“百会”“风府”和双侧“肾俞”后突触结构数目增多,结构清晰。这些结果与王煜[17]等的研究结果是一致的。树突棘是形成突触的重要部位,其数量可随功能而变化,即表现为突触的可塑性改变。突触可塑性是评价学习记忆能力的生物学基础。突触结构和生理功能的改变都可以导致其传递效能的改变[18]。这说明EA 刺激“百会”“风府”和双侧“肾俞”可改善AD 模型小鼠的突触结构,从而改善AD模型小鼠的学习记忆功能。
长时程增强是学习记忆的基础,其分子机制是海马谷氨酸突触后NMDA 受体和AMPA 受体的大量激活,使突触后反应增强[18]。NR2B是NMDA 受体的一个调节亚单位,主要存在于海马和皮层组织中,对学习记忆功能有较强的影响[18-19]。有研究已经证明,AD 模型小鼠海马区NR2B 的表达下降[20],通过慢病毒载体过表达NR2B 缓解了APP/PS1转基因小鼠的记忆障碍和焦虑抑郁样行为[21]。本研究实时荧光定量PCR 和Western blot 检测结果也显示,与CO 组相比,AD 组小鼠海马NR2B 的mRNA 和蛋白表达水平显著降低;与AD 组相比,EA 组小鼠海马NR2B 的mRNA 和蛋白表达水平显著升高,说明对AD 模型鼠进行16 周的EA 刺激“百会”“风府”和双侧“肾俞”,其学习记忆功能的改善可能与NR2B 增加引起的突触可塑性改善有关。
SYN 是分子量为38 000 的糖蛋白,位于突触前结构的突触囊泡膜上,促进突触小泡的前移和递质的释放,是成熟突触小泡和突触结构的重要标志性蛋白[22-23]。研究表明,SYN表达的增加能够增强大鼠的空间辨别性学习记忆能力[24-25]。Dong 等[26]的研究显示,与野生型大鼠相比,APP/PS1转基因大鼠小脑内SYN 和BDNF/TrkB 的表达降低,突触间隙宽度增加,突触后密度变薄。本研究结果也显示,EA 刺激AD 模型小鼠后,SYN 的mRNA 和蛋白表达增加的同时,海马神经元树突棘数目增多,电镜观察突触小泡增多、结构呈清晰改变。这说明EA 刺激“百会”“风府”和双侧“肾俞”对AD 模型幼鼠学习记忆功能的改善与由SYN引起的海马突触可塑性增强有关。
BDNF 可以诱导轴突和树突末端结构和功能变化[27]。在器官型耳蜗外植体中,BDNF增强了螺旋神经节神经元和内毛细胞之间的突触形成,并在毒素诱导的突触病中恢复了这些连接[28]。de Pins 等[29]的研究显示,在过表达BDNF 的杂交鼠中,BDNF/TrkB下游信号传导活性与树突棘密度和形态的改善相关;与5xFAD 小鼠相比,杂交鼠的突触标志物PSD-95 和突触素也有不同程度的恢复,兴奋性突触的突触前小泡数量也有所增加。本研究结果也显示,EA刺激AD 模型幼鼠的“百会”“风府”和双侧“肾俞”,在电镜观察到突触前活性区和突触后致密带增厚改变的同时,BDNF 的mRNA 和蛋白表达增加,说明电针“百会”“风府”和双侧“肾俞”对AD 模型小鼠学习记忆功能的改善与BDNF 引起的海马突触可塑性改善有关。
总之,本研究结果说明,通过对6 周龄APP/PS1幼鼠进行为期16 周的EA 刺激“百会”“风府”和双侧“肾俞”,明显改善了小鼠的学习记忆功能和突触可塑性。本研究结果将为EA刺激预防和治疗AD 提供研究基础,其信号机制还需进一步研究。
