机械敏感性离子通道Piezo1在代谢性疾病中的作用*
2022-09-01黄燕玲赵雅雯许戈阳
刘 阳,黄燕玲,赵雅雯,许戈阳
(暨南大学基础医学与公共卫生学院生理学系,广州广东 510632)
代谢性疾病是一类与遗传、环境、生活方式、运动等因素有关的病因复杂、病程缓慢且难以治愈的慢性疾病,包括糖尿病、肥胖、动脉粥样硬化、高血压等[1,2]。临床上将这种代谢紊乱引发的一系列病理现象统称为代谢综合征(metabolic syndrome,MetS),其特征是血糖升高、胰岛素抵抗和炎症、血脂异常、脂肪蓄积、血压升高、血栓形成等危险因素并存[2-3]。这些因素与患2 型糖尿病(type 2 diabetes,T2MD)和心血管疾病(cardiovascular diseases,CVD)等慢性病的风险增加有关[4]。MetS 促使动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的患病风险大约增加1 倍,患糖尿病的风险增加了大约5 倍,并且在成年人群中发病率很高,致使全球公共卫生系统的成本明显升高[5,6]。因此对影响代谢紊乱的相关因素的研究,以探寻代谢性疾病的病因和发病机制尤为重要。
碳水化合物、脂肪、蛋白质等营养物质是维持机体正常生命活动所必需的。当营养物质的合成代谢与分解代谢的平衡被打破时,往往会引起病理生理性变化,造成代谢紊乱并逐渐发展为糖尿病、肥胖、动脉粥样硬化、高血压等代谢性疾病[7]。而机械力感受及力学信号转导是生物体接收和响应来自内部和外部环境的机械刺激,调节各器官生理功能及能量代谢平衡的一种主要方式。并且近年来研究显示Piezo1 参与多个能量代谢调节过程,Piezo1 离子通道功能障碍会诱发多种代谢性疾病[8]。机械刺激激活Piezo1,引起Ca2+内流增多,影响INS-1 细胞的胰岛素释放,导致糖尿病及其并发症的发生发展[9-10]。在脂类代谢的过程中,Piezo1可以影响脂肪组织的炎症反应、胰岛素敏感性和调控前脂肪细胞的分化[11]。此外,Piezo1调控细胞的增殖、分化、迁移、凋亡、炎症反应和血管舒缩等过程,引起血管壁的脂质斑块形成和血管内皮的改变,进而导致动脉粥样硬化和高血压等代谢性疾病的发生发展[12-13]。因此,本文综述近年来的相关文献,讨论机械敏感性离子通道Piezo1在糖尿病、肥胖、动脉粥样硬化、高血压等代谢性疾病中的作用,为代谢性疾病的病因和发病机制提供参考资料。
1 Piezo蛋白的发现
机械敏感性离子通道可将机械刺激转换成生物信号来调节各项生理活动,其中,机械敏感性离子通道Piezo 是一种新型的机械门控离子通道,广泛分布于哺乳动物的皮肤、肾脏、肺、心脏等各个组织器官。2010 年Coste 检测到受刺激的小鼠神经母细胞瘤细胞(Neuro2A)可以产生与脊椎动物体内相似的机械激活(MA)的电流,并通过使用Affymetrix 微阵列筛选Neuro2A 细胞中能产生MA 电流的离子通道候选转录本。Coste 使用siRNA 下调Neuro2A 细胞中的每个候选基因的表达后,测量压力诱发的MA电流的变化,最终结果显示,敲低Fam38A导致MA 电流显著降低,Fam38A编码被机械压力激活的离子通道蛋白。Coste 将这个蛋白命名为Piezo1,来自希腊语“πίεση”(pίesi),意思为“压力”[14]。随后研究进一步确定了脊椎动物特有两类Piezo 蛋白亚型:Piezo1 和Piezo2,而在其他类型的动物和植物中只表达一种Piezo 亚型[14-15]。随着研究的深入,Piezo 蛋白的结构和功能已逐渐清晰。
2 Piezo蛋白的分型和功能及其下游信号通路
不同于其他物种,脊椎动物体内Piezo 可分为Piezo1 和Piezo2 两类亚 型,分别由FAM38A和FAM38B基因编码。当外界机械性张力刺激细胞膜时,细胞膜或细胞膜附近的Piezo1或Piezo2能够感受刺激,打开离子通道从而使得Na+、Ca2+等阳离子进入细胞,实现机械刺激向电信号和化学信号的转化[16]。
Piezo1主要表达暴露在流体压力和流量的组织,如:皮肤、肾脏、肺、膀胱、结肠、肾脏等组织器官[14]。Piezo1 蛋白能够感知与肺、膀胱、结肠等内脏疼痛相关的机械信号,介导Na+、Ca2+等离子的内流,从而调控相应的生理过程。而Ca2+作为最关键和最普遍的第二信使之一,参与众多细胞信号的传导。Piezo1离子通道可以通过细胞内储存的钙库释放或细胞外膜形成机械门控离子通道来调控细胞内Ca2+浓度[17]。当细胞内的Ca2+浓度增加时,可通过以下几条信号通路介导相关的代谢性疾病的发生发展:(1)促进INS-1细胞、小鼠胰岛释放胰岛素[9];(2)Ca2+-FGF1通路可以影响脂肪细胞的分化,诱发脂质的蓄积,介导肥胖的发生 和进展[18];(3)通 过Ca2+-TNF-α、NF-κB、VCAM-1 通路介导介导内皮动脉粥样硬化性炎症反应[19];(4)通过CaM-CaMKKβ-CaMKIV-mTOR 通路介导细胞的增殖和迁移过程[20];(5)可以通过P2Y2-Akt-NOS通路可以调控血管的舒缩,适应机体血压的变化[13]。见图1。
Piezo2多数富集在三叉神经感觉细胞、背根神经节和Merkel细胞等感觉组织中,能感应触觉、痛觉等刺激[21]。对于某些皮肤细胞和机械感觉神经细胞来说,Piezo2 介导的Na+、Ca2+内流可以使细胞膜去极化并触发动作电位,而细胞中Piezo2基因缺失则会消除机械刺激诱发的电活动,从而导致机械感觉的障碍[21,22]。
3 Piezo1离子通道的激动剂与拮抗剂
Syeda 从325 万种化合物中筛选出的一种名为Yoda1的小分子化合物,可以在没有其他细胞成分的人工脂质双分子层中激活Piezo1 离子通道,并引起相应电流的改变[23]。Yoda1 可以稳定Piezo1 蛋白的开放构象,降低激活的机械阈值,而这种效应允许Yoda1 在没有机械刺激的情况下激活部分Piezo1 离子通道,因此Yoda1 成为研究Piezo1 的常用激动剂[24,25]。尽管Piezo1 与Piezo2 之间的序列相似性很高,但Piezo2不受Yoda1的调节[25]。
半胱氨酸结家族的35 氨基酸肽毒素抑制剂(GsMTx-4)是一种从Grammostola spatulata 蜘蛛的毒液中分离出来的毒素,充当门控调节剂,增加通道激活所需的膜张力,有利于维持机械敏感性离子通道的关闭状态[26,27]。D-GsMTx4 和L-GsMTx4 的结构差异性较低,在阻断Piezo1 机械敏感电流方面有相同效应,而D-GsMTx4 则可以剂量依赖和可逆地抑制Piezo2机械敏感电流[28]。
4 Piezo1离子通道在代谢性疾病中的作用
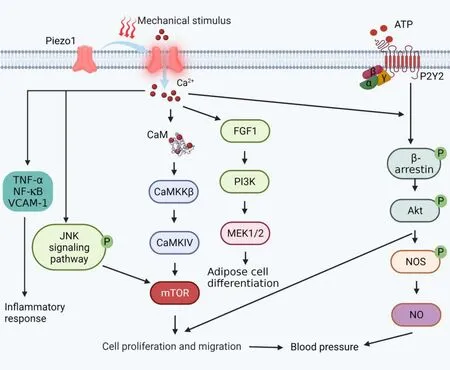
Figure 1.Related signaling pathways after Piezo1 activation.Akt:protein kinase B;ATP:adenosine triphosphate;CaM:calmodulin;CaMKKβ:calcium/calmodulin-dependent protein kinase kinase β;CaMKIV:calcium/calmodulin-dependent protein kinase type IV;FGF21:fibroblast growth factor 21;JNK:c-Jun N-terminal kinase;mTOR:mammalian target of rapamycin;NF-κB:nuclear factor kappa B;NO:nitric oxide;NOS:nitric oxide synthases;Piezo1:Piezo type mechanosensitive ion channel component 1;P2Y2:P2Y purinoceptor 2;TNF-α:tumor necrosis factor alpha;VCAM-1:vascular cell adhesion molecule-1.图1 Piezo1被激活后的相关信号通路
4.1 Piezo1离子通道在糖尿病中的作用 研究表明Piezo1 离子通道可以影响胰岛素的分泌和相关的胰腺炎症反应,从而影响糖尿病的发生发展。Deivasikamani 及其同事观察到INS-1 和BRIN-BD11 细胞均有Piezo1 的表达。采用Piezo1 的激动剂Yoda1 会激活Piezo1 离子通道,引起的Ca2+内流增加。12dyne/cm2的剪切应力刺激、高葡萄糖环境或低渗环境下细胞的肿胀均会诱导INS-1细胞分泌胰岛素;而Piezo1-siRNA显著抑制Yoda1和低渗对INS-1细胞的刺激作用。与野生型小鼠相比Yoda1 诱导胰岛细胞分泌胰岛素的效应在Piezo1+/-小鼠受到明显抑制[9]。这些结果表明Piezo1 离子通道激活能够调控胰岛素分泌,进一步研究机械敏感性离子通道Piezo1 诱导胰岛素分泌的机制具有重要的临床价值。此外,高血糖刺激血细胞中Piezo1的转录,导致人类血小板中的Ca2+升高和磷脂酰丝氨酸暴露,从而触发凝血酶原复合物(Xa 因子、Va 因子和凝血酶原)在血小板表面的组装,凝血酶生成,进而促进血栓形成[10]。这表明Piezo1通过促进血小板增加和凝血酶生成,在糖尿病患者中具有促血栓形成的作用,进而增加了糖尿病并发其它系统疾病的风险。由此可以得出,Piezo1不仅参与了糖尿病的发生发展,而且对其所并发的其它系统相关疾病损害有关,在机体的糖代谢中起着重要作用。了解Piezo1 在各器官组织当中对糖代谢的相关机制和途径,对于糖尿病的治疗相关药物的研发,有望能找到一些具有全身性调节糖代谢作用的药物,进而找到治疗糖尿病的新方法。
4.2 Piezo1离子通道在肥胖中的作用 脂肪细胞负责以脂肪的形式储存食物能量,并具有高度的可塑性和动态性,以响应营养的变化[29]。在肥胖症中,脂肪可塑性受损,脂肪储存和脂肪分解的平衡被打破,导致脂肪炎症和脂肪分解增强,进而引起肝脏等其他代谢器官的异位脂质沉积,导致全身胰岛素抵抗[29,30]。
Romero 实验室研究显示,乳制品和鱼类中的长链饱和脂肪酸会削弱小鼠神经母细胞瘤细胞(Neuro2A)细胞中Piezo1 对机械刺激的应答,从而抑制Neuro2A 细胞中Piezo1 的活性[31]。提示细胞能够通过Piezo1 响应脂肪酸代谢的变化。Zhao 则观察到Piezo1在肥胖小鼠脂肪组织中高表达,脂肪组织特异性Piezo1敲除会引起脂肪炎症浸润和胰岛素抵抗,高脂喂养则会进一步加剧这些不良后果。并且在脂肪组织特异性Piezo1敲除小鼠模型的肝脏中,脂肪酸合成基因的表达也显著增加,进而导致肝脏的脂肪变性[11]。上述研究表明,Piezo1离子通道可能参与调节肥胖患者的脂质代谢、维持脂肪可塑性、脂肪异位沉积和胰岛素抵抗等过程。
在另一项研究中,Wang 的研究显示在高脂喂养时,小鼠成熟脂肪细胞缺乏Piezo1 会造成前脂肪细胞向成熟脂肪细胞的分化障碍,导致脂肪细胞增大、脂肪组织重量增加、白色脂肪组织炎症;这是因为成熟脂肪细胞中Piezo1 离子通道打开,Ca2+内流增加,促进脂肪成纤维细胞生长因子1(FGF1)释放,激活下游PI3K-MEK 通路,从而诱导前脂肪细胞的分化(见图1)[18]。结合之前研究,脂肪细胞的可塑性对全身脂质代谢和胰岛素敏感性起着重要作用,并且随着脂肪细胞大小和体积的变化,对细胞膜的机械性压力刺激也随之变化[11,18]。推测Piezo1 离子通道可通过感受肥胖所引起的脂肪细胞膜张力变化,参与调节脂类代谢、脂肪异位沉积、脂肪细胞的分化过程。
4.3 Piezo1离子通道在动脉粥样硬化中的作用 脂质代谢障碍是动脉粥样硬化的病变基础,血浆总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(VLDL-C)及相应的载脂蛋白B(apoB)增高、高密度脂蛋白胆固醇(HDL-C)和载脂蛋白A(apoA)的降低均被认为是动脉粥样硬化的高危因素[32]。动脉粥样硬化的特点是脂质和复合糖类积聚于血管壁内膜,进而纤维组织增生及钙质沉着,导致动脉壁增厚变硬、血管腔狭窄,从而改变血流流体动力学,减少或阻断组织器官的血流供应[33]。而血管内皮细胞、平滑肌细胞和巨噬细胞的病理性炎症、细胞增殖、迁移和凋亡等相关因子改变是动脉粥样硬化发病机制的标志[32-33]。大量研究已经报道,血管内皮Piezo1 在感受压力、拉伸和流体剪切应力中具有重要的意义。在动脉粥样硬化小鼠中,GsMTx-4 可减少斑块形成,下调小鼠颈动脉斑块的炎症相关因子JNK、TNF-α、NF-κB 和VCAM-1 的表达(图1)。同时,氧化低密度脂蛋白(ox-LDL)刺激内皮细胞(ECs)表达Piezo1 和JNK、TNF-α、NF-κB 等炎症因子。YAP(Yes 相关蛋白)/TAZ(具有PDZ结构域(盘状同源区域)的转录共激活因子)在ox-LDL 诱导的内皮细胞中被激活,且Piezo1 活性也得到增强,而Piezo1-siRNA 则削弱了ox-LDL 的效应。此外,与对照组相比,ox-LDL 或Piezo1 激动剂Yoda1 均能诱导内皮细胞Ca2+内流,促进内皮细胞YAP 核易位,而Piezo1-siRNA 可削弱这一作用。这些结果表明,Piezo1 可以通过调节YAP/TAZ 激活和核定位来介导内皮动脉粥样硬化性炎症反应[19]。在过度机械拉伸作用于EC 时,EC 上出现SMC 的标记物(SM22、-SMA、caldesmon-1、SM-MHC和calponin)表达增加,表明在机械拉伸促进EC 表型向SMC 表型的转化,即EC 转化为SMC,并且体外循环流体剪切应力的机械刺激可促进血管平滑肌细胞增殖[34-35]。Piezo1 是非选择性的Ca2+通道,Piezo1 的激活可以促进Ca2+内流,而Ca2+在细胞增殖、迁移和凋亡调节中具有重要的作用[14,36]。细胞内Ca2+可通过钙调素(CaM)或钙调素依赖性蛋白激酶II(CaMKII)激活Akt/mTOR 通路,从而加速细胞增殖和迁移(见图1)[20]。总之,Piezo1 通过调控细胞增殖、迁移和凋亡等过程,引起血管腔的狭窄和血管壁弹性下降等病理改变,在动脉粥样硬化的发生发展中起着至关重要的作用。
4.4 Piezo1 离子通道在高血压中的作用 Piezo1 在传导细胞质膜内外部受力的过程中不可或缺,且被认为是内皮依赖性血管发育和血压调节所必须的血流传感器[37,38]。Lhomme 的研究显示,Yoda1 诱导肾上腺素预收缩的小鼠肺动脉(IPA)细胞外Ca2+内流,内皮一氧化氮合酶(eNOS)磷酸化,NO 合成增加,从而松弛IPA(见图1),而特异性敲除内皮细胞中的Piezo1可削弱Yoda1 的这一效应[39]。并且Wang 在人脐动脉内皮细胞(HUAEC)沉默Piezo1和血管内皮细胞特异性敲除Piezo1的小鼠模型上也观察到剪切应力诱导的Ca2+内流受到了抑制,内皮eNOS 活性和的cAMP 释放均显著减弱、平均动脉血压升高[13]。Iring和他的同事检测到血管内皮细胞上的Piezo1 受到流体剪切应力的刺激后,可诱导肾上腺髓质素释放,进而激活其Gs(活化型调节蛋白受体)偶联的嘌呤能受体P2Y2,升高胞内cAMP 水平,促进了eNOS 的磷酸化,从而舒张血管,降低血压[12]。这表明内皮细胞Piezo1 可以通过控制Ca2+内流,进而调控NO 的合成来调节血管的张力和血压。
另外研究显示,Piezo1 不仅影响血管内皮的结构,而且也可以调控血管平滑肌的增殖过程。Retailleau 的研究表明,在血管紧张素II(AngⅡ)诱发的慢性高血压小鼠模型中,平滑肌特异性敲除Piezo1会导致小鼠的动脉直径、壁厚和横截面积显著减少[37]。这些结果表明Piezo1 能够通过响应流量和压力的变化来调控血管平滑肌细胞的增殖,进而引起动脉的结构重塑,因此Piezo1 可能是治疗高血压疾病的一个新靶点。
综上所述,Piezo1离子通道可以通过感受管腔的机械信号变化并将其转换为细胞内信号,引起血管张力、管径和血管壁等多种血管形态结构和功能的变化,从而参与血压的生理调节。因此Piezo1 在需要对流体剪切应力作出反应的血管内皮细胞、平滑肌细胞和血管舒缩中发挥重要的作用,这可能成为高血压和其它高血压性心血管疾病药物的研发途径。
5 结语与展望
Piezo1蛋白是近年来研究的热点,广泛存在于机体的各个组织,Piezo1离子通道可作为机械门控通道感受外界多种机械力的变化,在调控细胞内能量代谢中也发挥着重要的作用。在机体代谢紊乱,Piezo1的功能出现障碍时,通过影响下游信号的传导,从而参与肥胖、糖尿病和动脉粥样硬化、高血压等代谢性疾病的发生发展。但Piezo1 离子通道如何感受机体能量异常、调控糖脂代谢的准确机制目前仍不是很清晰,有待深入研究,为相关的代谢性疾病的研究与治疗提供新的途径和方法。
