刺葡萄白藜芦醇合成酶基因对不同光质的响应及转录因子筛选
2022-09-01赖恭梯阙秋霞赖谱富高慧颖赖呈纯
赖恭梯,阙秋霞,赖谱富,高慧颖,王 琦,赖呈纯*
(1 福建省农业科学院 农业工程技术研究所,福州 350003;2 福建省农产品(食品)加工重点实验室,福州 350003)
芪类化合物是植物生物和非生物胁迫下产生的一种植保素,白藜芦醇(resveratrol,Res)又称芪三酚,是天然芪类化合物的代表,化学名称为3,4′,5-三羟基二苯乙烯,白藜芦醇有抗氧化、抗炎、抗肿瘤及心血管保护等作用[1-4]。白藜芦醇和类黄酮生物合成途径均源于苯丙烷类代谢途径,苯丙氨酸在苯丙氨酸解氨酶(PAL)作用下生成肉桂酸,再通过肉桂酸-4-羟化酶(C4H)作用下生成4-香豆酸,随后在香豆酰CoA连接酶(4CL)作用下生成4-香豆酰CoA和丙二酰CoA,最后在芪合酶(STS)和查尔酮合成酶(CHS)催化下分别进入白藜芦醇和类黄酮合成代谢途径[5-6]。STS与CHS同属于聚酮化合物合酶(PKS)超家族,因此STS与CHS同源性高,同时STS和CHS的催化功能具有一定的可变性[7]。STS是芪类化合物生物合成的关键酶,根据作用的底物及生成的产物不同可将其分为2类,一类是以肉桂酰辅酶A为底物生成银松素的银松素合成酶(pinosylvin synthase, PS),PS主要存在于裸蕨植物中;另一类是以4-香豆酰辅酶A为底物生成白藜芦醇的白藜芦醇合成酶(resveratrol synthase, RS)[8],RS仅存在于葡萄、花生、藜芦等有限植物中[9]。
从植物中提取的白藜芦醇安全可靠,但是受植物材料限制、前处理复杂、提取效率低、成本高,而通过离体细胞培养可避免天然植物提取所面临的瓶颈。细胞工程结合基因工程在遗传改良上的应用,可针对某一特定代谢产物进行调控,进行植物细胞次生代谢产物生产研究。柳忠玉[10]将虎杖PcRS基因转化拟南芥,结果发现PcRS能够促进白藜芦醇的合成,白藜芦醇的合成积累受PcRS的表达和底物浓度的共同调控。张宇[11]研究了葡萄白藜芦醇代谢途径关键基因的表达及其调控的机制,发现葡萄STS基因受多种生物和非生物诱导表达,同时与多种不同信号途径基因有较高的相关性。由于STS与CHS之间存在竞争关系,导致葡萄果皮中白藜芦醇含量与花色苷含量呈负相关[12]。花色苷与白藜芦醇的关系并不固定,而是处在动态变化中[6]。转录因子是植物代谢产物生物合成的重要调控因子,能够调控白藜芦醇等代谢产物合成途径中多个结构基因的表达[13-16]。因此,通过调控STS或RS表达,能够调节RS基因在底物利用中的竞争力,进而调节白藜芦醇的合成和积累。此外,环境因素对RS的表达也具有重要的影响作用,光照是植物生长发育和代谢产物合成的关键因子,其中光质能够调控白藜芦醇等次生代谢产物的合成及其合成代谢基因的表达[17],因此光质的筛选及其作用机理是葡萄白藜芦醇光响应研究的重点。本实验从刺葡萄中克隆RS1基因,进行了生物信息学分析,对靶向RS1的转录因子进行预测,并对刺葡萄愈伤组织进行不同光质培养处理,研究RS1及其候选转录因子基因在不同光质下的表达,以明确RS1的表达模式及其转录因子调控特征,为细胞工程白藜芦醇高效生产和白藜芦醇生物合成分子调控机制研究奠定理论基础。
1 材料和方法
1.1 植物材料与培养条件
刺葡萄愈伤组织细胞系为福建省农业科学院农业工程技术研究所营养科学与工程研究室继代保存,对愈伤组织进行不同光质培养处理,光质类型包括紫光、蓝光、绿光、黄光、红光、白光、暖白光和暖黄光,通过LED提供光源,采用HIPoint HR350光谱分析仪(中国台湾)测定光照强度和波长峰值,通过调整LED灯数量,使不同可见光质的光强尽可能处于2 000 Lx。每个处理的愈伤组织接种5瓶,每瓶接种6个细胞团,每团约0.05 g,3次重复。培养基为MS + 1.0 mg/L 2,4-D + 3%蔗糖 + 0.6%琼脂(pH 5.8),培养温度为(25±2)℃,光周期为12 h光照/12 h黑暗。
1.2 方 法
1.2.1 刺葡萄RS基因克隆与分析以刺葡萄愈伤组织为材料,总RNA提取采用北京天根提供的RNAprep Pure多糖多酚植物总RNA提取试剂盒,cDNA合成采用北京全式金提供的TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒,操作步骤按说明书进行,以葡萄基因组数据和NCBI已经登录的RS基因序列为模板,设计引物用于RS基因克隆,引物信息见表1。扩增产物经电泳、切胶回收、连接克隆载体、转化大肠杆菌、菌落PCR,最后委托白鲸生物科技有限公司进行测序,验证正确的序列提交到GenBank数据库中。

表1 引物信息Table 1 Primer information
1.2.2RS1基因生物信息学分析通过Gene Structure Display Server 2.0、ProtParam、SignalP-5.0、NetPhos、SWISS-MODEL、CELLO、WoLFPSORT、iPSORT在线软件,进行基因结构、蛋白质理化性质、信号肽、磷酸化、蛋白质三维模型、亚细胞定位预测分析;采用NCBI-CDD数据库和MEME进行保守结构域和保守基序预测;采用Mega5软件进行系统进化树构建;提取RS1基因起始密码子上游2 000 bp序列,采用PlantCARE在线软件进行RS1启动子顺式作用元件分析。
1.2.3 靶向RS1的转录因子预测和共线性分析以RS1启动子序列,通过PlantTFDB在线软件进行靶向RS1的转录因子预测;从EnsemblPlants下载葡萄、拟南芥、水稻和毛果杨的基因组及其注释数据,通过TBtools软件构建靶向葡萄RS1的转录因子基因与其他物种的基因共线图谱,并筛选出关键转录因子候选成员进行保守结构域和基因结构分析。
1.2.4RS1及其转录因子在不同光质下的表达模式刺葡萄愈伤组织于不同光质下培养,总RNA提取同1.2.1,cDNA合成和荧光定量PCR采用宝生物工程有限公司提供的PrimeScriptMTRT reagent Kit和TB Green®Premix Ex TaqMT,定量PCR引物经NCBI-Primer-BLAS进行特异性验证(表1),试验于Roche LightCycler 480中进行,通过转录水平分析明确RS1在不同光质下的表达模式,并验证候选转录因子的调控特征。
1.2.5 数据处理荧光定量PCR基因表达水平计算采用双内参基因分析方法,双内参基因为α-Tublin和60SRP[18-19]。数据分析和作图采用Excel和GraphPad Prism 8进行。
2 结果与分析
2.1 刺葡萄RS1基因克隆与序列分析
从刺葡萄愈伤组织中克隆到RS1基因,将其命名为VdRS1,序列信息提交到GenBank,登录号为OM339527,基因序列长度为1 206 bp,由2个外显子和1个内含子组成(图1,A),开放阅读框为1 179 bp,编码392个氨基酸,分子量为42.9 kD,理论等电点为5.97,为亲水性无信号肽蛋白,亚细胞定位预测为细胞质定位蛋白,NetPhos预测发现27个氨基酸位点发生磷酸化修饰(图1,B),其中13个苏氨酸位点,11个丝氨酸位点和3个酪氨酸位点,因此磷酸化修饰主要发生于苏氨酸和丝氨酸位点上。蛋白质的二级结构和三维结构模型见图1,C、D,该蛋白主要由α-螺旋、无规则卷曲和延伸链组成。
2.2 启动子顺式作用元件分析
启动子是下游基因表达的开关,因此启动子的活性及作用是参与基因表达的关键因素,通过PlantCARE对RS1基因上游启动子序列的预测发现,除了具有启动子基础元件如CAAT-box、TATA-box等还具有其他多种启动子顺式作用元件(图2,A)。RS1启动子上分布最多的为参与光响应的顺式作用元件,数量达到20个;其次为2类转录因子识别和结合元件,分别为MYB和MYC识别和结合元件,数量均为6个;第三类为激素响应元件,包括茉莉酸甲脂和生长素,均为2个;此外还有参与防御与胁迫、低温和胚乳表达响应的元件各1个(图2,B)。综上,RS1的启动子可能主要参与了葡萄光响应、转录因子识别与结合、激素调控、生长发育、环境条件响应,其中具有多个光响应、MYB和MYC识别和结合元件。
2.3 靶向RS1的转录因子分析
靶向RS1的转录因子及其在启动子上的结合位点数量统计结果(图3,A;表2)显示:具有23个靶向RS1的转录因子,MYB及其相关转录因子8个、Dof 转录因子6个、BBR-BPC和C2H2转录因子各2个,AP2、MIKC_MADS、GRAS、Trihelix和WRKY各1个。转录因子系统进化树和保守基序(图3,B—E),其中6个MYB含有3种motif的被聚为一类,而另外2个MYB仅有motif1自成一类,因此上述8个MYB转录因子可划分为2个类别。转录因子Dof虽然也预测获得3个保守基序,但是E值显示Motif2和Motif3并不显著,因此Dof具有非常保守的Motif1基序,系统进化分析显示6个Dof相似性较高。
进一步挖掘转录因子的基因信息,结果(表2)显示,23个转录因子基因分布于葡萄19对染色体中的15对,14个转录因子基因位于正链,另外9个位于负链,不同家族间的基因长度差异较大,ORF长度介于480~1 773 bp之间,平均为892 bp。预测的转录因子在RS1的启动子上具有多达93个结合位点,MYB、Dof和BBR-BPC分别具有11、30和8个结合位点,虽然靶向RS1的AP2和MIKC_MADS均只有1个,但是其结合位点分别达到了18和19个,因此MYB、Dof、BBR-BPC、AP2和MIKC_MADS可能在RS1的转录调控中发挥着重要的作用。

表2 靶向RS1的转录因子基因信息Table 2 Information of transcription factor genes targeting at RS1
2.4 转录因子基因共线性分析
以葡萄、拟南芥、水稻和毛果杨的基因组及其注释数据为基础,靶向葡萄RS1的23个转录因子基因中有18个成员在其他物种中具有共线基因(图4,A、B),在拟南芥、水稻和毛果杨中的共线基因分别为29、15和44个,因此葡萄转录因子与毛果杨具有较高的共线性,其次为拟南芥,而与单子叶禾本科的水稻基因共线性最低。由图4,B可知,具有共线性的18个靶向葡萄RS1的转录因子分布于葡萄19对染色体中的13对,染色体8号、1号和17号上的转录因子具有较多共线基因,分别达到22、13和11个。进一步对染色体上的共线基因进行分析发现位于8号染色体上的MYB-DIV(VIT_08s0007g01920)和Dof5.1 (VIT_08s0007g00180),以及位于1号染色体上的BBR-BPC1-like (VIT_01s0011g06380)分别具有11、9和9个共线基因,并且在其他每个物种中的共线基因达2~5个,因此上述3个转录因子在不同物种间的共线性高,功能保守。保守结构域预测结果(图4,C-E)显示,MYB-IDV具有SANT和MYB保守结构域,Dof5.1具有zf-Dof保守结构域,BBR-BPC1-like具有GAGA保守结构域,基因结构特征显示MYB-DIV基因具有2个外显子和1个内含子,而Dof5.1和BBR-BPC1-like均具3个外显子和2个内含子。分析表明,MYB-DIV、Dof5.1和BBR-BPC1-like转录因子具有多个RS1启动子结合位点,而且在不同物种间共线性高、功能保守,推测其在白藜芦醇生物合成过程中参与RS1的表达调控。
2.5 RS1及其转录因子在不同光质处理下的表达模式
RS1启动子具有大量光响应元件,推测RS1可能受光调控表达,通过不同光质处理进一步揭示RS1的表达特征,并验证候选转录因子基因(MYB-DIV、Dof5.1和BBR-BPC1-like)的表达模式。转录水平分析结果见图5,短波光(紫光、蓝光、绿光)处理下,RS1的表达水平总体低于长波光(黄光、红光)和混合光质(白光、暖白光和暖黄光)处理,当培养45 d时,红光和白光下RS1的表达水平较低,可能由于白光主峰波的波长为短波光在此时起主导作用。RS1与MYB-DIV基因在7种光质下具有相同的表达特征(表3),仅在暖白光下的表达模式不同,分别呈先升后降和下调表达模式。RS1和MYB-DIV在紫光下呈上调表达,在蓝光和绿光下呈先降后升,二者在3种短波光下总体呈上调表达趋势。在长波光的黄光和红光下,其表达模式呈先升后降,在混合光质白光和暖黄光下分别呈下调和上调表达。RS1和MYB-DIV的表达模式总体相同,在短波和长波光质下总体呈上调和先升后降的变化,因此,MYB-DIV在RS1的转录表达中起正调控作用。
靶向RS1的另一转录因子基因Dof5.1与RS1总体呈相反的表达模式(表3,图5),短波光下Dof5.1的表达水平高于RS1,在长波光质下Dof5.1总体呈上调表达,在混合光质暖白光和暖黄光下亦呈现上调表达模式,可能是由于该两种混合光质的主波峰为长波特性,因此长波光起主导作用。虽然Dof5.1基因与RS1在紫光和暖黄光下亦为上调表达,但是在紫光下上调幅度较小,趋于平缓状态;而在暖黄光下,Dof5.1表现为培养后期急剧上调,而RS1的表达呈培养前期上调。由于Dof5.1与RS1的表达模式呈负相关,因此,Dof5.1在RS1的转录表达中起负调控作用。此外,通过3对特异引物对BBR-BPC1-like基因进行荧光定量PCR扩增,均未采集到扩增信号。综上,转录因子MYB-DIV和Dof5.1分别通过正负效应调控RS1的表达参与刺葡萄白藜芦醇的生物合成。
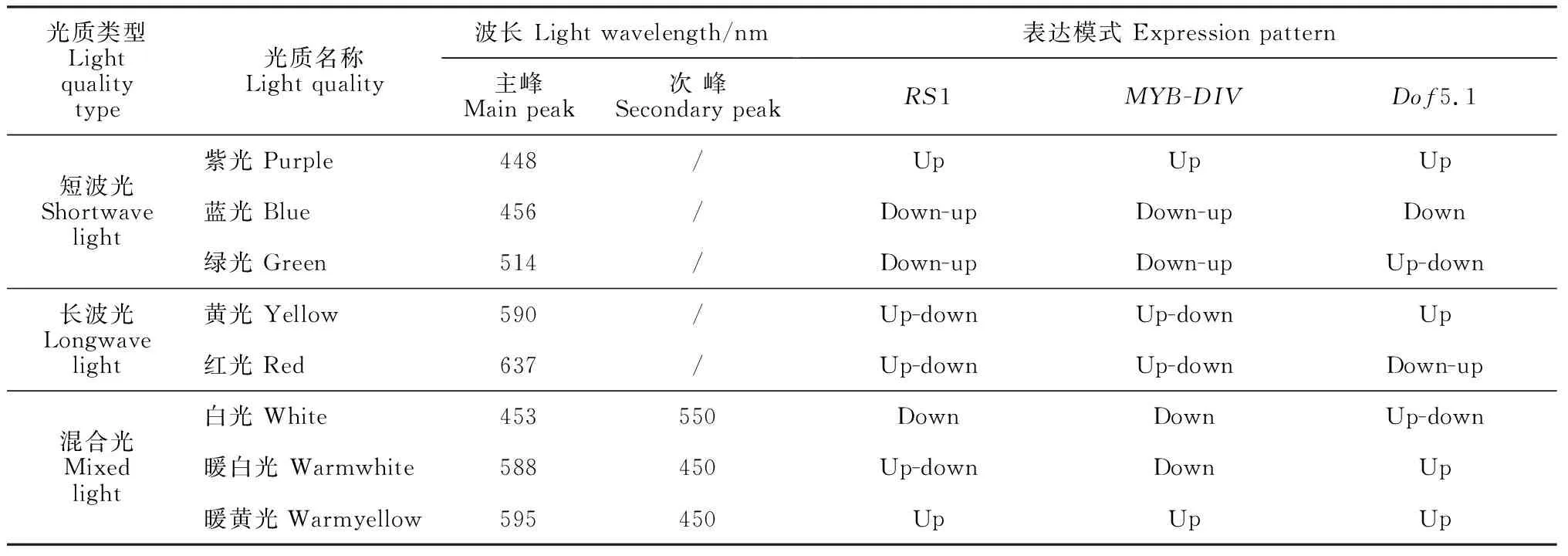
表3 光质类型及基因表达模式Table 3 Types of light quality and gene expression pattern
3 讨 论
3.1 长波光质促进刺葡萄RS1的高表达
光照是植物生长发育和次生代谢产物合成积累过程中最重要的环境因素之一[20],不同植物不同组织及其基因对光质的响应效应不同,张真认为最有利于提高葡萄白藜芦醇的含量和产量的光质依次为:白光、黄光、红光、蓝光和绿光[21],其结果表明长波光利于白藜芦醇的合成积累。也有研究发现蓝光明显促进‘黑比诺’葡萄愈伤组织白藜芦醇的含量和产量,而红光不利于白藜芦醇的积累[22]。在虎杖中,黄光和绿光均有利于愈伤组织的增殖,但是蓝光有利于白藜芦醇的积累[23]。白藜芦醇合成及其基因的表达具有物种特异性,此外,紫外线UV-C也被认为在白藜芦醇的合成积累中具有强诱导作用,通过诱导PAL、C4H、4CL和STS的上调表达,同时抑制CHS,从而促进白藜芦醇的合成[24]。
本研究结果表明,短波光质包括紫光、蓝光和绿光处理下的RS1的表达水平显著低于长波光质的黄光和红光以及混合光质的白光、暖白光和暖黄光,因此长波光促进RS1的表达,以上结果间接说明长波光有利于白藜芦醇的生物合成。光质对生长发育和次生代谢积累具有不同的效应[21],因此应该根据不同植物不同组织器官的特性,在不同阶段选择适宜的光质培养。葡萄细胞工程生产白藜芦醇应首先进行愈伤组织增殖培养,此阶段宜选择促进愈伤组织增殖的光质类型,以获得充足的提取原料;其次,筛选出白藜芦醇积累的最佳光质和时间,进行白藜芦醇合成和积累培养。本实验通过研究RS1在不同光质下的表达模式,提出长波光促进刺葡萄RS1的表达,为建立一套葡萄愈伤组织白藜芦醇生产的最佳光质培养方案提供理论基础。
3.2 MYB-DIV和Dof5.1通过正负调控参与RS1的转录表达
转录因子通过识别并结合启动子的顺式作用元件,调控下游基因的表达。本研究通过启动子顺式作用元件分析、转录因子预测和基因共线性比对,筛选出靶向RS1的3个候选转录因子,分别是MYB-DIV、Dof5.1和BBR-BPC1-like。MYB转录因子具有高度保守的MYB结构域,MYB参与白藜芦醇合成上游途径的苯丙烷代谢,以及具有竞争关系的类黄酮代谢途径,也在白藜芦醇代谢中发挥重要功能。
研究表明R2R3类型的MYB14和MYB15能够特异性地激活STS的表达参与白藜芦醇生物合成的转录调控[25],同时MYB15还在芪类化合物合成过程中参与调控其他转录因子的表达[26]。本实验荧光定量PCR结果表明,RS1及其转录因子基因MYB-DIV在不同光质下具有相同的表达模式(暖白光除外),两者的表达特征呈正相关,因此,MYB-DIV在RS1的转录表达中起正调控作用。
Dof是一类植物转录因子,由200~400个氨基酸组成,N端为高度保守的锌指结构DNA结合结构域,C末端为转录激活结构域。研究表明在大豆、大白菜和香蕉中的Dof家族成员分别达到78、76和74个[27-29],在葡萄中亦具有25个Dof转录因子成员[30],以上不同物种的Dof成员有待进一步通过实验进行验证。Dof家族基因涉及胁迫响应[31]、激素信号传递[32-34]、种子萌发[35-36]、生物合成[37-38]、细胞周期调控[39]等。通过利用酵母单杂交和烟草共转化,验证了葡萄VvDof14可以负调控VvABCG20基因的表达[40]。玉米ZmDof30可通过结合花粉特异表达基因Zm908启动子-126~+58区域的AAAG顺式作用元件,进而对其进行负调控[41]。在拟南芥中,Dof5.1过表达导致野生型出现叶片下卷表型,而Dof5.1突变会导致叶片上卷,并且促进叶片近轴-远轴极性基因REV表达,同时下调植物生长素基因IAA6和IAA19的表达[42]。通过转录因子预测和共线性分析,筛选到靶向RS1的候选转录因子Dof5.1,进一步通过荧光定量PCR表达分析验证,结果表明Dof5.1基因与靶基因RS1的表达模式总体呈相反趋势,Dof5.1在RS1的转录表达中起负调控作用。由于候选转录因子基因BBR-BPC1-like在不同光质处理下无扩增信号,因此不参与RS1的转录调控。本研究结果表明MYB-DIV和Dof5.1通过正负调控参与RS1的转录表达,调节葡萄白藜芦醇的生物合成。
