精氨酸对奶牛乳腺上皮细胞酪蛋白合成的影响
2022-09-01李大彪母晓佳郝怡泓
曹 越 李大彪 孙 梅 母晓佳 郝怡泓 杨 静
(内蒙古农业大学动物科学学院,动物营养与饲料科学自治区高等学校重点实验室,呼和浩特 010018)
乳蛋白是牛乳中的主要营养物质之一,其总量的70%以上是酪蛋白,主要包括αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白[1]。乳蛋白含量的高低直接影响牛奶品质的优劣。乳腺是具有合成和分泌功能的特殊器官,约90%的乳蛋白是乳腺组织利用血液中的游离氨基酸(amino acid,AA)在乳腺中从头合成的[2]。近年来研究发现,某些氨基酸,如精氨酸在乳蛋白中的含量低于乳腺从血液中吸收的量[3],这是因为吸收入血的精氨酸除了可以作为蛋白质合成的底物,还对体内一氧化氮、肌酸和多胺等物质的合成代谢过程具有功能性调节作用[4-5]。精氨酸在乳腺细胞中可以通过精氨酸-鸟氨酸代谢途径转化生成多胺,其具有促进细胞增殖、蛋白质周转以及合成的作用[6]。此外,研究发现精氨酸还可以作为信号转导分子通过激活哺乳动物雷帕霉素靶蛋白(mTOR)信号通路调控动物体内蛋白质的合成。当细胞外精氨酸供应发生改变时,处于活化状态的mTOR就会级联调控下游的效应蛋白核糖体蛋白S6激酶(S6K),进而参与细胞生长、分化、增殖及蛋白质合成等过程[7]。仔猪饲粮中添加10 g/kg精氨酸可显著提高肌肉组织mTOR信号通路相关蛋白磷酸化水平,并提高肌蛋白转化效率[8]。饲粮中添加12.8 g/kg的精氨酸可以显著提高大鼠乳腺细胞的活力及β-酪蛋白的合成量[9]。添加0.3 mmol/L精氨酸显著增加猪小肠上皮细胞mTOR及其下游信号分子S6K的磷酸化水平,进而促进猪小肠上皮细胞和胎盘滋养层细胞增殖[10-11]。
近年来,从微观分子生物学角度探究氨基酸对奶牛乳腺上皮细胞(BMECs)乳蛋白合成的影响机制已经成为泌乳生物学的研究热点。目前关于精氨酸对乳腺氨基酸代谢影响的研究大多以单胃动物为模型开展,而前人对反刍动物尤其是奶牛乳腺组织酪蛋白合成的研究仅停留在基因转录水平上[12-13],本研究拟在基因转录水平的基础上进一步从蛋白质翻译水平,深入阐述精氨酸对反刍动物乳腺酪蛋白合成的影响。鉴于此,本试验以BMECs为模型,研究不同浓度精氨酸对BMECs增殖率、精氨酸代谢关键酶活性、酪蛋白基因及蛋白表达量的影响,并从mTOR信号通路初步阐述其作用机制,为调控奶牛乳成分合成提供理论依据。
1 材料与方法
1.1 试验材料
DMEM/F-12培养基(12491-015)购自Gbico公司;L-精氨酸(A6969)、氢化可的松(H0135)、表皮生长因子(E4127)和胶原酶Ⅱ(17101-015)购自Sigma公司;胎牛血清(SH30084.03)购自Hyclone公司;RNA iso-plus(SD1410)、反转录PCR试剂盒(RR047A)、实时荧光定量PCR(RT-qPCR)试剂盒(RR820A)和4X SDS-PAGE Loading Buffer(AJE0870A)购自TaKaRa公司;酶联免疫吸附法(ELISA)试剂盒(MM-5107101;MM-5106901)购自江苏酶免实业有限公司;制胶试剂盒(P1200-1)、细胞裂解液(R0020)和BCA试剂盒(PC0020)购自Solarbio公司;转膜液(P0021B)、电泳液(P0014B)和封闭液(P0228)购自北京碧云天科技有限公司;S6K(2708S)、pS6K(97596S)和β-肌动蛋白(4970S)抗体购自CST公司;酪蛋白抗体(ab166596)、mTOR抗体(ab2732)和P-mTOR抗体(ab84400)购自Abcam公司。
1.2 试验设计
采用单因素完全随机试验设计,以0.70 mmol/L精氨酸(DMEM培养基中精氨酸的浓度)为对照组,参照前人研究结果[14-15],试验组精氨酸的浓度分别为1.40、2.80、5.60和11.20 mmol/L,每组6个重复。采集健康奶牛的乳腺组织,分离培养BMECs,将P3代BMECs接种于75 cm2培养瓶,当细胞生长至80%汇合时,更换饥饿培养基(无血清)培养16 h,再用含不同浓度精氨酸的诱导培养基继续培养24 h,收集细胞用于相关指标检测。
1.3 试验方法
1.3.1 原代BMECs分离培养
从屠宰场采集健康奶牛的乳腺组织,分离培养BMECs。用手术刀将最外层的乳腺组织剥离干净,避开乳导管、血管及结缔组织等部位,从内部剪取适宜大小的组织块放入3×双抗磷酸缓冲溶液中,转入超净台,先用3×双抗磷酸缓冲溶液清洗2次,再用酒精浸泡约60 s,最后用1×双抗磷酸缓冲溶液清洗3次。用已灭菌的眼科剪选取无导管且富含腺泡的乳腺样品放入小瓶中,在小瓶中将组织块反复剪碎,直至看不到明显块状为宜,再加3 mL的胶原酶Ⅱ,确保混合完全后放到培养箱中进行消化,计时80 min,每隔20 min取出离心管上下颠倒。待消化结束后,将样品用无菌滤网过滤、离心(1 280×g)8 min后,将细胞悬浮于生长培养基进行37 ℃、5%二氧化碳(CO2)培养。
1.3.2 BMECs活力的测定
将细胞接种于96孔板,加入200 μL生长培养基于37 ℃、5% CO2培养箱中培养。在细胞培养至20和24 h分别加入MTT溶液20 μL和二甲基亚砜100 μL,置于摇床振荡10 min。用全自动酶标仪检测490 nm的吸光度(OD)值。细胞相对增殖率(RGR)计算公式如下:
细胞相对增殖率(%)=100×试验组OD490 nm/对照组OD490 nm。
1.3.3 精氨酸代谢关键酶活性的测定
培养结束后,弃去6孔板中的细胞培养液,收集细胞沉淀于1.5 mL EP管中。加入磷酸盐缓冲液(pH 7.2~7.4)调整细胞浓度为106个/mL左右。反复冻融破坏细胞后离心20 min,取上清液。采用双抗体夹心ELISA测定,根据试剂盒提供的方法对精氨酸酶和鸟氨酸脱羧酶活性进行测定,全自动酶标仪检测450 nm样品OD值,将其代入标准品浓度与相应OD值拟合出的线性方程,从而得到精氨酸酶和鸟氨酸脱羧酶的活性。
1.3.4 精氨酸代谢相关酶、酪蛋白和mTOR信号通路基因相对表达量的测定
培养结束后收集细胞于1.5 mL EP管中加入400 μL RNA裂解液,提取总RNA并测定其浓度及OD260 nm/OD280 nm,反转录合成cDNA。以β-肌动蛋白、磷酸甘油醛脱氢酶和泛素表达转录因子为内参基因,采用RT-qPCR技术检测精氨酸代谢相关酶、酪蛋白以及mTOR信号通路基因的相对表达量。引物序列及参数见表1。目的基因相对表达量采用2-△△Ct法计算分析。

表1 引物序列及参数
1.3.5 酪蛋白表达量及mTOR信号通路蛋白磷酸化水平的测定
培养结束后,在细胞沉淀中加入含1%苯甲基磺酰氟(PMSF)的放射性免疫沉淀缓冲液(RIPA裂解液)于冰上裂解30 min,然后离心5 min,取上清测定蛋白浓度。蛋白样品稀释、变性后采用Western Blot技术[16]测定α-酪蛋白表达量以及mTOR和S6K蛋白磷酸化水平。结果使用Image StudioVer 5.2软件进行灰度值分析。
1.4 数据统计与分析
用Excel 2016对数据计算整理,利用SAS 9.0软件的one-way ANOVA程序进行单因素方差分析,采用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 添加不同浓度的精氨酸对BMECs增殖率的影响
由表2可知,当精氨酸的浓度为2.80 mmol/L时,BMECs的增殖率显著高于对照组和其他精氨酸组(P<0.05),11.20 mmol/L精氨酸组BMECs的增殖率显著低于对照组(P<0.05),1.40和5.60 mmol/L精氨酸组BMECs的增殖率与对照组无显著差异(P>0.05)。

表2 添加不同浓度的精氨酸对BMECs增殖率的影响
2.2 添加不同浓度的精氨酸对BMECs中精氨酸代谢关键酶活性的影响
由表3可知,当精氨酸的浓度为2.80 mmol/L时,BMECs中精氨酸酶活性显著高于对照组和其他精氨酸组(P<0.05),1.40、2.80和11.20 mmol/L精氨酸组BMECs中精氨酸酶活性与对照组相比无显著差异(P>0.05);当精氨酸的浓度为2.80和5.60 mmol/L时,BMECs中鸟氨酸脱羧酶活性显著高于对照组和其他精氨酸组(P<0.05),1.40和11.20 mmol/L精氨酸组BMECs中鸟氨酸脱羧酶活性与对照组相比无显著差异(P>0.05)。

表3 添加不同浓度的精氨酸对BMECs中精氨酸代谢关键酶活性的影响
2.3 添加不同浓度的精氨酸对BMECs精氨酸代谢关键酶基因表达量的影响
由表4可知,当精氨酸的浓度为2.80 mmol/L时,BMECs中精氨酸酶基因相对表达量显著高于对照组和其他精氨酸组(P<0.05),1.40和5.60 mmol/L精氨酸组BMECs中精氨酸酶基因相对表达量与对照组相比无显著差异(P>0.05);当精氨酸的浓度为2.80和5.60 mmol/L时,BMECs中鸟氨酸脱羧酶基因相对表达量显著高于对照组和其他精氨酸组(P<0.05),1.40和11.20 mmol/L精氨酸组BMECs中鸟氨酸脱羧酶基因相对表达量显著低于对照组(P<0.05)。

表4 添加不同浓度的精氨酸对BMECs精氨酸代谢关键酶基因相对表达量的影响
2.4 添加不同浓度的精氨酸对BMECs酪蛋白基因相对表达量的影响
由表5可知,当精氨酸的浓度为2.80 mmol/L时,BMECs中CSN1S1基因相对表达量显著高于对照组和其他精氨酸组(P<0.05);11.20 mmol/L精氨酸组BMECs中CSN1S1基因相对表达量显著低于对照组(P<0.05);当精氨酸的浓度为2.80和5.60 mmol/L时,BMECs中CSN3基因相对表达量显著高于对照组和11.20 mmol/L精氨酸组(P<0.05)。

表5 添加不同浓度的精氨酸对BMECs酪蛋白基因相对表达量的影响
2.5 添加不同浓度的精氨酸对BMECs中mTOR信号通路相关基因相对表达量的影响
由表6可知,当精氨酸的浓度为2.80和5.60 mmol/L时,BMECs中AKT、S6K1基因相对表达量显著高于对照组和其他精氨酸组(P<0.05);2.80 mmol/L精氨酸组BMECs中mTOR、4EBP1基因相对表达量显著高于对照组和11.20 mmol/L精氨酸组(P<0.05),5.60 mmol/L精氨酸组BMECs中mTOR、4EBP1基因相对表达量有高于对照组的趋势,但差异不显著(P>0.05);2.80和5.60 mmol/L精氨酸组BMECs中eIF4E基因相对表达量显著高于1.40和11.20 mmol/L精氨酸组(P<0.05);各精氨酸组BMECs中PI3K基因相对表达量差异不显著(P>0.05)。
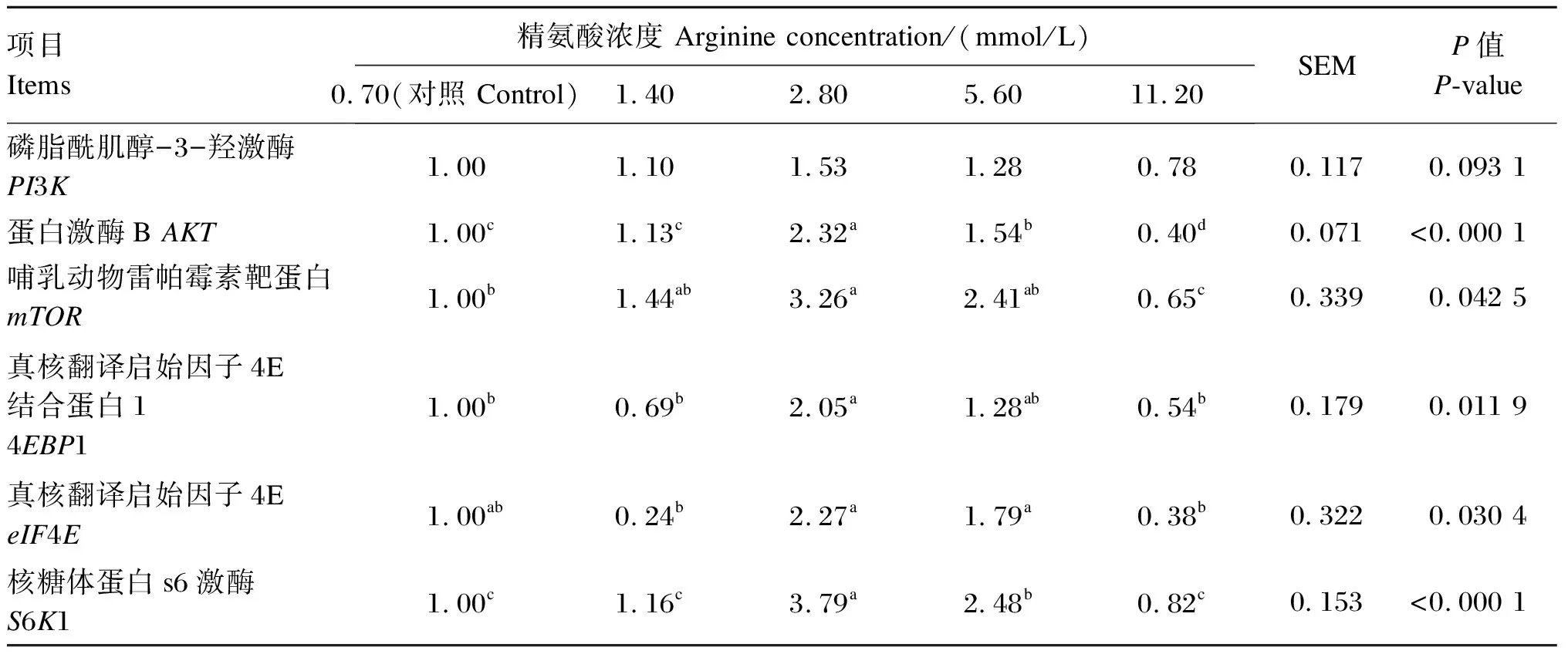
表6 添加不同浓度的精氨酸对BMECs中mTOR信号通路相关基因相对表达量的影响
2.6 添加不同浓度的精氨酸对BMECs酪蛋白表达量及mTOR信号通路蛋白磷酸化水平的影响
由图1可知,当精氨酸的浓度为1.40和2.80 mmol/L时,BMECs中S6K蛋白磷酸化水平和αs1-酪蛋白表达量显著高于对照组和其他精氨酸组(P<0.05),11.20 mmol/L精氨酸组BMECs中S6K蛋白磷酸化水平和αs1-酪蛋白表达量显著低于对照组(P<0.05);当精氨酸的浓度为1.40、2.80、5.60和11.20 mmol/L时,BMECs中mTOR蛋白磷酸化水平显著高于对照组(P<0.05),以2.80 mmol/L精氨酸组BMECs中mTOR蛋白磷酸化水平最高。

mTOR:动物雷帕霉素靶蛋白 mammalian target of rapamyein;p-mTOR:磷酸化动物雷帕霉素靶蛋白 phosphorylation of mammalian target of rapamyein;S6K:核糖体蛋白S6激酶 ribosomal protein S6 kinase;p-S6K:磷酸化核糖体蛋白S6激酶 phosphorylation of ribosomal protein S6 kinase;CSN1S1:αs1-酪蛋白 αs1-casein;β-actin:β-肌动蛋白。
3 讨 论
3.1 精氨酸对BMECs增殖的影响
动物体内细胞生长、增殖过程需要多种营养物质,如氨基酸、维生素、微量元素和无机盐。这些营养物质同样对于体外培养的BMECs增殖、分化和乳成分的合成是必不可少的[17]。罗海吉等[18]指出,精氨酸影响BMECs增殖的机理可能是由于精氨酸作为一种营养素是细胞增殖分化所需的底物。此外,精氨酸还对体内一氧化氮、肌酸和多胺等物质的合成具有功能性调节作用。精氨酸通过一系列酶的作用最终生成多胺,其具有促进细胞增殖、调控细胞生长和促进蛋白质沉积等多重作用[19-21]。本试验结果表明,当精氨酸浓度为2.80 mmol/L时显著提高了BMECs的增殖率,同时发现2.80 mmol/L精氨酸同样上调了BMECs中精氨酸酶和鸟氨酸脱羧酶的活性及其酶的基因相对表达量,这可能是由于其激活了精氨酸-鸟氨酸-多胺代谢通路,导致多胺生成,进而促进细胞的增殖。但在达到最适浓度后,随着精氨酸浓度的增加,BMECs的增殖率呈下降趋势,其原因可能是精氨酸转化生成大量的一氧化氮,而高浓度的一氧化氮可以抑制细胞增殖[12]。
3.2 精氨酸通过精氨酸代谢途径对BMECs酪蛋白合成的影响
研究发现,泌乳动物乳腺产出乳蛋白中的精氨酸含量远远低于乳腺对血液中游离的精氨酸的需要量[3],主要由于精氨酸作为一种功能性氨基酸,其在作为蛋白质合成前体物的同时,还可以在动物乳腺组织通过精氨酸代谢途径对乳蛋白的合成发挥功能性调节作用。精氨酸在动物乳腺组织中可以通过精氨酸-鸟氨酸途径发生分解代谢反应,其中精氨酸酶是促进精氨酸转化生成鸟氨酸的重要反应酶,鸟氨酸脱羧酶是鸟氨酸进一步转变为多胺的重要反应酶,多胺可以促进细胞的增殖、蛋白质合成。丁洛阳[22]试验发现,当BMECs中精氨酸-鸟氨酸-多胺代谢通路受到抑制后,BMECs的增殖率、细胞中酪蛋白合成受到显著抑制,表明精氨酸-鸟氨酸-多胺可能是调控酪蛋白合成的关键代谢通路。Folley等[23]测定了处于不同泌乳时期大鼠乳腺组织中精氨酸酶活性和乳蛋白含量,分析得出精氨酸酶活性与大鼠乳蛋白合成量存在正相关,且Yip等[24]在精氨酸对小鼠乳腺蛋白质合成的研究中也发现了类似规律。Oka等[25]研究发现,荷斯坦奶牛乳腺组织中精氨酸酶和鸟氨酸脱羧酶活性在泌乳期阶段显著上升,并导致乳腺组织中多胺类物质生成增多,从而促进乳蛋白的合成。本试验结果表明,2.80 mmol/L精氨酸显著上调了BMECs中精氨酸酶和鸟氨酸脱羧酶的活性及其酶的基因相对表达量。此外,与对照组相比,2.80 mmol/L精氨酸显著上调了CSN1S1和CSN3的基因相对表达量,1.40和2.80 mmol/L精氨酸组BMECs中αs1-酪蛋白表达量显著高于对照组和其他精氨酸组,且以2.80 mmol/L精氨酸组BMECs中αs1-酪蛋白表达量最高。这可能一方面是因为此浓度显著提高了BMECs的增殖率,BMECs数量在一定程度上代表着泌乳奶牛的乳汁分泌量及合成乳蛋白的能力;另一方面,本试验发现2.80 mmoL/L精氨酸显著上调了BMECs精氨酸-鸟氨酸-多胺代谢途径中精氨酸酶和鸟氨酸脱羧酶的活性和相应酶的基因相对表达量,从而催化生成多胺类物质(亚精胺、腐胺),而促进蛋白质在体内合成的前体物——多胺类物质[6]。
3.3 精氨酸通过mTOR信号通路对BMECs酪蛋白合成的影响
氨基酸不仅作为乳蛋白合成的原料底物,还可以作为细胞信号物质介导胞内外信息传递、调控细胞内基因转录、蛋白质翻译及蛋白磷酸化修饰等生物学过程,而这些过程可以在生物体内任何一步发生[26]。研究表明,mTOR信号通路是影响乳蛋白合成的关键通路[27]。在氨基酸的影响下,mTOR信号通路可以级联调控下游的2个靶蛋白——S6K1和4EBP1,进而调控乳蛋白合成翻译过程。S6K1可以被多种外源信号刺激,在哺乳动物细胞中发生磷酸化,而被mTOR磷酸化的S6K1活性可以上升近百倍。前人研究发现,mTOR可以直接通过P-S6K(Thr389)位点发生磷酸化或间接改变磷酸酶活性来完成[28]。赵艳丽等[29]向体外培养的BMECs中添加0.39~0.52 mmol/L的蛋氨酸显著提高了mTOR信号通路中mTOR和S6K1的蛋白磷酸化水平,并且在0.52 mmol/L水平下,酪蛋白编码基因CSN1S1、CSN2和CSN3的基因相对表达量也显著提高。王珊珊[30]研究表明,与对照组相比(不添加组氨酸),添加组氨酸(0.15~9.60 mmol/L)的BMECs显著提高了mTOR、4EBP1和S6K1的蛋白磷酸化水平。Zhao等[31]研究表明,将1.8 mmol/L亮氨酸添加到BMECs培养液可以显著提高mTOR、4EBP1和S6K基因相对表达量及蛋白磷酸化水平,同时促进了酪蛋白的合成。Zhang等[32]给荷斯坦奶牛静脉注射精氨酸后,发现其显著提高了奶牛乳中的酪蛋白含量和乳中酪蛋白基因相对表达量。此外,周刚[33]向奶牛阴外动脉注射了556 mg/L精氨酸,与不添加精氨酸组相比,显著提高了奶牛乳腺组织中mTOR、4EBP1和S6K1的基因相对表达量,并且显著提高了奶牛泌乳量及乳蛋白合成率。本试验结果表明,2.80 mmol/L精氨酸组BMECs中AKT、mTOR、S6K1、4EBP1和eIF4E的基因相对表达量最高,且当培养基中精氨酸的浓度为1.40和2.80 mmol/L时,BMECs中S6K蛋白磷酸化水平显著高于对照组和其他精氨酸组;当精氨酸的浓度为2.80和5.60 mmol/L时,BMECs中mTOR蛋白磷酸化水平显著高于对照组和其他精氨酸组,且以2.80 mmol/L精氨酸组BMECs中mTOR蛋白磷酸化水平最高。本试验发现,2.80 mmol/L精氨酸显著上调了BMECs中CSN1S1、CSN3的基因相对表达量和αs1-酪蛋白表达量,这说明mTOR信号通路是参与酪蛋白调控的重要通路,且适宜浓度的精氨酸可能通过mTOR信号通路激活其下游信号分子S6K磷酸化进而调控BMECs酪蛋白的合成。
4 结 论
当精氨酸的浓度为2.80 mmol/L时,显著促进了BMECs的相对增殖率、酪蛋白基因相对表达量及蛋白表达量、mTOR信号通路相关基因相对表达量及蛋白磷酸化水平;当精氨酸的浓度为2.80和5.60 mmol/L时,显著促进了精氨酸酶和鸟氨酸脱羧酶活性及基因相对表达量,以2.80 mmol/L精氨酸组最高。综上所述,当培养基中精氨酸的浓度为2.80 mmol/L时,对BMECs酪蛋白合成的促进效果最佳。
