脂多糖通过诱导NLRP3表达促进膀胱癌细胞侵袭迁移的机制研究
2022-09-01易永祥唐晨野沈瑞林郭晓汤志灵
易永祥 唐晨野 沈瑞林 郭晓 汤志灵
炎症与肿瘤关系密切,目前认为由细菌或病毒感染引起的炎症可能会促进肿瘤发生,同时在肿瘤发展的大多数阶段也可能起着关键作用,包括增殖、血管生成和侵袭转移等[1]。炎症在膀胱癌(bladder cancer,BC)发生和进展过程中同样被认为是一种重要的因素[2],但其内在机制尚未完全阐明。脂多糖(lipopoly‐saccharide,LPS)是革兰阴性杆菌细胞壁的组成成分,是一种致炎因子,其通过作用于配体Toll样受体4(toll-like receptor 4,TLR4)促进细胞内NOD样受体热蛋白结构域相关蛋白3(nucleotide binding oligomeriza‐tion-like receptor family pyrin domain containing 3,NL‐RP3)基因转录,从而发挥生物学活性。本研究通过观察LPS及NLRP3的特异性抑制剂MCC950对BC5637细胞增殖活力、侵袭迁移及相关因子表达的影响,来阐释炎症在BC发展过程中一种潜在的作用机制。
1 材料和方法
1.1 材料 人BC5637细胞购自中国科学院上海细胞库;LPS(LPG-38-01)购自深圳欣博盛生物科技有限公司;MCC950(HY-12815)购自美国 MCE 公司;CCK-8试剂盒(40203ES60)、RT-PCR试剂盒(11202ES08)购自翌圣生物科技(上海)股份有限公司;Transwell侵袭小室(3422)购自美国Corning公司;NLRP3(19771-1-AP)、基质金属蛋白酶-2(matrix metallopeptidase-2,MMP-2)(10373-2-AP)、基质金属蛋白酶-9(matrix metallopeptidase-2,MMP-9)(27306-1-AP)、钙黏蛋白E(E-cadhjerin)(20874-1-AP)、波形蛋白(Vimentin)(10366-1-AP)、GAPDH(10494-1-AP)抗体均购自于美国proteintech公司。
1.2 方法
1.2.1 细胞培养 将冻存的5637细胞于37℃水浴融化后移入EP管,离心后取上清液,加入新鲜RPMI1640完全培养基(含10%FBS),置于5% CO2、37 ℃培养箱中培养,待细胞生长至对数期时,用于后续实验。
1.2.2 实验分组及处理 将生长至对数期的5637细胞按50×104个/孔接种至6孔板中,当细胞贴壁生长且汇聚达到80%时加入不同药物,分为4组,分别为LPS组、MCC950组、LPS/MCC950组及空白对照组。药物浓度为 LPS(100 μg/ml)、MCC950(1 μmol/L),药物作用时间12 h,然后分别提取各组细胞进行实验。
1.2.3 CCK-8实验 将4组细胞分别按5×103个/孔种植在96孔板中,每孔加入90 μl培养基,继续置于5% CO2、37 ℃培养箱中培养,分别于第24、48、72、96 h时采用酶标仪检测选定孔的450 nm处光密度(optical density,OD)值,OD值可反映细胞增殖活力,检测前2 h需加入CCK-8溶液。
1.2.4 Transwell侵袭实验 将Matrigel基质胶提前1 d铺在Transwell小室内,放置于37℃培养箱内待用。收集4组细胞,调整细胞浓度为5×104个/ml,接种100 μl细胞悬液于Transwell小室内,24 h后取出小室并用PBS清洗2遍,加入4%甲醛溶液室温固定20 min,PBS清洗3遍,结晶紫染色5 min,用棉签去除小室内细胞,PBS再次清洗2遍,晾干后采用倒置显微镜随机选择5个视野拍照并计算细胞侵袭数目。相对侵袭率=观察组细胞侵袭数/对照组平均细胞侵袭数×100%。
1.2.5 细胞划痕实验 将4组细胞分别按104个/孔种植于24孔板中,用25 μl的消毒枪头从上至下在24孔板中央做垂直划痕,再用无血清PBS清洗3遍以除去划下的悬浮细胞,分别在划痕后即刻及24 h采用倒置显微镜观察细胞的迁移情况并拍照。应用Image-Pro Plus 6.0软件测量两个时间点细胞未覆盖的面积。划痕愈合率=[1-(24 h的划痕面积/开始的划痕面积)]×100%。
1.2.6 qRT-PCR 按照TRIzol法的相关步骤分别提取4组细胞的总RNA,进行RNA纯度和完整度鉴定并取500 ng进行逆转录,将取得的cDNA用作实时定量PCR的模板。设计并合成MMP-2、E-cadherin、Vimentin、NLRP3及内参照GAPDH的引物序列详见表1。在ABI7500(Applied Biosystems)PCR仪上进行操作,采用RQ=2-ΔΔCt法计算上述基因的相对表达量。

表1 各基因的引物序列
1.2.7 Western blot 使用RIPA裂解液分别提取4组细胞的总蛋白,紫外分光光度计测定蛋白浓度,将蛋白样品与SDS-PAGE蛋白上样缓冲液混合后上样,经过转膜及5%脱脂牛奶+TBST封闭,加入一抗稀释液,4℃杂交过夜,PBS清洗3遍后加入二抗稀释液室温孵育1 h,滴加化学发光液后显影、扫描,对感光胶片条带进行灰度值测定,以目的条带与内参照条带GAPDH的比值代表目的蛋白的相对表达量。
1.3 统计学处理 采用SPSS 20.0统计软件进行数据分析,GraphPad Prism 6.0软件进行统计作图。计量资料以表示,多组间比较采用单因素方差分析,多重比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 LPS和MCC950对5637细胞增殖活力的影响 图1和表2显示,在24、48、72、96 h 4个时间点,4组之间的OD值均不全相同或全不相同,差异有统计学意义;LPS组的OD值均显著高于空白对照组和MCC950组,MCC950组在24、48 h两个时间点的OD值显著低于空白对照组;LPS/MCC950组在4个时间点的OD值均显著低于LPS组。LPS增强5637细胞增殖活力的作用可被MCC950抑制,说明LPS可能通过刺激NLRP3表达来增强5637细胞的增殖活力。

图1 CCK-8实验检测LPS和MCC950对5637细胞增殖的影响

表2 4组细胞各时间点的450 nm OD值比较
2.2 LPS和MCC950对5637细胞侵袭能力的影响 空白对照组、LPS组、MCC950组、LPS/MCC950组的相对侵袭率分别为(100.00±14.43)%、(150.00±8.33)%、(100.00±22.05)%、(111.10±9.62)%,总体上具有统计学差异(F=7.89,P<0.01)。图2显示,LPS组的侵袭率显著高于空白对照组和MCC950组;LPS/MCC950组的侵袭率显著低于LPS组。LPS促进5637细胞侵袭的作用可被MCC950抑制,说明LPS可能通过刺激NLRP3表达来增加5637细胞的侵袭能力。
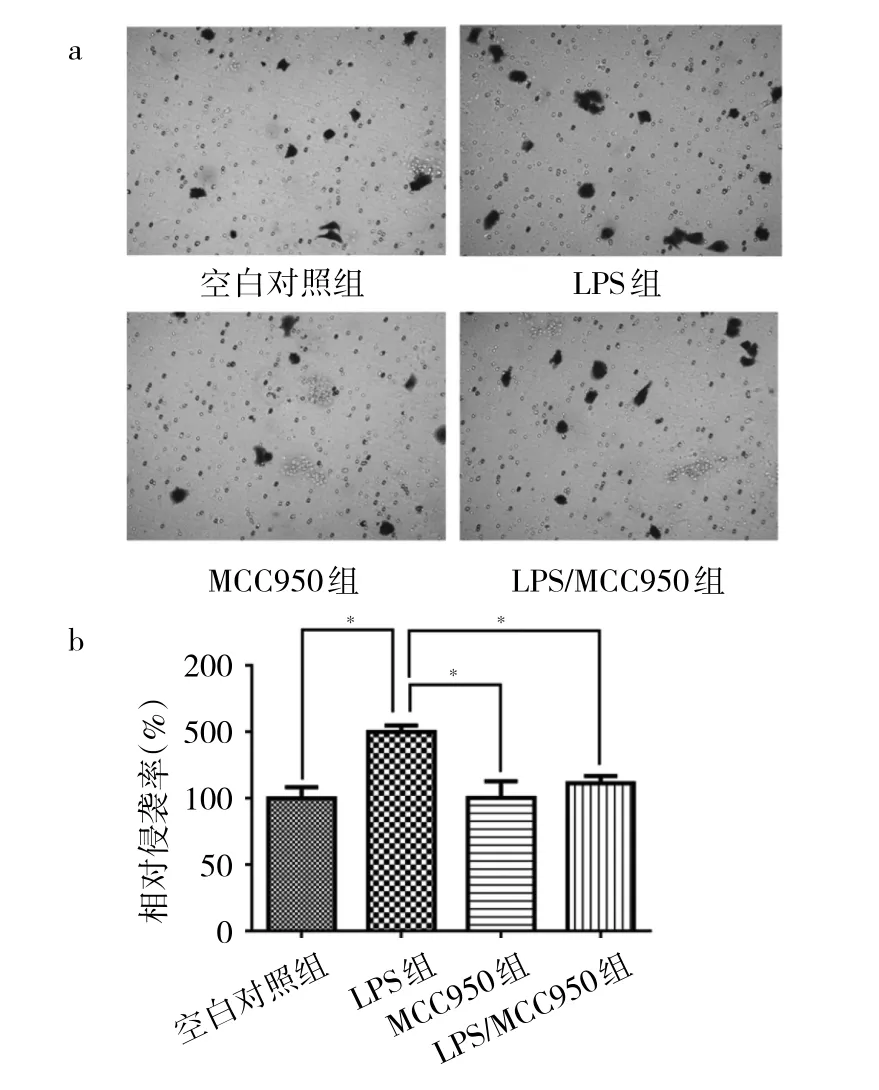
图2 Transwell侵袭实验检测LPS和MCC950对5637细胞侵袭能力的影响(a:结晶紫染色,×10;b:4组间相对侵袭率的两两比较,*P<0.05)
2.3 LPS和MCC950对5637细胞迁移能力的影响 空白对照组、LPS组、MCC950组、LPS/MCC950组的24 h划痕愈合率分别为(50.23±1.95)%、(60.87±1.99)%、(39.82±2.89)%、(48.27±0.64)%,总体上具有统计学差异(F=54.40,P<0.01)。图3显示,LPS组的划痕愈合率显著高于空白对照组和MCC950组;MCC950组的划痕愈合率显著低于空白对照组;LPS/MCC950组的划痕愈合率显著低于LPS组并高于MCC950组。LPS促进5637细胞迁移的作用可被MCC950抑制,说明LPS可能通过刺激NLRP3表达来增加5637细胞的迁移能力。
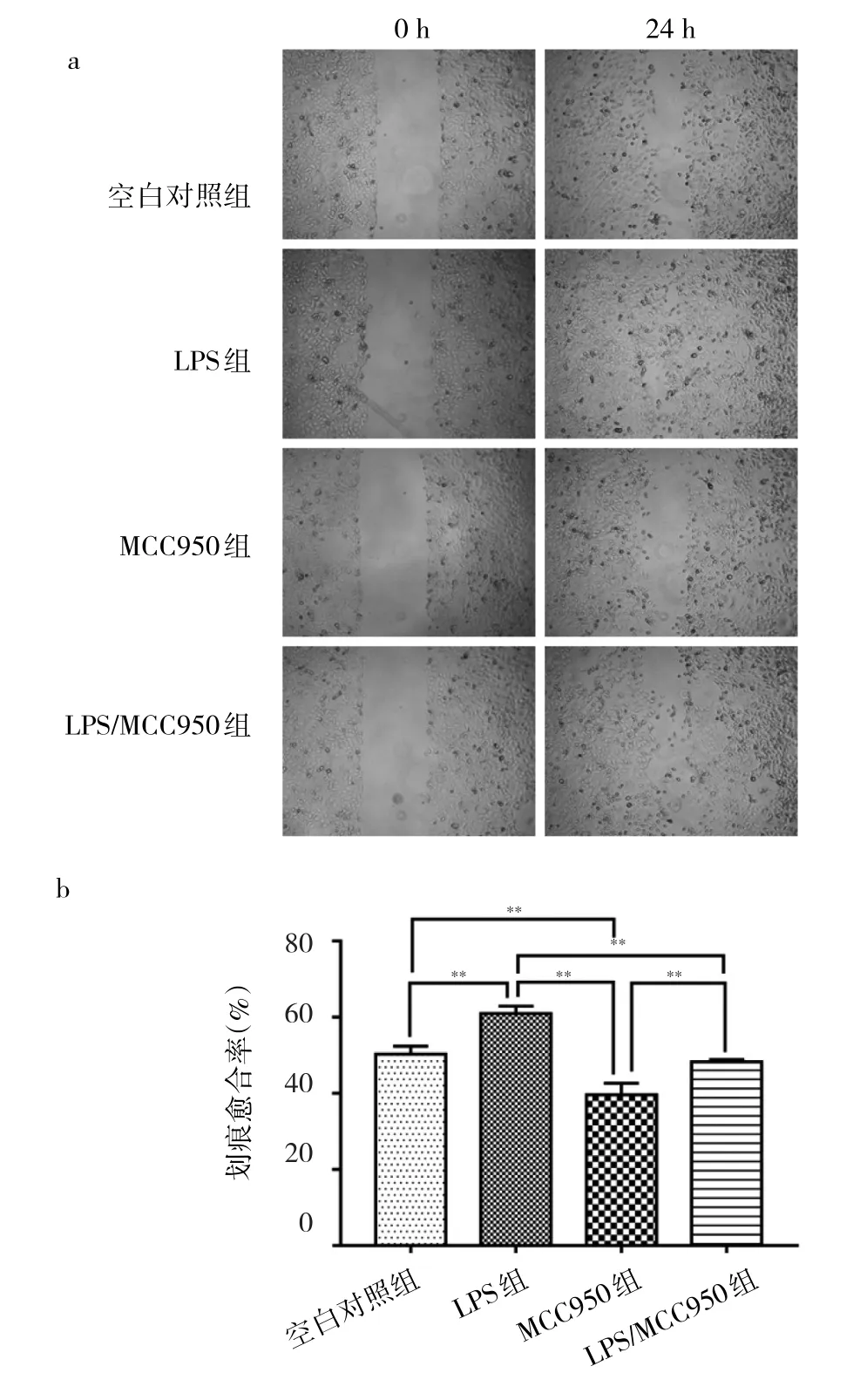
图3 细胞划痕实验检测LPS和MCC950对5637细胞迁移能力的影响(a:细胞划痕图,×4;b:4组间24 h划痕愈合率的比较,**P<0.01)
2.4 LPS和MCC950对5637细胞侵袭迁移、上皮间充质转化(epithelial-mesenchymal transition,EMT)相关因子及NLRP3表达的影响 4组的MMP-2、E-cadherin、Vimentin、NLRP3 mRNA相对表达量均不全相同或全不相同,差异有统计学意义(F=109.80、6.63、133.50和9.67,均P<0.05)。图4显示,LPS组的 MMP-2、Vi‐mentin、NLRP3 mRNA表达量均显著高于空白对照组和MCC950组,E-cadherin mRNA表达量则显著低于空白对照组和MCC950组;MCC950组的MMP-2 mRNA表达量显著低于空白对照组;LPS/MCC950组的MMP-2、Vimentin、NLRP3 mRNA表达量显著低于LPS组,E-cadherin mRNA表达量则显著高于LPS组。4组的MMP-2、MMP-9、E-cadherin、Vimentin、NLRP3蛋白相对表达量均不全相同或全不相同,差异均有统计学意义(F=9.72、41.26、190.60、224.30和38.23,均P<0.05)。图5显示,LPS组的MMP-2、MMP-9、NLRP3蛋白表达量均显著高于对照组和MCC950组,E-cadherin蛋白表达量则显著低于对照组和MCC950组;MCC950组的MMP-2、MMP-9、Vimentin、NLRP3蛋白表达量均显著低于对照组,E-cadherin蛋白表达量则显著高于对照组;LPS/MCC950组的MMP-9、Vimentin、NLRP3蛋白表达量均显著低于LPS组,E-cadherin蛋白表达量则显著高于LPS组。LPS可显著上调5637细胞NLRP3 mRNA和蛋白表达,同时影响侵袭迁移及EMT相关因子的表达,但这些效应均可被MCC950抑制,证实LPS可通过诱导NLRP3表达来促进5637细胞侵袭迁移及EMT。

图4 qRT-PCR检测LPS和MCC950对5637细胞侵袭迁移、EMT相关因子及NLRP3 mRNA表达的影响(*P<0.05,**P<0.01)

图5 Western blot检测LPS和MCC950对5637细胞侵袭迁移、EMT相关蛋白及NLRP3蛋白表达的影响(a:蛋白条带图;b:4组间各蛋白相对表达量的两两比较,*P<0.05,**P<0.01)
3 讨论
LPS可以通过病原相关分子模式(pathogen associ‐ated molecular pattern,PAMP)结合 TLR4/髓样分化蛋白-2复合体触发TLR4信号通路,激活NF-κB,使其组成部分p65出现磷酸化和核易位,进一步触发NLRP3转录并激活NLRP3炎症小体[3-5],也可以通过激活Cas‐pase-11,切割gasdermin D产生氨基末端片段,以细胞固有的方式激活NLRP3炎症小体[6],从而引起炎症反应。LPS可用于构建神经炎、肺炎、脓毒症等炎症模型[7-9],也可用于模拟肿瘤细胞所处的炎症微环境[10-11]。本研究同样采用LPS处理5637细胞以模拟炎症微环境,研究炎症对BC细胞侵袭迁移的影响。
NLRP3蛋白属于NOD样受体(nucleotide-binding oligomerization domain-like receptor,NLR)蛋白家族,由热蛋白结构域(pyrin domain,PYD)、核苷酸结合寡聚化结构域(nucleotide-binding and oligomerization do‐main,NACHT)及富含亮氨酸重复序列(leucine-rich repeats,LRR)3部分组成[12]。NLRP3炎症小体是目前研究最为广泛和深入的炎症小体之一,主要在巨噬细胞、树突状细胞、中性粒细胞等炎症和免疫相关的细胞中表达,也可在多数肿瘤细胞中表达[13],其可介导IL-1β、IL-18等促炎细胞因子分泌,在调节炎症反应和免疫微环境中发挥重要的作用[14]。通过调控NLRP3观察BC细胞侵袭迁移能力的变化可以很好地阐明炎症影响BC进展的一种可能的机制。
本研究表明LPS可显著增强5637细胞的增殖活力,促进其侵袭迁移及EMT,同时本研究也观察到NL‐RP3 mRNA和蛋白表达上调,据此推测在炎症微环境中BC细胞的侵袭及迁移能力增加,而其中NLRP3炎症小体可能发挥着重要的作用。本研究采用MCC950处理5637细胞,发现NLRP3蛋白的表达被显著抑制。MCC950是一种含有二芳基磺酰脲的化合物,可以直接与NLRP3的NACHT结构域内的Walker B基序相互作用,从而阻断ATP水解并抑制NLRP3活化及炎症小体形成,而且对NLRP1、NLRC4、AIM2等其它炎症小体的激活没有影响,因此MCC950被认为是NLRP3的强效特异性抑制剂[15-16]。本研究将MCC950与LPS共同作用于5637细胞,发现MCC950可显著抑制LPS对5637细胞产生的效应,这就证实了LPS可通过诱导NLRP3表达来促进BC细胞侵袭迁移的机制。
近年来,许多研究同样表明NLRP3炎症小体具有促进肿瘤侵袭转移的作用。在结直肠癌中,肿瘤周围组织的巨噬细胞高表达NLRP3,激活NLRP3可增强结直肠癌细胞的体外迁移和体内转移能力[17]。在食管癌中,NLRP3与Ki-67增殖指数呈正相关,过表达NLRP3显著促进肿瘤细胞增殖、侵袭和迁移,而沉默则产生相反效应[18]。在乳腺癌中,NLRP3在高侵袭亚型中表达异常上调,且可以通过Caspase-1依赖的方式诱导IL-1β自分泌以促进EMT和转移[19]。由于NLRP3炎症小体在肿瘤发生、发展过程中的作用逐步得到证实,目前已作为潜在的抗肿瘤治疗靶点受到关注[20]。
综上所述,本研究采用LPS处理BC细胞以模拟炎症微环境,发现LPS可通过诱导NLRP3表达来促进BC细胞侵袭与迁移。NLRP3炎症小体可能是炎症状态下促进BC进展的重要因子。我们还需通过动物实验和进一步的机制研究加以论证。
