c-TCD检查对比剂注射时机对脑血流动力学的影响及卵圆孔未闭患者脑血管反应性研究
2022-09-01孔琦乔松刘小利李雅国赖其伦姜佩依
孔琦 乔松 刘小利 李雅国 赖其伦 姜佩依
心脏右向左分流(right-to-left shunt,RLS)是隐源性卒中、偏头痛等多种疾病的重要原因,其中大部分是由卵圆孔未闭(patent foramen ovale,PFO)导致。临床对PFO有多种检查方法,如经食管超声、右心声学造影和对比增强经颅多普勒超声(contrast-enhanced transcranial Doppler,c-TCD)[1]。其中,c-TCD 因其简单、无创、廉价的优点现已被广泛应用于PFO初筛检查。Valsava动作(Valsava maneuver,VM)能使胸腔压力增加,减少静脉回心血流量,从而使右心充盈,而在VM结束的瞬间,右心房压力高于左心房,会使未闭的卵圆孔开放或者扩张,在c-TCD中结合VM,能够有效增加微泡数量,从而提高检查的阳性率[2-4]。临床共识推荐受检者在行c-TCD检查时,注射对比剂5 s后再行VM[5-6]。然而,临床实践中,关于c-TCD检查时0.9%氯化钠注射液-气体-混血混合液(agitated saline with blood,ASb)注射时机及其与VM的先后关系仍存在争议[7-8],对于不同注射时机对PFO患者脑血管反应性的影响也研究不多。脑血管反应性是一种在一定范围内维持脑血流动力学稳定的过程,其受到脑灌注及动脉压的影响[9-10]。研究发现,出血性及缺血性卒中、脑动脉狭窄患者脑血管反应性明显受损[11-12]。脑血管反应性对PaCO2敏感[10,13],因此临床可选择屏气试验来配合检查,其比CO2吸入试验更简便易行,其屏气指数(breath-holding index,BHI)可用来评估脑血管反应性[13-14]。基于此,本研究旨在分析c-TCD检查中ASb不同注射时机对脑血流动力学的影响,并观察PFO患者的脑血管反应性,现报道如下。
1 对象和方法
1.1 对象 选取2020年3月至2021年8月在浙江医院行c-TCD检查的受检者104例,其中男65例(62.5%),女39例(37.5%);年龄(58.65±13.54)岁。排除标准:颞窗透声欠佳、已诊断出其他RLS原因如肺动静脉瘘等、有明确大动脉狭窄及心源性病因的脑卒中、肺功能不佳患有慢性肺部疾病、认知障碍无法配合检查的受检者。每例受检者均接受3种不同ASb注射时机的检查,即无VM常规注射、VM下呼气前注射和VM下呼气后注射。受检者c-TCD检查结果阳性(3种不同注射时机检查时至少其中1种出现阳性)提示存在RLS。所有阳性组受检者后续均进一步接受经食管超声检查明确存在PFO,余受检者为阴性组。本研究经医院医学伦理委员会批准,批件号:2022临审第(68K)号,受检者均表示了解检查过程并签署知情同意书。
1.2 检查仪器与方法 所有受检者c-TCD检查均使用DWL Doppler—Box型经颅多普勒超声机(德国科尔麦公司),使用2 MHz探头。受检者均仰卧位,监测右侧大脑中动脉血流;均于右手肘静脉留置20 G留置针,用三通管连接1个10 ml注射器和1个20 ml注射器。ASb由9 ml 0.9%氯化钠注射液和1 ml空气以及1滴(0.05 ml左右)受检者鲜血混合而成。
所有受检者接受c-TCD检查。ASb的制备方法是利用三通管及2个注射器,将受检者的1滴鲜血、0.9%氯化钠注射液、空气来回推注混合出均匀一致的微气泡。嘱受试者事先练习传统VM[4-5]:深吸气后紧闭声门10 s做呼气动作。持续10 s以上,监测受检者大脑中动脉血流速度减低30 cm/s以上视为VM有效动作[15-17]。所有受检者均在不同注射时机下先后行3次c-TCD检查:常规推注ASb不实施VM、在VM期间呼气前1 s推注ASb、在VM呼气后1 s紧接推注ASb,每次推注时间5 s。每组c-TCD检查之间至少休息间隔5个心动周期以上以消除上一次试验的影响。而后受检者在充分平卧休息(5 min以上)重新获得稳定的右侧大脑中动脉血流基线后再次接受屏气试验。屏气试验要求受检者平静呼吸后尽力屏气(20 s以上,且需避免深呼吸,即避免VM带来的脑动脉血流速度减低)[13,18-19],记录屏气后峰值流速及屏气时间。
1.3 观察指标 观察受检者注射后25 s之内出现的微泡信号[5,10],微泡信号为深度固定,短促尖锐的高亮信号。将所有受检者3种时机注射试验所得结果由2位经验丰富的医师统计,监测到的微泡信号数量及血流速度取2位医师统计的平均值。有1个微泡信号出现则诊断为阳性,存在RLS。记录3种时机注射的RLS阳性率、微泡信号数量、收缩期血流速度、舒张期血流速度、搏动指数(pulsation index,PI)。受检者屏气试验中平静状态下大脑中动脉收缩期血流速度作为基线,VM屏气过程中血流速度最大值作为峰值,计算所有受检者的BHI。BHI<0.69 视为脑血管反应性受损[10,18]。
1.4 统计学处理 采用SPSS 25.0软件软件。非正态分布的计量资料以M(P25,P75)表示,多组比较采用Kruskal-WallisH检验。计数资料以频数和构成比表示,组间比较采用χ2检验。相关性分析采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 常规注射、呼气前注射、呼气后注射RLS阳性率比较 常规注射RLS阳性15例(14.4%),呼气前注射54例(51.9%),呼气后注射44例(42.3%),呼气前注射RLS阳性率均高于呼气后注射和常规注射(均P<0.05)。
2.2 常规注射、呼气前注射、呼气后注射微泡信号数量、收缩期血流速度、舒张期血流速度、PI比较 呼气前注射微泡信号数量高于呼气后注射和常规注射(P<0.05),而3种时机注射收缩期血流速度、舒张期血流速度、PI比较差异均无统计学意义(均P>0.05)。见表1。
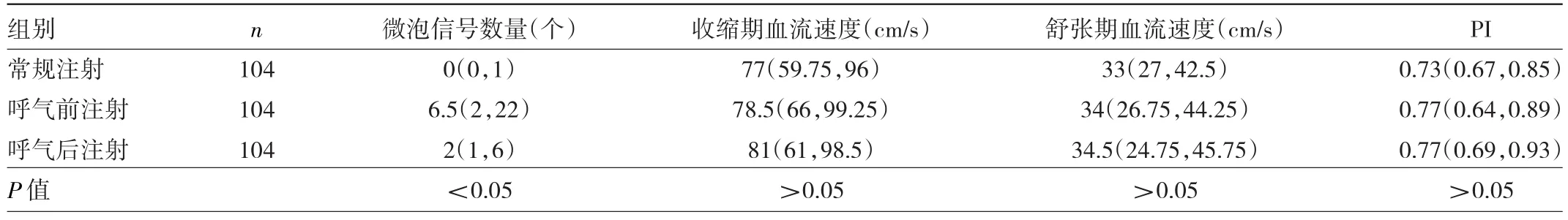
表1 常规注射、呼气前注射、呼气后注射微泡信号数量、收缩期血流速度、舒张期血流速度、PI比较
2.3 呼气后组微泡信号数量与大脑中动脉血流速度、PI的相关性分析 呼气后组微泡数量与收缩期流速、舒张期流速均呈负相关(r=-0.280、-0.328,均P<0.05),而与PI无关(P>0.05)。
2.4 阳性组与阴性组受检者基线情况比较 阳性组与阴性组受检者性别、年龄、个人史、既往疾病史比较差异均无统计学意义(均P>0.05)。见表2。
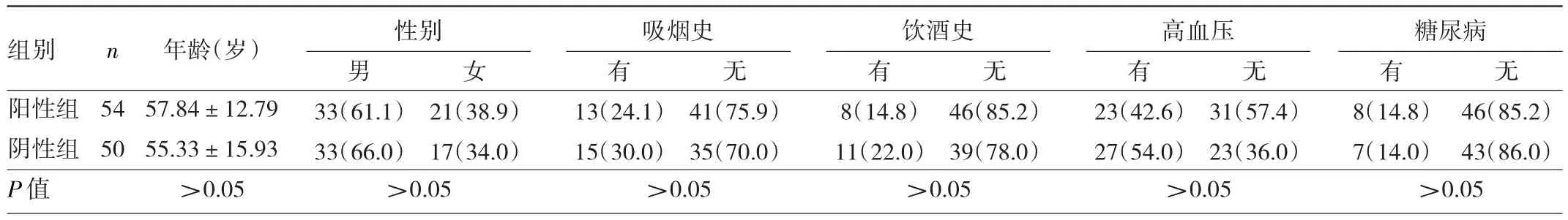
表2 阳性组与阴性组受检者基线情况比较[例(%)]
2.5 阳性组与阴性组受检者基线流速、峰值流速、BHI、脑血管反应性受损情况比较 阳性组与阴性组受检者基线流速、峰值流速比较差异均无统计学意义(均P>0.05);阳性组BHI低于阴性组,脑血管反应性受损比例高于阴性组,差异均有统计学差异(均P<0.05)。见表3。

表3 阳性组与阴性组受检者大脑中动脉基线流速、峰值流速、BHI、脑血管反应性受损情况比较
3 讨论
众所周知,VM能够加大PFO开放程度[2-4],VM能使胸腔压力增加使得除了固有分流类型之外的潜在型分流出现,结合VM可以有效提高c-TCD的阳性率[2,17,20]。VM分为4个阶段[21]。第一阶段,胸内压升高,主动脉压随之升高;第二阶段(应变期)左心室前负荷下降,主动脉压下降,胸内压升高,导致回心血量阻力增大,体循环容积暂时增加,肺动静脉循环血量也相应减少;第三阶段(释放期),胸内压瞬间减低,回心血量迅速增加,右心房压力明显高于左心房,导致未闭的卵圆孔开放到最大[22],主动脉压随着胸内压的释放而进一步下降;第四阶段(恢复期)左心室前负荷、主动脉压恢复。伴有VM的情况下,ASb的注射时机也至关重要,有研究发现,在注射ASb同时进行VM和注射ASb 5 s后进行VM的比较中,发现注射5 s后微泡信号数量明显增多[6,8]。Lange等[7]研究认为在VM前5 s与后5 s注射RLS阳性率没有差异。也有学者认为,在呼气后注射ASb与不伴VM的结果无异[17,23]。
本研究中在VM前、后注射的结果有统计学差异,呼气前注射较呼气后注射RLS阳性率更高,微泡信号数量也更多。这可能是因为呼气前注射时间在于VM第二阶段末期,在呼气前微泡已经体静脉系统到达右心房,此后受试者呼气进入VM释放阶段,卵圆孔在这一瞬间开放到最大,微泡此时进入左心房,继而进入左心室及主动脉中,最后在大脑中动脉中被检测到。相比之下,呼气后注射时间位于VM第三阶段,ASb到达右心房需要(5.1±1.4)s[5,23-24],而刚进入体循环的微泡尚未全部到达右心房,待微泡到达右心房时,右心房压力已恢复,卵圆孔恢复平静呼吸时的大小,因此能通过卵圆孔到达大脑中动脉中被监测到的微泡信号数量也就随之减少。本研究结果显示,VM呼气后注射并非毫无意义,这种方法的检查结果仍较无VM的常规注射阳性率高,只是更推荐在呼气前注射。早期国际共识推荐在VM开始前进行注射能更大地提升微泡信号数量[6,17,23],许多学者认为在注射之后的 5 s嘱受检者做VM并持续5 s,这样能使注射的微泡尽可能更多地聚集在右心房,而伴随着之后VM一起发生右向左分流。而对比于此次研究中使用的VM期间呼气前注射方法,静脉高压似乎会更多地破坏制造的微泡[25]。也有学者认为,无论是在VM之前,还是在VM期间注射,两者在RLS阳性率上没有区别[7]。
VM因胸腔压力升高,肺静脉回流受阻,血流动力学的改变主要发生在左心室,二尖瓣舒张期的血流速度明显下降后恢复[22]。根据VM的四期心脏血流动力学改变,脑血流虽然存在一定时间的延迟,但仍将顺应全身动脉压力的变化呈现先降低后升高的趋势[16,26],而且这种趋势远大于血压本身变化的幅度[20,27]。本研究常规注射脑血流速度作为基线,脑血流在VM第三阶段到最低,在第四阶段因VM的释放获得反应性充血而提升血流速度到达峰值。呼气后注射因时间的推迟,在检测到微泡信号的瞬间流速较呼气前组更高。然而,与笔者预想的不同,更高速的血流并未携带更多微泡,微泡信号数量和血流速度之间呈现负相关关系。这可能是由于:(1)卵圆孔的关闭阻隔了部分来不及到达大脑中动脉的微泡,虽然血流速度升高,但并未携带部分微泡;(2)第三阶段血流量的下降会导致氧合随之下降,脑血流的自身调节能力将提高动脉氧提取来保证氧合的充足[20,27],在这个过程中,可能会造成微泡更多的损耗;(3)VM期间动脉氧合下降也将导致外周阻力升高,也会造成微泡的破坏。因此,笔者推测:c-TCD中微泡信号数量的变化或许能够反向提示脑血管反应性。
BHI能够提示脑血管反应性[19],这点在脑血管狭窄的患者中已经得到证实[6]。而对于隐源性卒中尤其是PFO的患者,脑血管反应性的研究还不甚明确。因此本研究进一步对比观察了阳性组与阴性组患者的BHI,阳性组的BHI明显高于阴性组。这主要是因为PFO介导了低氧血症:当右心房的脱氧静脉血与左心房的含氧动脉血混合后[28],使峰值血流速度减低并影响了脑血管反应性;同时PFO患者更易发生房颤等心脏疾病[29],这种影响将同样作用于全身,PFO患者在发生隐源性卒中时更易发生低灌注缺血。而经过PFO封堵术及其他手段的治疗,受检者在c-TCD中所检测到的微泡信号数量应大幅下降或结果转变为阴性,这或许能提示PFO封堵术后脑血管反应性也将相应得到改善。当然这种推论需要更多治疗前后的对比研究来加以证明。
本研究尚有许多不足,首先是样本量较小,可能导致试验结果不准确。在注射时机的选择上,缺乏与VM前注射的比较,对c-TCD规范检查所能提供的证据不够全面。BHI虽能反应脑血管反应性,但在本研究中缺乏屏气试验与CO2吸入试验的比较。
综上所述,临床行c-TCD检查评估PFO时,不推荐在VM呼气结束后紧接着注射ASb,在VM期间的呼气前注射ASb更能有效地提高检查阳性率以及微泡信号数量。PFO患者的BHI较正常受检者低,可能提示PFO患者的脑血管反应性更易受损。
