新生儿坏死性小肠结肠炎研究进展与展望
2022-09-01朱雪萍钱继红
朱雪萍 钱继红
1.苏州大学附属儿童医院新生儿科(江苏苏州 215008);2.上海交通大学医学院附属新华医院新生儿科(上海 200092)
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是以腹胀、呕吐、便血等为主要临床表现的急性坏死性肠道疾病,其发生与早产、肠黏膜缺氧缺血、感染、肠道菌群失调、不合理喂养、免疫应答异常等多种因素相关。近年来,随着早产儿尤其极低和超低体重儿救治存活率的提高,NEC 的发病也呈逐渐增加的趋势[1],出生体重<1 500 g的NEC患儿病死率约为20.0%~30.0%,而存在肠道广泛坏死者病死率更高[2]。同时,NEC可导致短肠综合征、肠狭窄、生长发育迟缓、神经发育迟滞等并发症,严重影响患儿远期生活质量[3]。尽管国内外学者不断致力于探索NEC的发病机制、诊断标准及治疗手段,但目前对该病的认识仍不足。积极预防、早期识别及规范治疗是减少NEC 发生、提高 NEC患儿存活率及改善其预后的关键。
1 诊断与预测进展及展望
1.1 NEC诊断标准
NEC 早期准确诊断具有一定困难,Bell 分期是目前NEC 诊断及分期的主要标准,由Bell 等[4]结合NEC患儿的全身表现、胃肠道症状及影像学检查制定的诊断标准,将NEC 分为Ⅲ期。Kliegman 等[5]对该标准进行修订,制定了改良“Bell 分期标准”,将每一个分期增加了A、B 两个等级。尽管目前该标准被广泛接受及使用,但该标准缺乏组织病理标准,不能排除如自发性肠穿孔(spontaneous intestinal perforation,SIP)、缺血性肠坏死(ischemic intestinal necrosis,IIN)、食物蛋白诱导的小肠结肠炎综合征(food protein-induced enterocolitis syndrome,FPIES),以及其他类似于NEC临床表现,而非NEC病理改变的肠道疾病[6]。
除Bell 分期外,部分地区及国家还有佛蒙特-牛津网络(Vermont Oxford network,VON)定义、美国疾病控制与预防中心(Centers for Disease Control and Prevention,CDC)定义、英国的NEC胎龄特异性(gestational age-specific case definition of NEC)定义、三选二规则(two out of 3 rule)、斯坦福NEC 评分(Stanford NEC score)、国际新生儿协会(International Neonatal Conference,INC)NEC工作组定义等多种版本的NEC诊断标准[7]。但这些标准及定义存在主观性较强、缺乏大样本及多中心临床研究的验证等局限性,因此也均不能作为NEC 诊断的最佳标准。包括Bell分期在内的上述标准均纳入了肠壁积气和门静脉积气作为评估指标,但这两种表现均发生在疾病晚期,并且受到观察者临床经验和主观偏倚的影响。制定一个特异性、灵敏性及可行性均较优的定义用于NEC 诊断是目前NEC 临床诊疗及研究所面临的巨大挑战,结合各种生物标志物用于NEC的早期诊断近年来备受关注。
1.2 影像学对NEC诊断与病情评估的价值
腹部平片是诊断NEC的经典影像学检查,常表现为肠襻扩张、肠壁水肿、肠间壁积气以及门静脉积气。但腹部平片检查为非特异性,且不能动态监测肠道的功能及状态,对肠穿孔前期敏感性较差,有一定滞后性,可能导致更高的重症率和病死率。近年来,肠道超声(bowel ultrasound,BUS)因具有无辐射、易于床旁操作、高分辨率以及可动态检测的特点,在NEC 的诊断上逐渐受到重视及应用[8]。BUS可用于监测肠道蠕动功能、肠壁厚薄、肠壁血运、有无异常积气以及积气的严重程度等[9],且在门静脉积气检测方面明显优于腹部平片[10]。
1.3 早期预测NEC的生物标志物
NEC 发病急、进展快,早诊断、早治疗对提高NEC 患儿生存率和远期预后极为重要。如上所述,目前NEC 的诊断主要是依靠临床症状及影像学检查,具有一定局限性。研究者尝试通过血常规指标、急性炎症标志物和免疫学指标等早期预测及诊断NEC,但效果不甚理想[11]。近年来,随着转录组学、代谢组学、蛋白组学领域的不断发展,在 NEC领域开展了相关的研究和尝试。
miRNA与特定的靶mRNA结合以调控基因的表达[12]。基于NIHGEO数据库中关于NEC的miRNA芯片所进行的大规模荟萃分析显示,miRNA-429、miRNA-200 a、miRNA-200 b 和miRNA-141、miRNA-200c集群的低表达在NEC的发生发展中起重要作用[12]。长链非编码RNA(lncRNAs)可以调节肠道上皮细胞的平衡及参与肠道黏膜的生长[13]。一项使用高通量测序技术(NGS)对NEC 患儿病变和邻近肠道组织中的lncRNA 和mRNA 表达谱所进行的检测发现,两者共有4 202 个lncRNAs的表达存在显著差异,进一步通过共表达分析发现,包括lncRNA ENST 00000623580、lncRNA NONHSAT180418.1、lncRNA NONHSAT125636.2和NONHSAT 087855.2 在内的lncRNA 可能通过lncRNA-mRNA网络相互作用介导NEC的发生和发展[14]。虽然目前关于NEC的lncRNAs的研究有限,但miRNAs和lncRNAs有潜力成为早期预测NEC的生物标志物及干预治疗靶标。
蛋白组学通过使用液相色谱-质谱(LC-MS)对研究对象在特定时间及空间下的蛋白质进行检测,对于疾病生物标志物的研究有着重要意义[15]。有研究通过蛋白组学对NEC相关蛋白进行探索发现,包括C 反应蛋白(CRP)、巨噬细胞迁移抑制蛋白(macrophage migration inhibitory protein,MMIP )在内的多种蛋白和NEC发生相关,但均为非特异性[16]。代谢组学使用质子核磁共振波谱(1H NMRS)、LC-MS和气相色谱-质谱(GC-MS)对生物标本中的小分子化合物进行分析检测,获得完整的代谢图谱[15]。Thomaidou 等[17]利用非靶向1H NMRS 联合靶向LC-MS检测NEC患儿尿液代谢物发现,包括氨基酸、有机酸、糖类和维生素在内的25种代谢物和NEC发生相关,其中14种代谢物对NEC有很好的诊断性能。组学研究为早期预测NEC提供了新方向,目前相关研究大多为单中心,且病例数较少,存在较多偏倚和缺陷,但这些研究均提示,预测NEC 的发生、发展、分期和治疗靠单独的一种生物标志物难以实现,组学研究与临床数据的结合使得建立完善精准的NEC预测体系成为可能。NEC研究要取得突破性进展需要国家层面的多中心合作或国际合作,确保研究的高度权威性和同质性;另外,临床研究的经费、人力和时间投入也是一个亟需解决的问题。
2 预防进展及展望
2.1 产前预防
早产是发生NEC的独立高危因素,避免发生早产至关重要。同时,产前应用糖皮质激素、延迟脐带结扎对NEC的发生有一定预防作用[18-19]。但在围生期的标准化管理中,尚未提出可用于降低NEC发生的保护措施,目前除预防早产外的相关保护因素仅在小样本、单中心的临床研究中得到证实,缺乏强有力的循证医学支撑。
2.2 产后预防
母乳含有丰富的免疫活性物质和各种有益因子,对新生儿尤其是早产儿发育不成熟的肠道有很好的保护和促进成熟作用。目前多数研究均证实,母乳喂养对于NEC有明显预防作用[20]。但大多早产儿或极低出生体重儿的母亲往往会缺乏母乳,不能满足患儿的母乳正常供应,尽管近年来母乳库的建立能满足部分小胎龄早产儿的母乳供应,但在保存以及巴氏消毒过程中可能会导致母乳中的活性成分被破坏,这是当下亟需被解决的问题之一。目前开展了较多关于母乳活性成分对NEC 预防相关的研究,但均处于临床前研究阶段,广泛应用于临床仍需时间。
维持肠道正常微生物群落的稳态对NEC发生有预防作用,出生后早期抗生素和H2受体阻滞剂的应用对肠道微生物群落及稳态的破坏会间接导致NEC发生风险的增加[21]。近年来,使用肠道微生态制剂调节肠道微生物群落及预防NEC备受推崇,尽管有大量研究表明使用益生菌对肠道微生物群落和稳态有明显改善和保护作用,但目前并没有一项益生菌被指定或推荐用于预防NEC,需要制定适用于新生儿需求的益生菌使用和管理方法,进行严格的药物临床试验,推荐合理的使用指征、剂量和时间,保证益生菌应用的有效性和安全性。
3 治疗进展及展望
临床上,一旦怀疑NEC需立即开始干预及治疗,禁食、胃肠减压、抗感染、肠外营养、维持内环境稳定以及必要的高级生命支持等是目前治疗NEC的主要方法。其中,禁食时间取决于NEC的严重程度,Ⅰ期NEC 禁食48~72 小时,Ⅱ期禁食7 天,Ⅲ期禁食10~14天,随着患儿临床情况的改善,可以开始肠内营养并逐渐加量[22]。在培养结果回示前,应当尽早应用能够覆盖革兰阴性菌和厌氧菌的广谱抗生素,对于重症和抗生素治疗无效患儿,应当考虑联合抗真菌药物[23]。Ⅰ期NEC 患儿病情控制后可选择在48~72 小时后停止使用抗生素并恢复喂养,对于Ⅱ期及以上的患儿,即使培养结果为阴性,也要抗感染治疗10~14 天[22]。在内科保守治疗期间,需行连续的体格检查、实验室检查和影像学检查监测患儿病情是否改善或恶化,对于内科保守治疗无效,病情不断进展的患儿应尽早行手术治疗(图1)。手术治疗的主要目的是减少严重败血症及全身脏器衰竭的风险,尽可能保留患儿肠道的长度,预防短肠综合征的发生[24]。NEC 手术干预的绝对指征是发生肠穿孔,影像学表现为腹腔积气;在未发生肠穿孔的情况下,经过积极内科治疗,患儿临床症状、实验室检查和影像学检查持续加重也是需要进行手术干预的指征;而NEC 后肠狭窄是NEC 患儿后期进行手术的重要原因,需要外科治疗的NEC 患儿病死率更高,并易伴有包括短肠综合征、生长发育迟缓和神经发育障碍在内的远期并发症[24]。由于NEC危害性较大,对出现腹胀、喂养不耐受等非特异性疑似该病表现的新生儿常在未明确诊断之前禁食,会导致因肠道缺乏底物刺激而延缓肠道发育成熟,最终可能增加这部分新生儿发生NEC 的风险。同样,抗生素滥用也会促使新生儿肠道菌群紊乱,增加NEC的发生风险。因此,临床上对未确诊但疑似NEC的患儿禁食或抗感染与否尚存在争议,制定严格的诊断标准,提高临床医师诊疗水平,严格把控治疗指征是解决这一现象的关键。
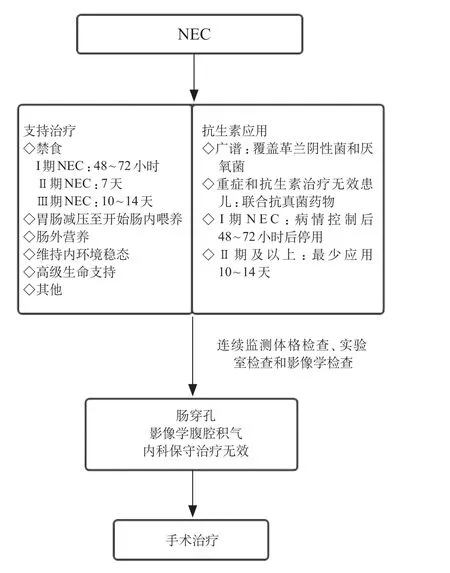
图1 NEC 的治疗
3.1 干细胞用于NEC治疗
干细胞被定义为拥有自我更新和转化为多种成熟细胞类型能力的非特异性细胞[25]。肠道上皮细胞在受到缺血、缺氧和低温等应激因素损害时,肠道干细胞(intestinal stem cells,ISCs)可促进受到应激损害的肠道上皮细胞的修复和再生[26]。除了再生和替代的基本能力外,干细胞还可以分泌多种旁分泌因子,发挥包括抗炎、抗凋亡、促进增殖和迁徙等生物效应[27]。有动物模型研究发现,间充质干细胞(mesenchymal stem cells,MSCs)和神经干细胞以及干细胞源性的外泌体均可降低NEC 的发生率[28]。然而,目前多数研究尚处于临床前研究阶段,如何制定合理的研究标准和推广临床转化,是目前亟需解决的问题。关于MSCs,目前研究较多的包括骨髓源性、羊水源性和脐带源性。骨髓源性MSCs 源自骨髓,能够分化成多种细胞类型,主要通过旁分泌机制植入损伤组织并促进组织修复,在模拟NEC 缺氧条件下,骨髓源性MSCs 可分泌IL-6、血管内皮生长因子(VEGF)和肝细胞生长因子(HGF),从而提高肠道细胞的活力和增殖[29],动物实验证实其能改善肠道屏障功能,降低NEC 的发生率[30-31]。但有研究发现,骨髓源MSCs 主要参与免疫调节,羊水源性MSCs 主要参与细胞的发育和生长[32]。而脐带源性MSCs 免疫原性较低,对肠道损伤保护作用更强[33]。神经干细胞(neural stem cells,NSCs)可以修复并更新肠神经系统(enteric neural system,ENS)源的神经元,近年来NSCs 在各种肠道疾病研究中备受关注[34]。研究发现,使用NSCs 注射液治疗的NEC 大鼠幼崽肠道神经系统的完整性、干细胞的分化及其生存率均显著高于对照组[35]。
越来越多的临床前研究证实干细胞对NEC有显著改善作用,但干细胞应用于临床依旧存在一些问题需要解决:①干细胞获取和培养工艺需要进一步优化;②干细胞的获取和临床应用缺乏完备的伦理准则;③干细胞改善NEC的具体作用机制;④干细胞具有免疫原性,其应用于临床治疗NEC的安全性和效益性。
3.2 外泌体用于NEC治疗
外泌体是由多泡体和质膜融合形成的较小囊泡,不同类型细胞分泌的外泌体通过与靶细胞膜上的受体相互作用影响细胞信号转导[36]。目前有些试验已经证实了外泌体对NEC治疗的有效性,但尚未在临床中应用。干细胞源性外泌体(stem cell-derived exosomes,SC-Exs)作为干细胞分泌的生物活性因子,对预防NEC 有很好的保护效果,可保持肠道屏障的完整性,降低NEC 的发生率和严重程度[37]。母乳中富含母乳源性的外泌体(human breast milkderived exosome,HM-Ex),从母乳中提取外泌体更安全且经济。相关研究表明,HM-Ex 可以修复肠道上皮紧密连接蛋白,减少肠上皮细胞的损伤和坏死,显著降低NEC的发生风险[38-39]。
动物模型及相关研究发现,外泌体对NEC的治疗具有显著作用,但目前依旧存在一些问题需要解决:①母乳经过巴氏消毒后外泌体的活性是否受到影响;②外泌体的分离和提纯工艺需要进一步研究和改善;③外泌体改善NEC的具体机制尚未完全明确;④目前其功效仅在临床前研究被证实,进入临床应用的安全性、有效性仍有待进一步研究。
NEC 是新生儿严重疾病,是导致早产儿死亡的重要原因之一。随着新的诊断技术和检测指标的不断出现,对NEC的认识水平不断提高。积极预防、早期识别及规范治疗是减少NEC发生、提高NEC患儿存活率及改善其预后的关键。目前NEC治疗方面出现了较多新兴方案,有可能从根本上改善NEC的发生、发展及预后,但其具体作用机制尚不清楚,安全性和临床有效性有待证实,这将是今后的重点研究方向之一。
