Tiam1过表达调控喉癌生长及侵袭转移的体内外实验研究
2022-09-01王爽杨新明魏明辉朱伟谕
王爽,杨新明,魏明辉,朱伟谕
(1.中南大学湘雅二医院 耳鼻咽喉头颈外科,湖南 长沙 410011;2.国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院深圳医院 头颈外科,广东 深圳 518116)
喉癌是世界上最常见的肿瘤之一,约占所有肿瘤的6%。在全世界范围内,喉癌平均每年新增病例超过500 000例,每年新增死亡人数超过200 000例[1-2]。尽管喉癌在手术、放疗及化疗等方面的研究有大量的进展,但是喉癌患者的长期预后仍然不理想。肿瘤的局部复发、淋巴结转移和远处转移是影响喉癌患者预后的主要原因[3-4]。肿瘤的恶性生物学行为需要多种特异性蛋白的激活以及失活,而这些特异性蛋白的表达和功能方面的调节就有可能会阻止肿瘤细胞的恶性生物学行为。因此,寻找与肿瘤复发及转移密切相关的蛋白,从而采取有效的干预或预防措施是目前喉癌基础研究中的热点。
T淋巴瘤侵袭转移诱导因子1(T lymphoma invasion and metastasis inducing factor 1,Tiam1)是1994年由Habets等采用前病毒插入致突变的原理,由BW5147小鼠的T淋巴瘤细胞高侵袭变异株中分离鉴定而得到的[5]。Tiam1在人类多种恶性肿瘤中呈高表达状态,而且与恶性肿瘤细胞的侵袭、转移等特性密切相关[6-10]。有关Tiam1在头颈肿瘤中的表达,相关研究主要集中于鼻咽癌方面,还有少许在口腔癌及甲状腺癌中的研究,而在喉癌及下咽癌中则报道甚少[11-13]。我们前期在喉癌组织水平的研究结果已表明Tiam1的表达与喉癌患者的淋巴结转移、临床分期、组织病理学分级以及肿瘤的复发等临床病理特征密切相关[14-15]。这些结果均提示Tiam1可能在喉癌的发生、发展中发挥了重要的作用。因此,本研究通过构建过表达Tiam1的人喉癌细胞株,观察Tiam1过表达前后细胞生物学行为的改变,从体外细胞及动物体内水平来阐明Tiam1的过表达对喉癌细胞生长,迁移及侵袭能力的影响,为进一步探讨Tiam1在喉癌中的作用机制打下基础。
1 材料与方法
1.1 质粒、主要试剂及仪器
以pcDNA3为载体的Tiam1/C1199质粒(氨苄抗性)由John Collard (the Netherlands Cancer Institute)惠赠。Tiam1兔抗人多克隆抗体(美国Santa cruz公司),β-actin小鼠抗人单克隆抗体(上海碧云天有限公司),辣根酶标记山羊抗小鼠IgG、辣根酶标记山羊抗兔IgG、兔二步法免疫组化检测试剂盒(北京中杉金桥有限公司),G418(美国Amresco公司),LipofectamineTM2000(美国Invitrogen公司),Transwell小室(美国Corning公司),Matrigel基质胶(美国BD公司),Elx800酶标仪(美国Thermo Fisher Scientific公司)。
1.2 细胞转染及稳定细胞株的筛选
Hep-2细胞(购自中国科学院上海生命科学研究院细胞资源中心)置于37 ℃、5%CO2及饱和湿度的条件下,用含有10%的胎牛血清、100 U/mL链霉素和100 U/mL青霉素的完全培养基进行常规培养。Tiam1/C1199质粒经常规的转化、抽提及鉴定。将Hep-2细胞接种于6孔板中,每孔3×105个细胞,待细胞融合率在50%~70%时,将7 μg质粒DNA与 10 μL LipofectamineTM2000形成复合物,培养6~8 h后更换完全培养基。继续培养48 h后加入含G418(终浓度为800 μg/mL)的培养液,持续筛选约2周,可见阳性细胞克隆出现。将细胞克隆接种于96孔板中,扩增培养(G418使用维持浓度400 μg/mL)获得稳定转染的细胞株。Western blot验证转染后Hep-2细胞中Tiam1蛋白的上调效果。本实验以pcDNA3(Mock)质粒作为转染对照。实验共分3组:①空白对照组(Hep-2);②转染pcDNA3(Mock)的Hep-2细胞株(Hep-2/Mock);③稳定转染Tiam1基因的Hep-2细胞株(Hep-2/Tiam1)。
1.3 Western blot
收集处于对数生长期的细胞或裸鼠移植瘤组织,加入细胞裂解液行总蛋白提取。然后按照BCA蛋白浓度测定试剂盒的说明书进行蛋白浓度的测定。取40 μg蛋白变性处理后在8%的SDS-PAGE中进行电泳。蛋白电泳后转膜至PVDF膜。加入相应的抗体(Tiam1按1∶100稀释,β-actin按1∶1 000稀释)后置于4 ℃冰箱中过夜。次日在PVDF膜中再加入相应的二抗(山羊抗兔IgG按1∶1 000稀释,山羊抗小鼠IgG按1∶5 000稀释),室温下孵育2 h。PVDF膜稍干后滴加DAB显色液,PVDF膜显色后扫描记录。以β-actin作为内参照,采用Quantity One凝胶成像分析系统对条带进行半定量灰度分析。实验重复3次,结果取平均灰度值。
1.4 MTT实验检测细胞的增殖能力
以每孔5×103个处于对数生长期的细胞接种于96孔板中,每孔体积200 μL,每组细胞设6个副孔,同时设空白对照。然后每隔24 h,连续3 d用MTT法检测各组细胞的生长情况。到时间点时,每孔加入5 mg/mL的MTT溶液20 μL,继续培养4 h后,吸弃孔中培养基后,每孔加入DMSO 150 μL。Wellscan MK 2洗板机上振荡使结晶物充分溶解,以空白对照孔调零,在酶联免疫检测仪570 nm处测量各孔的吸光度值(OD值)。实验重复3次,结果取平均值,以相对应的OD值表示细胞增殖能力的大小,绘制生长曲线。
1.5 细胞划痕实验
将处于对数生长期的细胞接种于预铺有纤连蛋白的6孔板中,每组细胞设2个副孔,每孔5×105个细胞,37 ℃、5% CO2条件下培养过夜,之后换无血清培养基,继续培养24 h。待细胞长至约90%融合时,用10 μL的Tip头比着直尺垂直划出1条无细胞的细痕,PBS溶液洗去脱落的细胞,加入无血清培养基继续培养。分别于划痕后0、48 h观察细胞划痕处的愈合情况并拍照。实验重复3次,结果取平均值。
1.6 Transwell小室侵袭实验
取100 μL稀释的Matrigel胶(3.9 μg/uL)置于孔径为8 μm的Transwell上室的聚碳酸脂膜上,使膜上所有的微孔均被Matrigel胶覆盖。在Transwell上室加入2 mL无血清培养基的细胞悬液(细胞密度为5×104个/mL),下室加入1 mL含10%胎牛血清的完全培养基。37 ℃、5% CO2条件下培养24 h后,取出Transwell小室,棉签擦尽上室面的Matrigel胶和未穿透膜的细胞,下室用95%乙醇固定后,苏木素染色,倒置显微镜下随机取5个高倍镜视野观察、计数并拍照。计数小室下室的细胞数即为穿透Matrigel胶的细胞数,取平均数作为实验结果,以该细胞数代表肿瘤细胞的侵袭力。实验重复3次,每组细胞设3个副孔。
1.7 人喉癌裸鼠移植瘤动物模型的建立
4周龄SPF级雄性BALB/C裸鼠(约20 g/只)购自中国科学院上海实验动物中心。调整对数生长期的细胞浓度为2.0×107个/mL。将各组细胞以8.0×106个(0.4 mL PBS细胞悬液)细胞/只接种于每只裸鼠右侧腋下。实验动物分Hep-2组7只,Hep-2/Mock组7只,Hep-2/Tiam1组6只。每隔3 d用游标卡尺测量其右侧腋下原位肿瘤的长径(a)与短径(b),按公式π/6×(a×b2)计算原位肿瘤的近似体积。接种25 d后,断颈处死裸鼠,剥离原位肿瘤、双侧淋巴结及肝肺组织。测得原位肿瘤的重量。组织固定后石蜡包埋行连续组织切片,以明确移植瘤形成及淋巴结、肝肺转移情况。另一部分原位肿瘤用于后续组织蛋白的提取。
1.8 免疫组织化学染色
应用兔二步法免疫组化检测试剂盒进行操作。石蜡切片脱蜡、水化及进行抗原修复后,滴加3% H2O2溶液置于37 ℃恒温箱中孵育,加入兔抗人Tiam1多克隆抗体(用PBS液按1∶50稀释)后,4 ℃冰箱中孵育过夜,次日滴加山羊抗兔IgG抗体-HRP多聚体,孵育后滴加DAB显色溶液,显微镜下控制显色时间,以阳性细胞着色而背景不着色为准,苏木素复染,蒸馏水冲洗,自来水返蓝,1%盐酸乙醇分化;上行梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.9 统计学方法
2 结果
2.1 Tiam1基因稳定过表达的喉癌Hep-2细胞株的建立
Hep-2细胞转染Tiam1/C1199质粒后G418持续筛选约2周,可见阳性细胞克隆出现,随机挑取3个转染Tiam1/C1199质粒的单克隆(分别命名为T1、T2、T3)和1个转染空载体的单克隆(命名为C/M)扩增培养。Western blot进行单克隆鉴定,其结果显示3个Tiam1过表达的转染克隆细胞(T1、T2、T3)的Tiam1蛋白表达水平均有不同程度的增高,而与转染空载体的克隆细胞(C/M)及未转染细胞(Hep-2)相比较,差异具有统计学意义(F=31.298,P<0.01);而且T1克隆的Tiam1蛋白表达量最高(图1)。因此,可以认为Tiam1基因已经稳定转染到Hep-2细胞中,并且我们选取Tiam1过表达效率最高的T1克隆细胞进行后续的体内外功能实验。
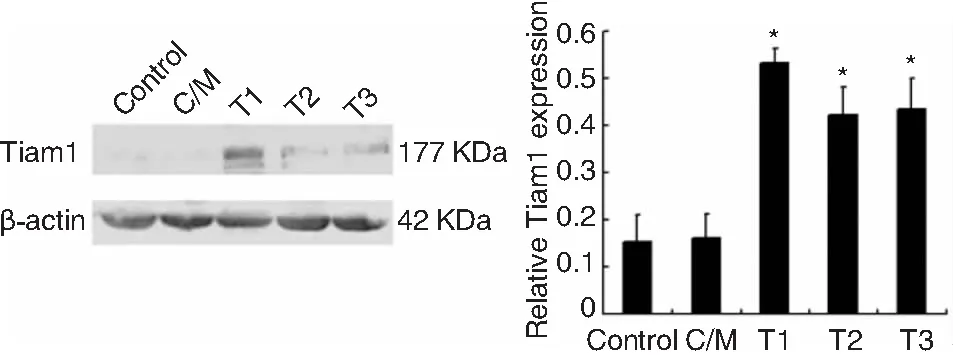
图1 Western blot检测Tiam1在蛋白水平的上调效果,Tiam1/C1199质粒转染Hep-2细胞株使Tiam1基因过表达 注:*P<0.001,T1、T2、T3 vs Control,Control代表未转染的Hep-2细胞;C/M代表转染空载体的单克隆;T1、T2、T3代表3个转染Tiam/C1199质粒的单克隆。
2.2 Tiam1过表达对Hep-2细胞体外增殖能力的影响
为了验证Tiam1对Hep-2细胞体外增殖能力的影响,采用MTT法检测了Hep-2细胞的生长情况。以OD值为纵坐标,各时间点为横坐标绘制生长曲线(图2)。通过连续3d的比较,发现Hep-2、Hep-2/Mock及Hep-2/Tiam1 3组细胞之间的增殖能力无明显统计学差异(P均>0.05)。该结果提示Tiam1基因过表达后对Hep-2细胞的体外增殖能力无明显影响。

图2 MTT法检测Hep-2、Hep-2/Mock及Hep-2/Tiam1细胞的体外增殖情况,结果显示Tiam1过表达后对Hep-2细胞的体外增殖能力无明显影响
2.3 Tiam1过表达后对Hep-2细胞的体外迁移及侵袭能力的影响
通过划痕实验观察细胞迁移能力的改变,结果发现划痕48 h后Hep-2/Tiam1组细胞体外划痕后的迁移距离与对照组Hep-2和Hep-2/Mock组相比明显增加(147.00±26.06 vs 83.33±23.18,96.33±16.01),差异具有统计学意义(F=6.916,P<0.05),而Hep-2与Hep-2/Mock组间差异不明显(图3)。之后进一步采用Transwell侵袭实验比较各组细胞侵袭能力的变化,结果发现24 h后Hep-2/Tiam1组细胞穿过Transwell小室聚碳酸酯膜的细胞数较对照组Hep-2和Hep-2/Mock组明显增多(68.33±6.66 vs 43.00±8.89,45.00±7.55)(F=9.900,P<0.05),而Hep-2与Hep-2/Mock组间差异不明显(图4)。上述结果证实Tiam1基因过表达后能增强Hep-2细胞的体外迁移及侵袭能力。

图3 Tiam1过表达后对喉癌细胞株Hep-2细胞体外迁移能力的影响 A:划痕实验结果显示Tiam1过表达后Hep-2细胞的体外迁移愈合能力明显增加 (× 100);B:各组细胞体外迁移距离的柱状统计图 注:*P<0.05,Hep-2/Tiam1 vs Hep-2,Hep-2/Mock。
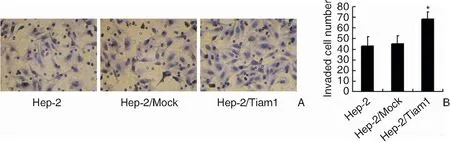
图4 Transwell侵袭实验结果显示Tiam1过表达后对喉癌细胞株Hep-2细胞体外侵袭能力的影响 A:Tiam1过表达后Hep-2细胞穿过Transwell聚碳酸酯膜的数量明显增加 (苏木素 ×200);B:各组细胞体外侵袭细胞数的柱状统计图 注:*P<0.05,Hep-2/Tiam1 vs Hep-2,Hep-2/Mock。
2.4 免疫组织化学及Western blot检测移植瘤标本中Tiam1的表达水平
所有裸鼠原位肿瘤剥离石蜡包埋切片后,常规HE染色均可见细胞核增大,核仁深染,细胞异型性非常明显,符合Hep-2细胞移植瘤的特点,这说明我们成功构建了喉癌Hep-2细胞株的移植瘤动物模型。所有裸鼠原位肿瘤行免疫组织化学染色技术发现Hep-2/Tiam1细胞移植瘤中Tiam1的染色强度明显强于Hep-2及Hep-2/Mock组。Western blot检测显示Hep-2/Tiam1细胞移植瘤中Tiam1的表达水平明显高于Hep-2及Hep-2/Mock组(P<0.05)。见图5。

图5 免疫组织化学染色及Western blot检测3组移植瘤标本中Tiam1的表达 A:Hep-2细胞接种后移植瘤 (HE ×200);B:3组移植瘤中Tiam1的表达情况 (免疫组化 ×200);C:Western blot检测3组移植瘤中Tiam1的表达情况 注:*P<0.05,Hep-2/Tiam1 vs Hep-2,Hep-2/Mock。
2.5 Tiam1基因过表达对喉癌细胞体内生长能力的影响
所有接种Hep-2细胞的裸鼠在第25天处死时,右侧腋下均可见明显的移植瘤,成瘤率达100%。根据所测得的移植瘤长短径,计算出移植瘤体积,从而得到3组细胞移植瘤体积生长曲线。Hep-2、Hep-2/Mock及Hep-2/Tiam1组细胞最终的移植瘤体积分别为(639.661±319.257、705.647±397.460及548.836±325.978)mm3/只,方差分析结果显示3组细胞的最终移植瘤体积并无统计学差异(F=0.324,P>0.05)。Hep-2、Hep-2/Mock及Hep-2/Tiam1 3组细胞的移植瘤重量分别为(0.650±0.366、0.775±0.453及0.566±0.274)g/只,方差分析结果亦显示3组细胞移植瘤重量无统计学差异(F=0.511,P>0.05)。以上结果均提示Tiam1基因过表达后对喉癌Hep-2细胞接种后的移植瘤体内生长无明显影响。见图6。

图6 Tiam1基因过表达后对喉癌Hep-2细胞株在裸鼠体内生长的影响 A:Hep-2细胞接种后第25天裸鼠处死时的图片;B:移植瘤的体积生长曲线;C:右侧腋下原位移植瘤图片;D:各组移植瘤重量的比较 注:P均>0.05。
2.6 Tiam1基因过表达对喉癌细胞体内淋巴结转移能力的影响
Hep-2细胞组7只裸鼠中共2只双侧、2只单侧(共计6个淋巴结,转移率为 42.9%)可见淋巴结微转移灶;Hep-2/Mock细胞组7只裸鼠中共1只双侧、3只单侧(共计5个淋巴结,转移率为 35.7%)可见淋巴结微转移灶;而Hep-2/Tiam1 细胞组6只裸鼠中共3只双侧3只单侧(共计9个淋巴结,转移率为 75%)可见淋巴结微转移灶。Hep-2/Tiam1细胞组与前两组的淋巴结转移率比较,差异具有统计学意义(P<0.05),见图7。同时所有裸鼠肝肺组织中未见转移灶。因此,这表明Tiam1基因过表达能够促进喉癌Hep-2细胞株在动物体内的淋巴结转移能力。

图7 Tiam1基因过表达后对喉癌Hep-2细胞株在裸鼠体内淋巴结转移能力的影响 注:*P<0.05,Hep-2/Tiam1 vs Hep-2,Hep-2/Mock。
3 讨论
在我们的研究中,MTT实验显示Tiam1过表达后对Hep-2细胞株的体外增殖能力无明显影响(P>0.05)。而细胞划痕实验及Transwell侵袭实验均发现Tiam1过表达后,Hep-2细胞的体外迁移及侵袭能力均显著增加(P<0.05)。本研究中3组细胞的裸鼠移植瘤动物模型均100%成瘤,而且3组细胞的移植瘤标本中均有肿瘤破溃的情况出现,据此,我们认为喉癌Hep-2细胞在裸鼠体内有着很高的致瘤性。过表达Tiam1的Hep-2细胞株在裸鼠体内的成瘤速度及最终质量较两对照组相比无明显差异(P>0.05),但颈淋巴结的转移率明显增加(P<0.05)。因此,我们体外及体内的研究结果均说明Tiam1的过表达对喉癌Hep-2细胞的生长能力无明显影响,但能够促进其侵袭及转移能力。我们前期组织病理学的研究结果表明Tiam1的高表达与喉癌的T分期之间无明显统计学关系,但是与喉癌患者的颈淋巴结转移密切相关[14-15]。因此,我们现今在细胞水平上的研究结果与前期组织学上的研究结果相符。
有关Tiam1对其他肿瘤生物学行为的影响,刘莉等[16]发现Tiam1过表达后能够增强结直肠癌细胞的体内增殖能力。Hou等[17]发现Tiam1基因沉默能够降低肺巨细胞癌的体内侵袭转移能力。还有相关研究发现Tiam1对肺腺癌、胆管癌细胞的体内生长及迁移侵袭能力均有影响,而且Tiam1的侵袭功能既依赖于Rho介导的细胞信号传导通路,也依赖于非Rho介导的细胞信号传导通路[18-19]。Huang等[10]通过将肝癌细胞注射入裸鼠侧腹部皮下形成移植瘤,他们发现Tiam1的过表达能够促进肿瘤细胞的生长及转移能力,而下调Tiam1的表达水平则能够抑制肿瘤细胞的增长及转移能力。还有研究发现下调Tiam1的表达能够抑制结直肠癌移植瘤的生长能力,并且会减少肿瘤细胞向肝肺的转移[20]。由此可见,以上研究均认为Tiam1对肿瘤细胞的体内外生长、尤其是侵袭转移能力均有影响。而对于我们的研究中Tiam1对喉癌生长方面影响的研究结果与其他大部分的研究结果不符,我们认为可能与细胞的特异性、体内实验的样本量及裸鼠造模的方法差异等因素有关。而有关Tiam1对喉癌侵袭转移能力相关的信号通路的进一步阐明将有助于深入探讨喉癌的发病机制。
4 结论
Tiam1过表达后对喉癌细胞的体内外增殖能力无明显影响,但能增强喉癌细胞的体内外侵袭转移能力。以上结果表明Tiam1在喉癌的进展中可能发挥了重要的作用,其有可能成为喉癌治疗中的潜在干预靶点。
