连翘苷对食管上皮恶性转变细胞和食管癌Eca-109细胞的抑制作用及机制
2022-09-01郭子琪王少康桂兰兰孙桂菊
郭子琪,王少康,桂兰兰,夏 惠,孙桂菊
(东南大学公共卫生学院,江苏 南京 210009)
2020年,食管癌的发病率位列全球范围恶性肿瘤的第7位,总死亡率位列全球范围恶性肿瘤第6位。据统计,我国食管癌的发病率和死亡率居高不下,是威胁国民健康的高发性恶性肿瘤。目前食管癌治疗有手术切除、化疗和放疗,但副作用不容忽视。中药在我国应用历史悠久,资源丰富,具有成本低廉、毒副作用较小等特点,因而在中药中筛选抗癌生物活性成分并探讨其抗癌机制显得尤为重要。
连翘苷不仅是中药连翘的主要生物活性物质之一,也存在于新食品原料连翘叶中,且具有抗炎、抗氧化和抗肿瘤等药理作用。越来越多的研究显示连翘苷可通过多种信号通路如磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/PKB)(也称为PI3K/AKT)、Janus激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)等信号通路发挥作用。PI3K/AKT信号通路对许多生理和病理状况至关重要,例如细胞增殖、血管生成、代谢、分化和存活,被证实在乳腺癌、前列腺癌和胃癌等多种肿瘤中异常表达。已有研究发现连翘苷可通过调节PI3K/AKT信号通路抑制768-0细胞增殖活力;同时多项研究证实PI3K/AKT信号通路与食管癌的发生有关,且发现可通过抑制PI3K/AKT信号通路来影响食管癌细胞生长。然而,连翘苷对食管癌的抗癌效果及作用机制尚不明确。
本研究以食管上皮恶性转变细胞(本课题组自制)和Eca-109细胞为研究对象,观察连翘苷对这两种细胞增殖、周期、凋亡、迁移和侵袭的影响,并从PI3K/AKT信号通路探讨其作用机制,为新食品原料连翘叶的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
人食管正常上皮细胞(human normal esophageal epithelial cell,HEEC)、人食管癌Eca-109细胞购自上海中科院细胞库。连翘苷(纯度≥98%) 北京世纪奥科生物技术有限公司;黄曲霉毒素B(aflatoxin B,AFB)(纯度≥98%) 上海源叶生物科技有限公司;胎牛血清以色列BI公司;低限基本培养基(minima essential medium,MEM)、无血清细胞冻存培养基RPMI-1640、磷酸盐缓冲液(phosphate-buffered saline,PBS)(0.01 mol/L,pH 7.4)、胰蛋白酶溶液 美国Gibco公司;双抗(青霉素、链霉素) 美国Hyclone公司;甲醇(分析纯) 上海凌峰化学试剂有限公司;细胞计数试剂盒-8(cell counting kit-8,CCK8) 美国APExBIO公司;Transwell小室、基质胶、荧光素标记的连接素V-异硫氰酸荧光素/碘化丙啶(annexin V-fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)细胞凋亡检测试剂盒 美国BD公司;细胞周期检测试剂盒江苏凯基生物技术股份有限公司;增强型化学发光试剂(enhanced chemiluminescence reagents,ECL) 江苏迅贝生物技术股份有限公司;PI3K、p-PI3K、AKT、p-AKT、p21、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、基质金属蛋白酶9(matrix metallopeptidase 9,MMP9)、-actin等抗体 美国ABcam公司。
1.2 仪器与设备
IX51型倒置显微镜 日本Olympus公司;CCL-170B-8型二氧化碳培养箱 新加坡ESCO公司;Vert.A1型倒置金相显微镜 德国Zeiss公司;5424 R型台式高速冷冻离心机 德国Eppendorf公司;FacsAriaII型流式细胞仪 美国BD公司;Infnite F50型酶标检测仪瑞士Tecan公司;DYY-7C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 细胞培养
根据本研究前期基础,使用含1 μmol/L AFB的MEM培养基(每100 mL MEM培养基中加入10 mL胎牛血清和1 mL双抗)进行长期培养HEEC,置于37 ℃、5% CO的细胞培养箱中,每2~3 d进行传代,直到培养到第30代为食管上皮恶性转变细胞。
Eca-109细胞使用RPMI-1640培养基(每100 mL RPMI-1640培养基中加入10 mL胎牛血清和1 mL双抗)进行长期培养,置于37 ℃、5% CO的细胞培养箱中,每2~3 d进行传代。
1.3.2 细胞克隆程度测定
将HEEC和食管上皮恶性转变细胞用胰蛋白酶消化后,接种于6 孔板,每孔接种1 000 个细胞,待细胞贴壁后,每隔3 d换1 次培养液。培养2 周后,弃掉孔中的培养液,PBS洗2 次,用3 mL甲醇(分析纯)固定15 min,加入结晶紫溶液常温染色20 min,用PBS冲洗,然后在显微镜下观察计数大于10 个细胞的克隆数,实验重复3 次。克隆形成率计算如公式(1)所示。

1.3.3 细胞存活率测定
将HEEC、食管上皮恶性转变细胞和Eca-109细胞各以5×10个/mL密度接种于96 孔板,每孔100 μL,置于37 ℃、5% CO培养箱内培养24 h,分别用0、1、10、100、200、400、600、800、1 000 μmol/L连翘苷处理细胞,并设置空白孔(仅含培养液)、对照孔(0 μmol/L连翘苷),每组设5 个复孔。干预24 h后,每孔加10 μL CCK8溶液,37 ℃培养箱内孵育1.5 h,置于酶标检测仪中在450 nm波长下测定各孔吸光度。使用Graph Pad软件计算半数抑制浓度(50% inhibitory concentration,IC)。通过将0 μmol/L连翘苷组的细胞存活率定义为100%,细胞存活率按公式(2)计算,表征各组细胞增殖活力。

1.3.4 细胞周期测定
一方面,尽管东昌区政府高度重视并采取一系列卓有成效的措施支持葫芦文化产业的发展,却没有深刻认识到葫芦文化在乡村旅游中的发展地位,没有充分抓住山东省全面开发乡村旅游的良好机遇,利用本地丰富的葫芦文化旅游资源,大力发展极具地域特色的乡村旅游。另一方面,社区居民对种植、加工葫芦的收入较为满意,且因文化层次较低,缺少乡村旅游开发经验,从而对开发葫芦文化旅游缺乏足够的信心和热情。
将食管上皮恶性转变细胞和Eca-109细胞接种于细胞培养瓶,内含3 mL完全培养液,置于37 ℃、5% CO培养箱内培养24 h,分别用0、10、100 μmol/L连翘苷干预细胞24 h,用PBS洗涤后,加1 mL胰酶进行消化,待细胞皱缩变圆立即加入2 mL完全培养液终止消化,离心(1 000 r/min、5 min)后,加入PBS调整每孔1×10个细胞,1 000 r/min离心5 min后,倒掉上清液,加入500 μL体积分数70%冰乙醇置于4 ℃冰箱过夜。PBS洗涤、离心2 次(1 000 r/min、5 min),弃上清液,加入500 μL配制好的染液((RNase A)∶(PI)=1∶9),轻柔吹打混匀,避光放置30~60 min后,吸取细胞悬液过300 目筛后,用流式细胞仪检测,使用FlowJo软件分析数据。
1.3.5 细胞凋亡测定
将食管上皮恶性转变细胞和Eca-109细胞各以1×10个/mL密度接种于6 孔板,每孔2 mL,置于37 ℃、5% CO培养箱内培养24 h,分别用0、10、100 μmol/L连翘苷处理细胞24 h后,与上述同样方法用PBS调整至每孔5×10个细胞后,PBS洗涤、离心(1 000 r/min、5 min)2 次,弃上清液,加适量的结合缓冲液,轻柔吹打,加5 μL Annexin V-FITC,避光孵育15 min后,加5 μL PI,采用流式细胞仪检测细胞凋亡的变化,使用FlowJo软件分析数据。
1.3.6 细胞迁移、侵袭能力测定
收集0、10、100 μmol/L连翘苷干预的食管上皮恶性转变细胞和Eca-109细胞。用无胎牛血清的MEM培养基以体积比1∶8稀释基质胶,50 μL/孔铺于Transwell小室,4 ℃冷藏过夜。上室加入200 μL细胞悬液(5×10个/孔),下室加入含体积分数20%胎牛血清的600 μL培养液。培养24 h后取出小室,PBS清洗,棉签擦去基质胶与细胞,甲醇(分析纯)固定,结晶紫染色液染色后于倒置显微镜下观察穿过膜的细胞,每张膜随机选取5 个视野,计数穿过微孔的细胞数,分析细胞侵袭能力。而在分析细胞迁移能力时,Transwell小室不需要铺基质胶,且上室仅加入200 μL细胞悬液(2×10个/孔)即可,其余步骤同细胞侵袭能力分析。
1.3.7 Western blot检测
提取0、10、100 μmol/L连翘苷干预的食管上皮恶性转变细胞和Eca-109细胞的总蛋白,用RIPA裂解液提取细胞总蛋白,BCA蛋白定量检测试剂盒检测蛋白浓度。配制分离胶和浓缩胶,将定量后的蛋白按照20 μg/孔上样,用不同的恒压进行电泳,采用“三明治”法将蛋白转移至聚偏氟乙烯膜,然后用质量分数5%脱脂奶粉在室温下封闭2 h,加入对应的一抗后4 ℃孵育过夜。TBST(Tris-HCl缓冲溶液+Tween-20)洗膜3 次,每次10 min,用对应种属的二抗((二抗)∶(TBST)=1∶3 000)在37 ℃孵育1 h,TBST洗膜3次,每次10 min。最后用ECL化学发光试剂于暗室显色曝光,用Image J软件定量分析蛋白灰度值结果。
1.4 数据统计与分析
使用SPSS 20.0软件对结果进行统计学分析,多组间比较采用单因素方差分析,数据用平均值±标准偏差表示,用Graph Pad 8.0软件进行绘图。<0.05表示有统计学意义。
2 结果与分析
2.1 食管上皮恶性转变细胞的确定
平板克隆形成实验是体外检测细胞增殖能力的常用方法。细胞克隆形成的能力与肿瘤细胞增殖能力密切相关,其大小可以反映肿瘤细胞的致瘤能力和恶性程度。如图1所示,HEEC和食管上皮恶性转变细胞的克隆形成率分别为(0.60±0.08)%、(4.23±0.21)%,与HEEC相比,食管上皮恶性转变细胞的克隆形成率显著升高(<0.05),说明食管上皮恶性转变细胞的细胞增殖能力较强。研究表明食管鳞癌的癌前病变主要指食管鳞状上皮细胞的异型增生,因此认为食管上皮恶性转变细胞具有一定的致瘤能力,属于食管癌前病变细胞。
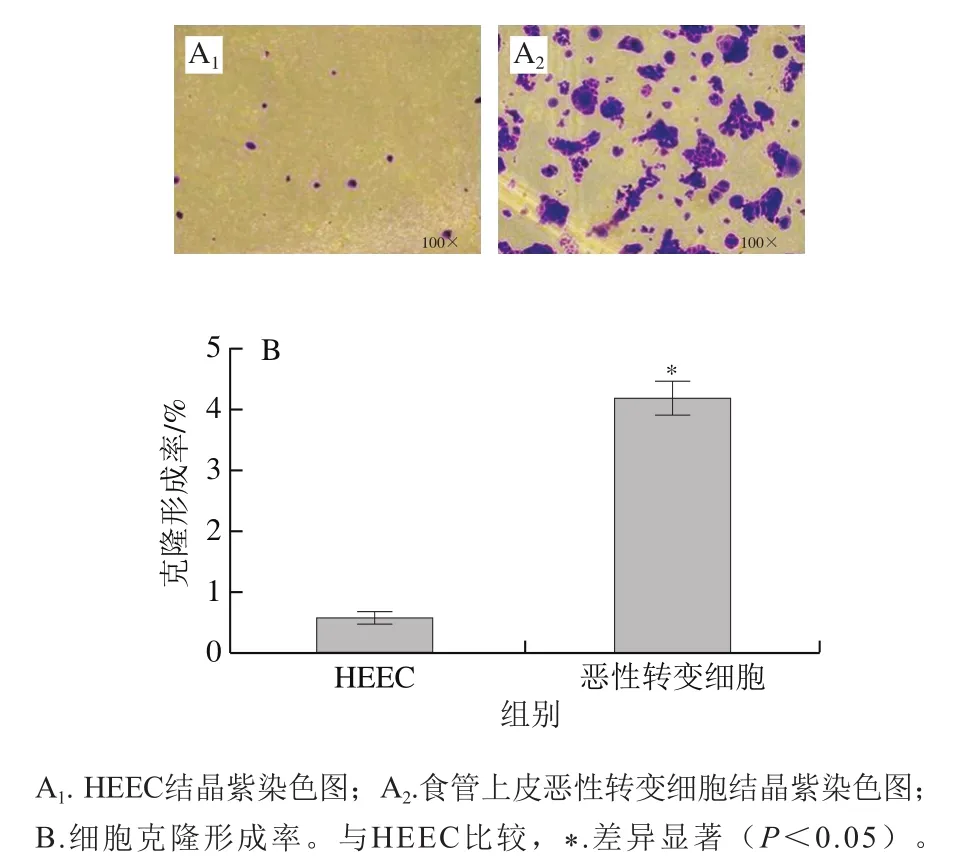
图1 食管上皮恶性转变细胞的平板克隆实验结果(n=3)Fig. 1 Results of plate cloning of malignantly transformed esophageal epithelial cells (n = 3)
2.2 连翘苷对食管上皮恶性转变细胞、Eca-109细胞和HEEC存活率的影响
CCK8法检测结果(表1)显示,10、100、200、400、600、800 μmol/L和1 000 μmol/L连翘苷均可抑制食管上皮恶性转变细胞和Eca-109细胞增殖,其IC值分别为308.4 μmol/L和322.0 μmol/L;然而,1、10、100 μmol/L连翘苷可促进HEEC增殖,200、400、600、800 μmol/L和1 000 μmol/L连翘苷可抑制HEEC增殖,其IC值为384.4 μmol/L。结合连翘苷对3 种细胞增殖的影响,1、10、100 μmol/L连翘苷对HEEC增殖无明显的抑制,这证明了连翘苷浓度在低于或等于100 μmol/L时对HEEC无明显的细胞毒性作用;而10、100 μmol/L连翘苷可抑制食管上皮恶性转变细胞和Eca-109细胞增殖,且为避免高浓度连翘苷细胞毒性的影响,故选择浓度10、100 μmol/L进行后续实验。
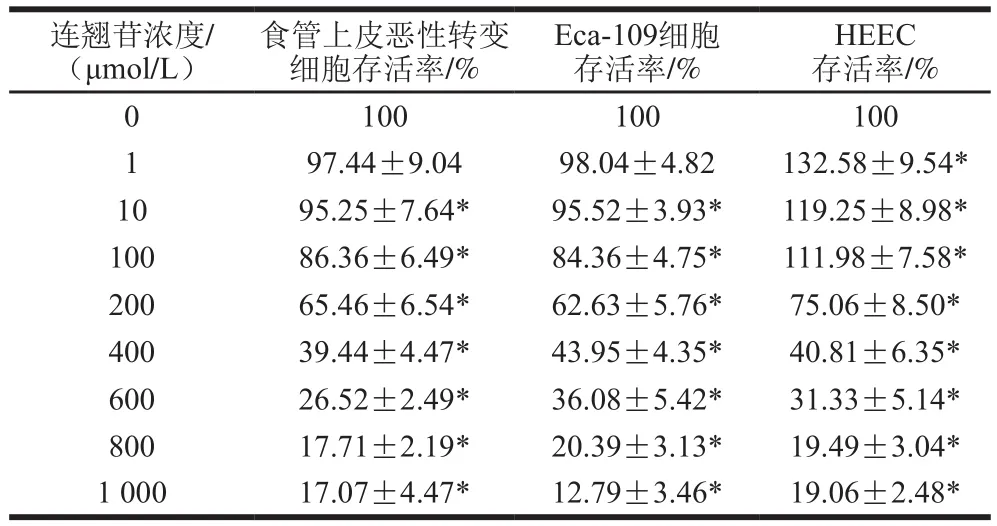
表1 不同浓度连翘苷对食管上皮恶性转变细胞、Eca-109细胞和HEEC存活率的影响(n=3)Table 1 Effect of forsythin at different concentrations on the survival rates of malignantly transformed esophageal epithelial cells, Eca-109 cells and HEEC (n = 3)
2.3 连翘苷对食管上皮恶性转变细胞的抑制作用及机制
2.3.1 连翘苷对食管上皮恶性转变细胞周期的影响
流式细胞术检测细胞周期结果(图2)显示,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞周期发生显著改变,干预组G0/G1期细胞比例显著增加(<0.05),S期细胞比例显著降低(<0.05),且随着连翘苷浓度升高,各周期细胞比例变化越明显,说明连翘苷可能通过将细胞阻滞在G0/G1期抑制食管上皮恶性转变细胞增殖。
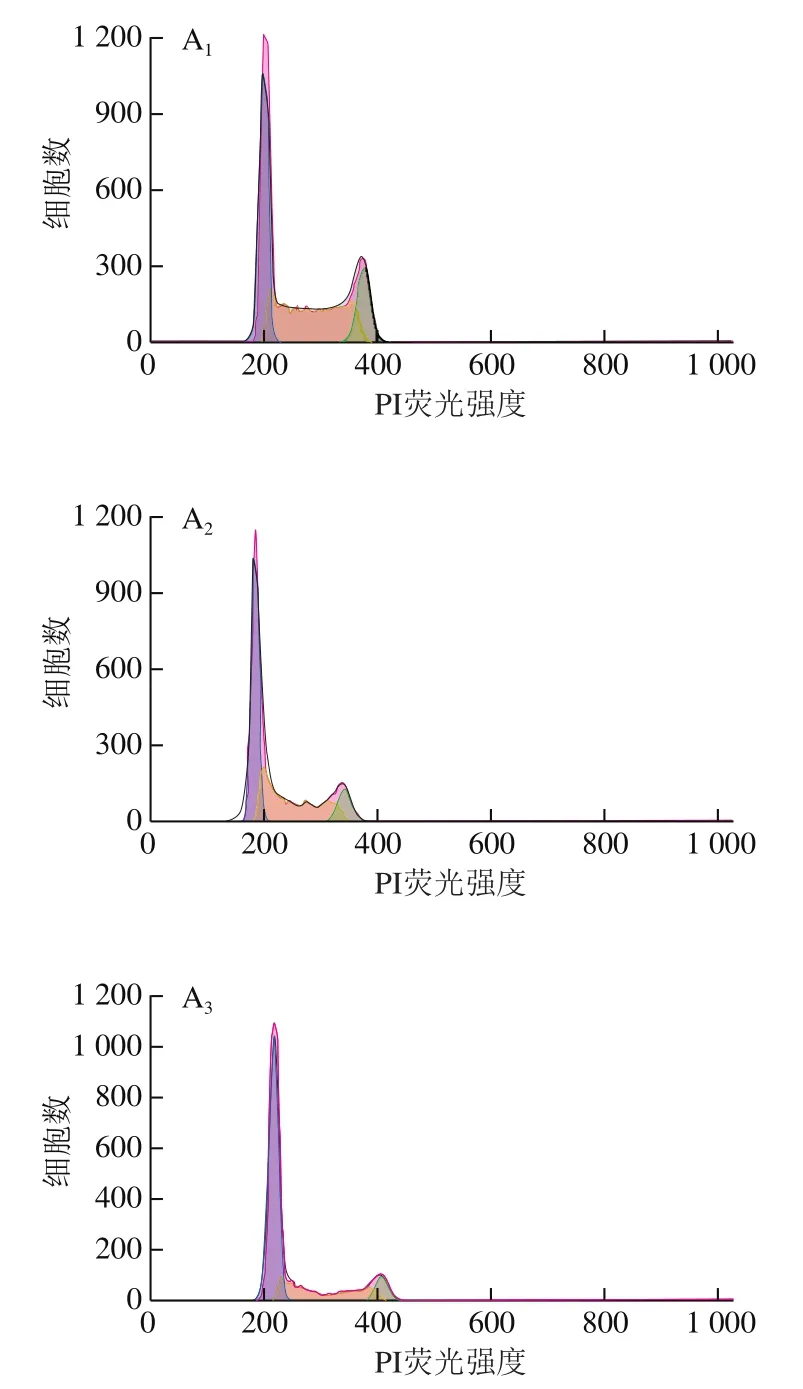
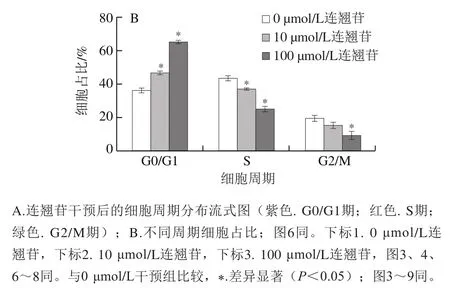
图2 连翘苷诱导食管上皮恶性转变细胞周期改变(n=3)Fig. 2 Forsythin-induced cell cycle changes of malignantly transformed esophageal epithelial cells (n = 3)
2.3.2 连翘苷对食管上皮恶性转变细胞凋亡的影响
流式细胞术检测细胞凋亡结果显示,0、10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的凋亡率分别为(8.15±0.14)%、(10.76±0.46)%和(22.83±0.13)%(图3)。与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的凋亡率显著升高(<0.05)。说明连翘苷可能通过促进细胞凋亡抑制食管上皮恶性转变细胞增殖。
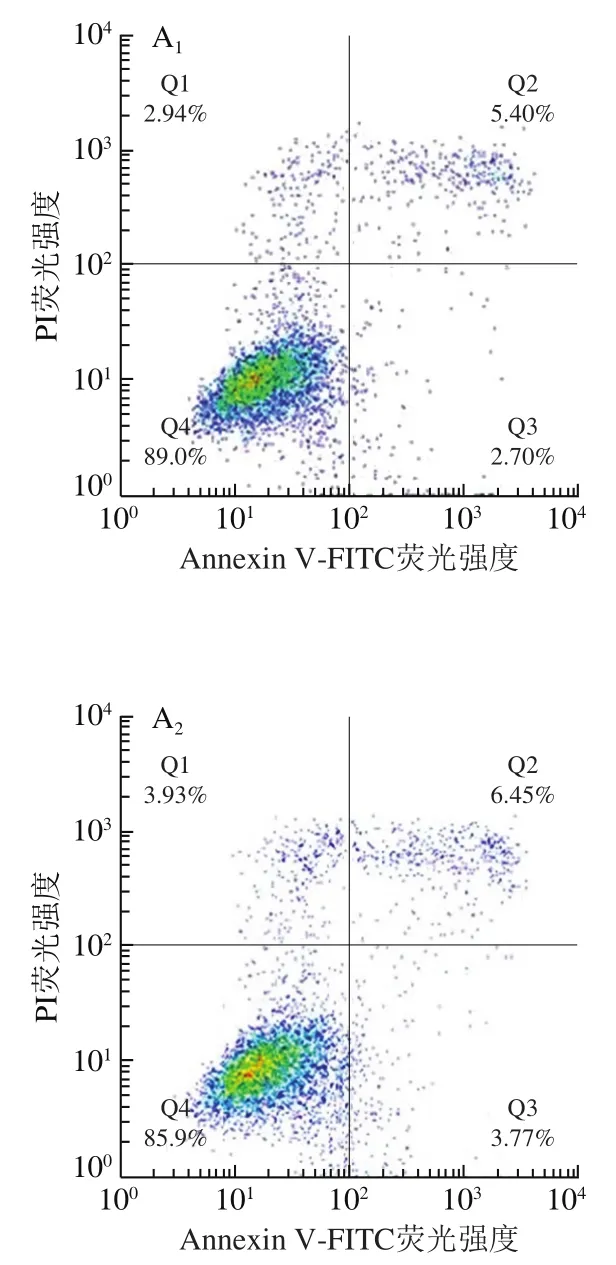
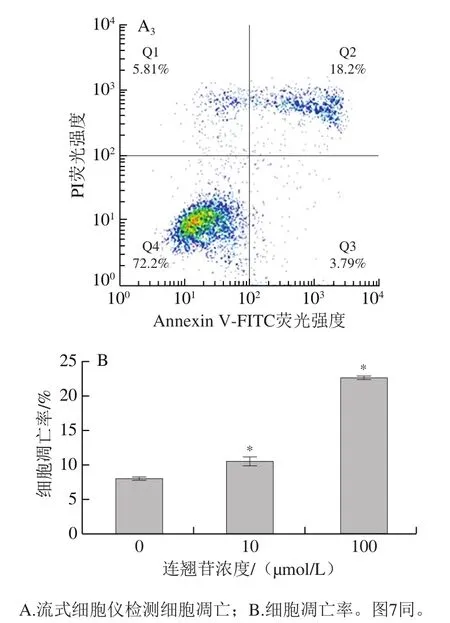
图3 连翘苷对食管上皮恶性转变细胞凋亡的促进作用(n=3)Fig. 3 Promoting effect of forsythin on cell apoptosis in malignantly transformed esophageal epithelial cells (n = 3)
2.3.3 连翘苷对食管上皮恶性转变细胞迁移、侵袭的影响
如图4A、B所示,0、10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的迁移穿膜细胞数分别为295.20±14.62、190.20±20.30和136.60±7.94。与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的迁移穿膜细胞数显著减少(<0.05),说明经10、100 μmol/L连翘苷干预后的食管上皮恶性转变细胞迁移能力降低。由图4C、D可知,0、10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的侵袭穿膜细胞数分别为169.80±16.81、67.60±4.63和47.60±1.50。与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞的侵袭穿膜细胞数显著减少(<0.05),说明经10、100 μmol/L连翘苷干预后的食管上皮恶性转变细胞侵袭能力降低。

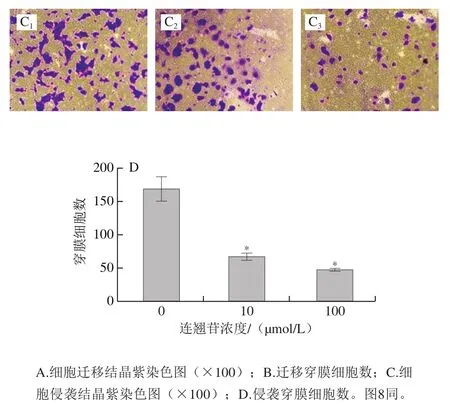
图4 连翘苷对食管上皮恶性转变细胞迁移、侵袭的抑制作用(n=5)Fig. 4 Inhibitory effect of forsythin on migration and invasion of malignantly transformed esophageal epithelial cells (n = 5)
2.3.4 连翘苷对食管上皮恶性转变细胞中蛋白表达的影响
Western blotting检测结果如图5显示,在PI3K/AKT通路蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞中p-PI3K、p-AKT蛋白表达水平显著降低(<0.05)。在周期相关蛋白表达方面,与0 μmol/L干预组相比,100 μmol/L连翘苷干预组的食管上皮恶性转变细胞中p21蛋白表达水平显著升高(<0.05)。在凋亡相关蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞中Bcl-2蛋白表达水平显著降低(<0.05)。在侵袭迁移相关蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的食管上皮恶性转变细胞中MMP9蛋白表达水平显著降低(<0.05)。
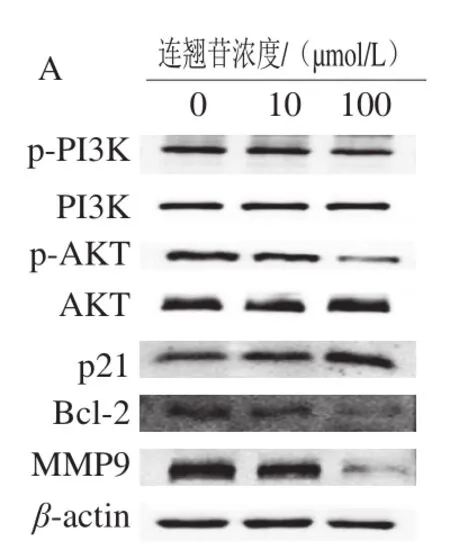
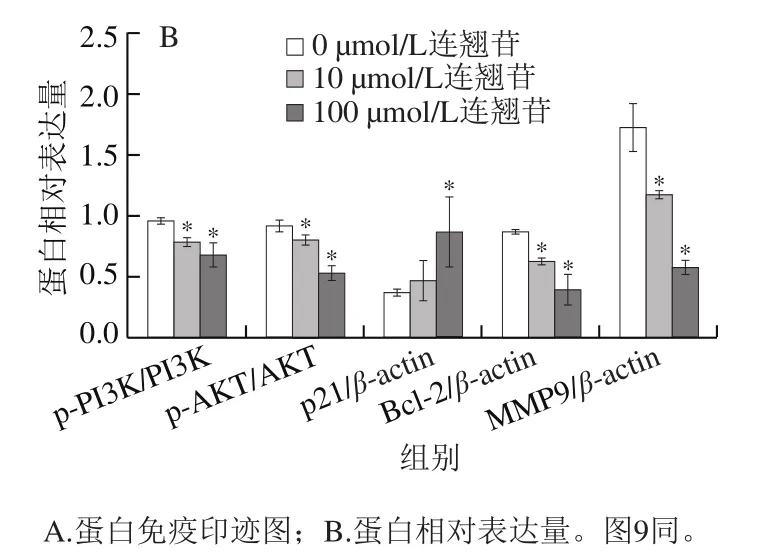
图5 连翘苷对食管上皮恶性转变细胞中蛋白表达的影响Fig. 5 Effect of forsythin on protein expression in malignantly transformed esophageal epithelial cells
2.4 连翘苷对Eca-109细胞的抑制作用及机制
2.4.1 连翘苷对Eca-109细胞周期的影响
流式细胞术检测细胞周期结果如图6所示,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的Eca-109细胞周期发生明显改变,干预组G0/G1期细胞比例显著增加(<0.05),S期细胞比例明显降低(<0.05),且随着连翘苷浓度升高,各周期细胞比例变化越明显,说明连翘苷可能通过将细胞阻滞在G0/G1期抑制Eca-109细胞增殖。
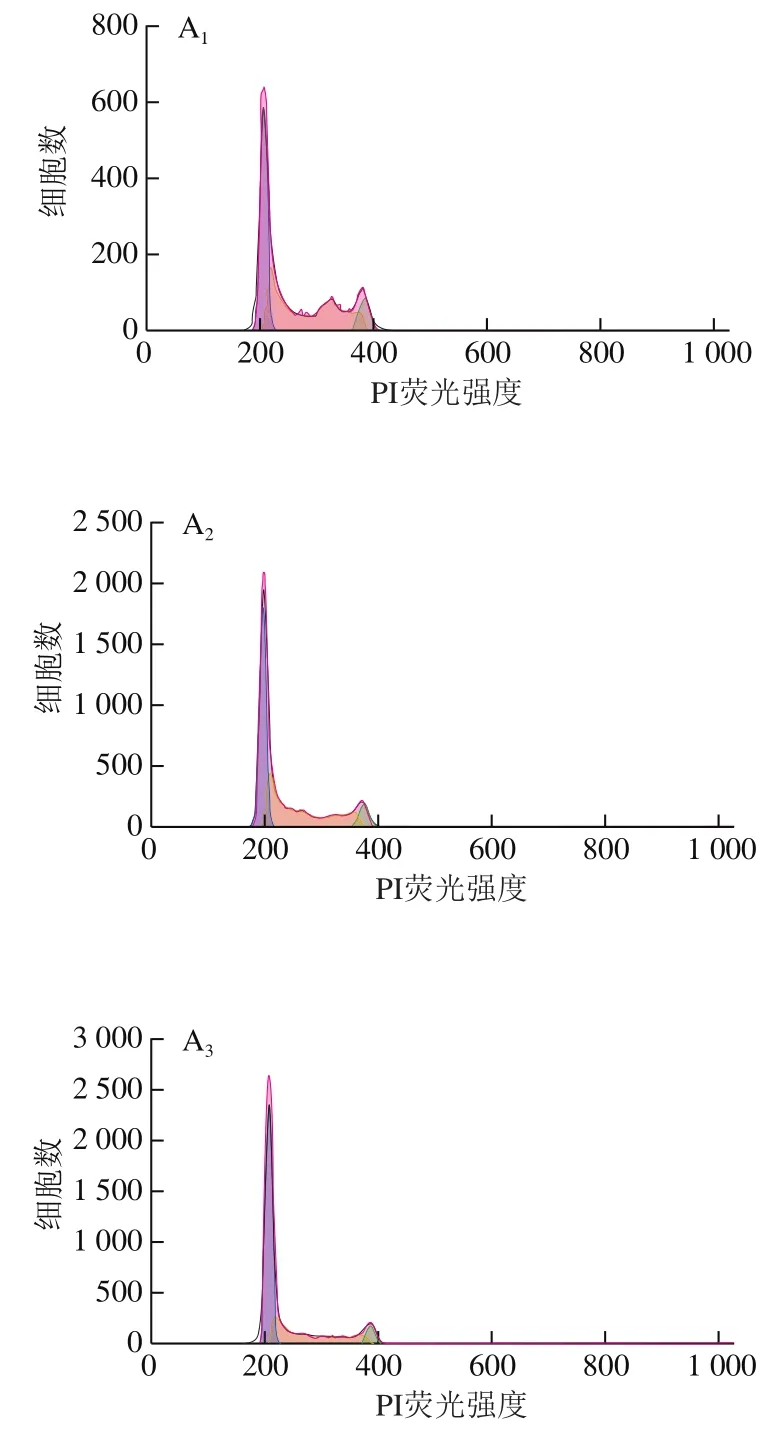
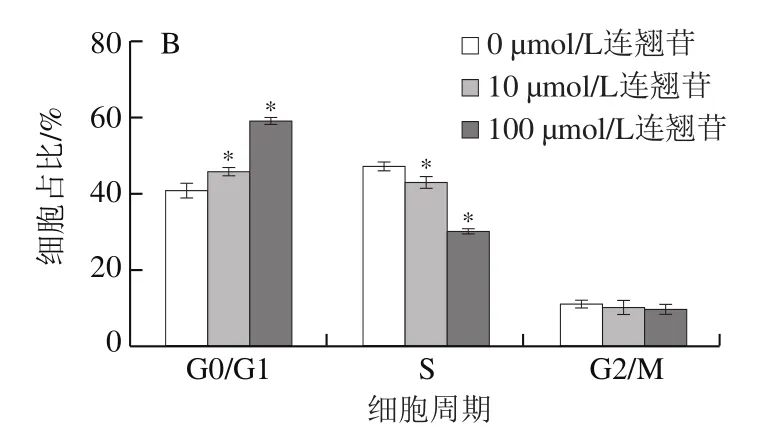
图6 连翘苷诱导Eca-109细胞周期改变(n=3)Fig. 6 Forsythin-induced cell cycle changes in Eca-109 cells (n = 3)
2.4.2 连翘苷对Eca-109细胞凋亡的影响
流式细胞术检测细胞凋亡结果如图7所示,0、10、100 μmol/L连翘苷干预组的Eca-109细胞的凋亡率分别为(9.92±0.59)%、(12.71±0.50)%和(15.42±0.01)%。与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组Eca-109细胞的凋亡率显著升高(<0.05),说明连翘苷可能通过促进细胞凋亡抑制Eca-109细胞增殖。
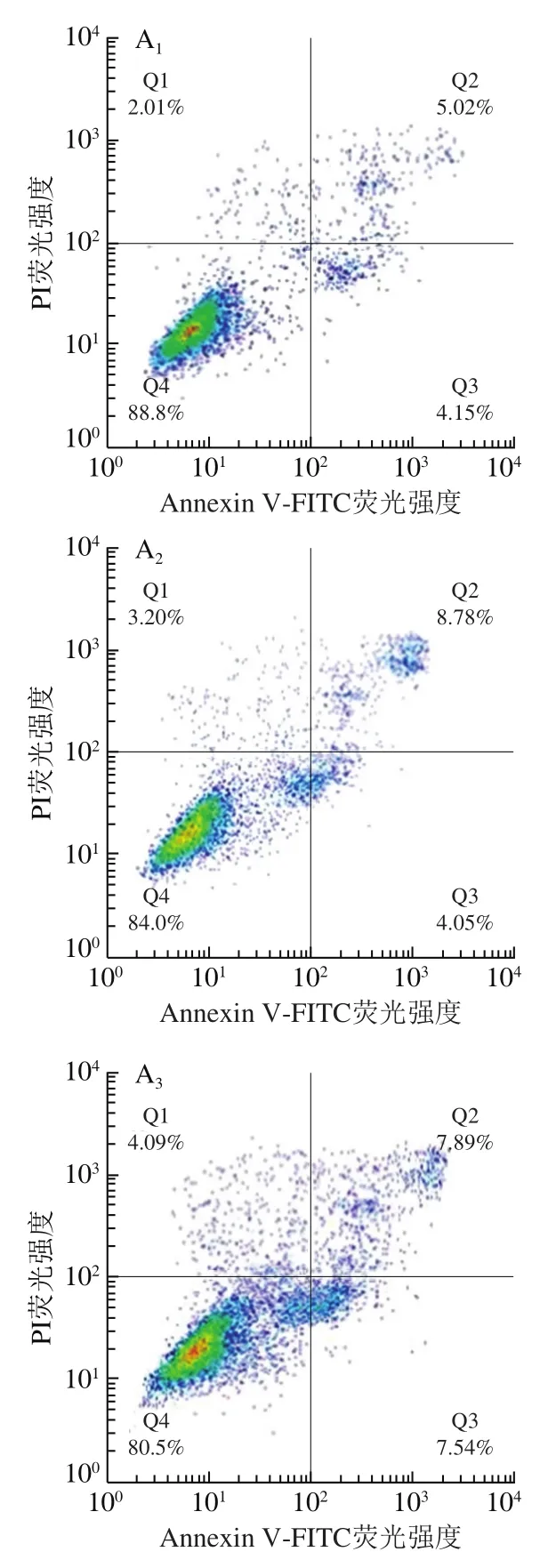
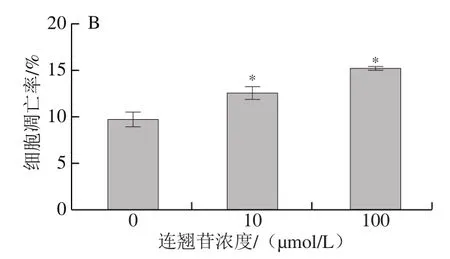
图7 连翘苷对Eca-109细胞凋亡的促进作用(n=3)Fig. 7 Promoting effect of forsythin on cell apoptosis in Eca-109 cells (n = 3)
2.4.3 连翘苷对Eca-109细胞迁移、侵袭的影响
Transwell迁移实验结果如图8A、B所示,0、10、100 μmol/L连翘苷干预组的Eca-109细胞的迁移穿膜细胞数分别为413.60±12.02、310.04±9.91和183.60±10.30。与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组Eca-109细胞的迁移穿膜细胞数显著减少(<0.05),说明经10、100 μmol/L连翘苷干预后的Eca-109细胞迁移能力降低。Transwell侵袭实验结果(图8C、D)显示,0、10、100 μmol/L连翘苷干预组Eca-109细胞的侵袭穿膜细胞数分别为44.40±3.82、20.00±2.00和7.40±0.48,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组Eca-109细胞的侵袭穿膜细胞数显著减少(<0.05),说明经10、100 μmol/L连翘苷干预后的Eca-109细胞侵袭能力降低。
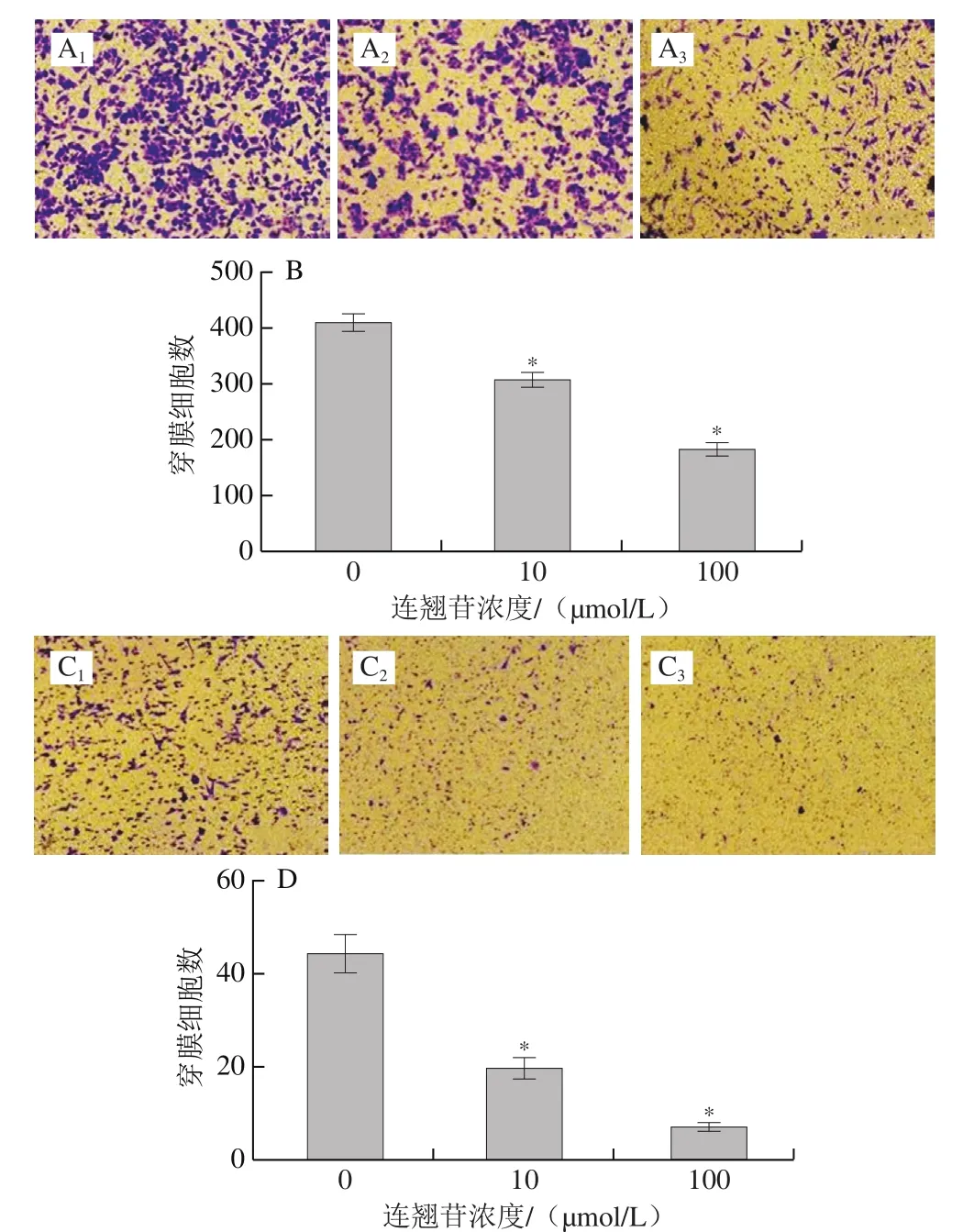
图8 连翘苷对Eca-109细胞迁移、侵袭的抑制作用(n=5)Fig. 8 Inhibitory effect of forsythin on migration and invasion of Eca-109 cells (n = 5)
2.4.4 连翘苷对Eca-109细胞中蛋白表达的影响
Western blotting检测结果显示,在PI3K/AKT通路蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的Eca-109细胞中p-PI3K、p-AKT蛋白表达水平显著降低(<0.05)(图9)。在周期相关蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的Eca-109细胞中p21蛋白表达水平显著升高(<0.05)。在凋亡相关蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的Eca-109细胞中Bcl-2蛋白表达水平显著降低(<0.05)。在侵袭、迁移相关蛋白表达方面,与0 μmol/L干预组相比,10、100 μmol/L连翘苷干预组的Eca-109细胞中MMP9蛋白表达水平显著降低(<0.05)。
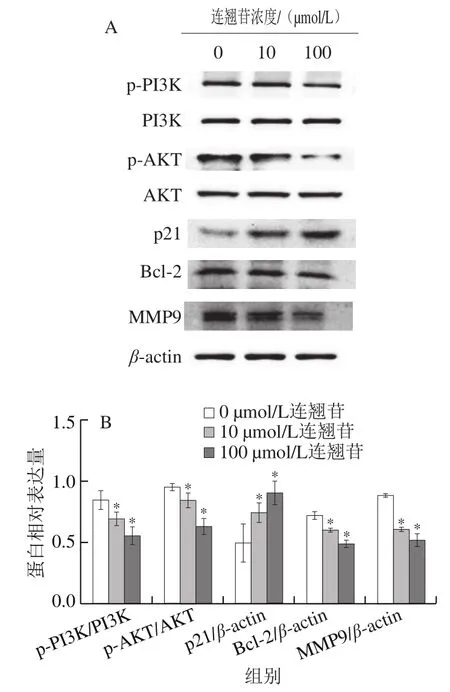
图9 连翘苷对Eca-109细胞中蛋白表达的影响Fig. 9 Effect of forsythin on protein expression in Eca-109 cells
3 讨 论
连翘是一味广谱抗肿瘤中药,对乳腺癌、前列腺癌、食管癌等均有抑制作用,其中连翘苷为主要活性物质。本研究旨在证明连翘苷具有抗食管癌活性。本课题组前期的病例对照研究结果表明,AFB的高暴露可能是中国淮安(食管癌高发区)地区人群食管癌前病变的重要危险因素,故本研究使用AFB处理HEEC使其转变为食管上皮恶性转变细胞。本研究发现连翘苷可抑制食管上皮恶性转变细胞和食管癌Eca-109细胞的增殖,且连翘苷对食管上皮恶性转变细胞和食管癌Eca-109细胞的抑制率呈现浓度梯度依赖性增高。
PI3K/AKT信号通路在多种癌症的发生、发展进程中发挥着重要作用,其异常激活同样与食管鳞状细胞癌的发生、发展息息相关。PI3K通过配体(胰岛素、生长因子、激素)与酪氨酸激酶受体以及G蛋白偶联受体的结合而被激活。一旦被激活,该蛋白激酶将催化磷脂酰肌醇二磷酸为磷脂酰肌醇三磷酸。AKT被募集到质膜,可经历两个磷酸化过程,第一个过程由3-磷酸肌醇依赖性蛋白激酶1在苏氨酸残基水平催化,第二个反应由哺乳动物雷帕霉素靶蛋白复合物2(mammalian target of rapamycin complex 2, mTORC2)催化。一旦被磷酸化激活,AKT将磷酸化其他物质从而介导细胞增殖和凋亡等。据报道,连翘苷可通过抑制PI3K/AKT信号通路而发挥抑制肾细胞腺癌768-0细胞增殖活力、干预细胞周期、促进细胞凋亡、抑制细胞迁移与侵袭的能力。本研究发现经连翘苷干预后食管上皮恶性转变细胞和食管癌Eca-109细胞p-PI3K、p-AKT的表达水平降低,提示连翘苷可能通过PI3K/AKT信号通路抑制食管癌。
越来越多的证据表明p21蛋白是控制细胞增殖/生长并参与多种癌症的细胞周期检查点的关键调节剂,可在G1和S期作为负调节剂控制细胞周期进程。Du Yuanyuan等发现连翘苷可通过p53/p21信号通路调节细胞周期,Guo Qisang等发现抑制PI3K/AKT信号通路可提高p21的表达水平,因此推测连翘苷通过抑制PI3K/AKT信号通路上调p21蛋白表达来促进周期改变,本研究证实了这一推测。
Lei Qiuxiang等发现连翘叶的乙醇提取物(ethanol extract ofleaf,FSEE)可诱导食管癌TE-13细胞凋亡,且经FSEE处理后的TE-13细胞mRNA表达水平下调。Bcl-2是Bcl-2细胞凋亡蛋白调节剂家族的成员,可特异性阻断细胞凋亡。Zhang Li等研究发现miR-325的过表达可抑制PI3K和AKT的磷酸化,降低Bcl-2的表达。PI3K/AKT通路可通过增加Bcl-2启动子的组蛋白乙酰化来促进Bcl-2转录。本研究证实连翘苷可通过抑制PI3K/AKT信号通路下调Bcl-2表达来促进食管上皮恶性转变细胞和Eca-109细胞凋亡。
韩国的一项研究发现连翘提取物可能阻断乳腺癌细胞的侵袭,而且通过明胶酶谱和组织蛋白酶K检测试剂盒检测到MMP2和MMP9活性降低。MMP9是MMP家族的成员,参与癌症转移中细胞外基质的分解。PI3K/AKT/mTOR信号通路可通过诱导MMP9启动子区域上的和来调节MMP9的表达,从而控制癌细胞迁移和侵袭。因此假设连翘苷可通过抑制PI3K/AKT信号通路下调MMP9表达来抑制食管上皮恶性转变细胞和Eca-109细胞侵袭、迁移,本研究的实验结果证实了这一假设。
综上,连翘苷可抑制食管上皮恶性转变细胞和Eca-109细胞的增殖、迁移、侵袭发生,且随着浓度的增加抑制作用越显著,其机制与抑制PI3K/AKT通路中相关蛋白的表达有关。
