紫苏籽多糖分离纯化及抗肿瘤活性
2022-09-01刘子坤杨安皓安绮沄李冲伟
刘子坤,尹 贺,杨安皓,安绮沄,李冲伟,3,*,金 涛,*
(1.黑龙江大学 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150500;2.黑龙江大学生命科学学院,黑龙江 哈尔滨 150080;3.哈尔滨美苏生物科技开发有限公司,黑龙江 哈尔滨 150080)
紫苏((L.) Britt)为一年生草本植物,在中国、印度、日本和韩国等地盛产。在中国,紫苏和紫苏籽均被国家卫生部列入“药食同源”名单中。紫苏籽中含有黄酮、多酚、多肽和迷迭香酸等多种活性成分、以及丰富的不饱和脂肪酸,主要成分-亚麻酸进入人体后可生成二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)等,具有降血脂、预防血栓形成、保护心脑血管和提高免疫力的功能。Kwak等发现紫苏叶乙醇提取物对HCT116大肠癌细胞和H1299肝癌细胞的生长均起到抑制作用,Park等发现紫苏叶提取物可增强巨噬细胞胆固醇外流能力,并降低动脉粥样硬化的发生。Thomas等研究发现,紫苏叶提取物能够降低高脂饮食导致的高血脂水平,对控制啮齿类动物肥胖具有一定的功效。目前,大多数研究集中在紫苏油和紫苏叶上,对紫苏粕的功效研究却鲜有报道。紫苏粕是紫苏籽榨油后的副产物,含有丰富的多糖、多肽和黄酮类物质。目前,这些紫苏粕大部分没有得到很好的利用,直接作为畜禽饲料,或直接丢弃,不仅造成了资源的浪费,而且污染了周围的环境。
多糖在多种方面均具有重要生理功能,如抗氧化、抗肿瘤、抗病毒、增强非特异性免疫等。在多糖抗肿瘤研究中发现,多糖可对肝癌、肺癌及乳腺癌等肿瘤细胞起到抑制作用。因此,多糖的抗肿瘤作用被越来越多的研究者关注。本研究以紫苏籽多糖(seed polysaccharide,PFSP)为对象,并通过构建H荷瘤小鼠模型探究PFSP对小鼠血清细胞免疫因子和相关酶质量浓度,及细胞凋亡相关蛋白表达量的影响,结合肿瘤组织显微病理切片观察,阐释PFSP的抗肿瘤功效,以期为紫苏籽高值化利用提供理论参考,为开发植物源高效抗肿瘤药物提供新思路。
1 材料与方法
1.1 动物、材料与试剂
6~8 周龄SPF级昆明种健康小鼠购自哈尔滨市双城区弘昌养殖场,体质量18~20 g,雌雄各半,生产许可证号:SCXK(黑)2007-0001。
紫苏籽由哈尔滨美苏生物科技开发有限公司提供;肝癌瘤株H购自上海富衡生物科技有限公司。
纤维素DEAE-52 福州飞净生物科技有限公司;Sephadex G-100、G-200葡聚糖凝胶 常州天地人和生物科技有限公司;葡聚糖标准品 中国计量科学研究院;乳酸脱氢酶(lactate dehydrogenase,LDH)、醛缩酶(aldolase,ALD)、白细胞介素(interleukin,IL)-2、IL-10、肿瘤坏死因子(tumor necrosis factor,TNF)-α试剂盒 上海酶联生物科技有限公司;环磷酰胺(cyclophosphamide,CTX)药剂((CTX)∶(人参茎叶总皂苷)=1∶1) 吉林通化茂祥制药有限公司;三氟乙酸、1-苯基-3-甲基-5-吡唑啉酮、乙腈、三乙醇胺等试剂均为分析纯。
1.2 仪器与设备
FDU-1100冷冻干燥机 日本EYELA东京理化器械株式会社;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;Ulti Mate 3000高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Dionex公司;Spectrum Two傅里叶变换红外光谱分析仪美国Perkin Elmer公司;SpectraMax Paradingm多功能酶标仪 美国Bio-Rad公司;LWD 200-37 T倒置显微镜日本Olympus公司。
1.3 方法
1.3.1 PFSP提取
取紫苏籽榨油后的紫苏粕废料粉碎化,过60 目筛,加入石油醚(1∶20,/)脱脂6 h,残留物用蒸馏水(1∶20,/)在85 ℃提取2 h,此过程重复3 次,收集所有滤液。蒸发浓缩后加入3 倍体积无水乙醇,并在4 ℃下静置12 h,5 000 r/min离心15 min。沉淀物复溶后加入Sevag试剂((正丁醇)∶(氯仿)=1∶3)进行脱蛋白处理,反复多次,直至无明显残留。将溶液在自来水、蒸馏水和去离子水内分别透析1 d,冷冻干燥得到粗多糖PFSP。
1.3.2 PFSP的分离及纯化
将PFSP复溶后缓慢滴加到经处理的DEAE-52纤维素层析柱(58 cm×4 cm)上,依次用0、0.2、0.4、0.6 mol/L和0.8 mol/L NaCl溶液进行洗脱,流速为5 mL/min,5 mL收集一管。采用苯酚-硫酸法测定多糖含量,并根据峰值合并各组分。
将PFSP分离得到的各亚组分别装载到葡聚糖凝胶Sephadex G-100柱上,用蒸馏水以5 mL/min流速洗脱,收集洗脱液,每管5 mL,根据峰值合并各组分,冷冻干燥于4 ℃保存。
1.3.3 多糖相对分子质量测定
采用Sephadex G-200柱层析进行相对分子质量测定,将不同分子质量的葡聚糖标准品配制成质量浓度5 mg/mL溶液,0.1 mol/L NaCl溶液进行洗脱,记录洗脱体积()。并用蓝色葡聚糖相同条件上样测得外水体积()。以已知标准品相对分子质量对数值(lg)为纵坐标,/为横坐标制作标准曲线,并将待测多糖溶液以相同条件上样,根据标准曲线方程计算该多糖相对分子质量。
1.3.4 单糖组成分析
称取2.0 mg干燥样品分别置于安瓿管中,加入3 mL 2 mol/L三氟乙酸,110 ℃条件下水解3 h,水解后冷却至26 ℃,将样品移至圆底烧瓶并加入色谱级甲醇,减压浓缩至干,加入超纯水溶解并定容至1.5 mL;取200 µL上述溶液于反应管,加入100 µL 0.6 mol/L氨水溶液,100 µL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮溶液,混匀、封口,70 ℃下衍生100 min。反应后冷却至26 ℃,加入200 µL 0.3 mol/L乙酸溶液,氨水中和,摇匀后加入等体积三氯甲烷,萃取分层,收集水相部分,进行HPLC检测。
检测条件:色谱柱Agilent eclipse plus C柱(150 mm×4.5 mm,5 μm);梯度洗脱:流动相A为纯乙腈,流动相B为NaHPO缓冲液(0.45 g NaHPO+900 mL去离子水+1.0 mL三乙胺+100 mL乙腈),0~4 min 94% B、4~50 min 88% B;进样量10 μL;流速1.0 mL/min;紫外检测器;检测波长254 nm;柱温35 ℃。
混合标准品衍生方法同上,衍生后利用HPLC仪检测。各组分单糖组成定量采用与混合标准样品中各单糖的峰面积之比的方法表示。
1.3.5 傅里叶变换红外光谱测定
取样品与干燥KBr粉末混合、研磨、压片,在4 000~400 cm范围内进行红外光谱扫描。
1.3.6 免疫器官指数及抑瘤率测定
H肿瘤细胞悬液制备:取H肿瘤细胞,3 000 r/min离心10 min,用无菌生理盐水冲洗肿瘤细胞3 次,稀释5 倍,取40 μL细胞悬液加入10 μL质量分数0.4%台酚蓝染液,控制细胞浓度为3.0×10个/mL。
动物饲养及荷瘤小鼠模型构建:小鼠雌雄分笼,正常适应性饲养7 d(温度保持(22±2)℃,相对湿度保持(50±10)%,噪音小于60 dB,模拟白天和晚上的时间各为12 h,自由进食和饮水)。适应性饲养结束后,将小鼠雌雄各半并随机分为每10 只一组,共6 组。除正常组外,其余各组小鼠一次性颈后皮下注射0.2 mL肿瘤细胞悬液进行造模,7 d后观察小鼠颈后是否有明显肿块,并剔除造模失败的小鼠。1 d后对造模成功的小鼠进行灌胃处理,正常组和模型组:灌胃0.3 mL纯净水;阳性对照组:灌胃0.3 mL质量浓度1 mg/mL CTX药剂;PFSP-1组:灌胃0.3 mL质量浓度1 mg/mL PFSP-1溶液;PFSP-2组:灌胃0.3 mL质量浓度1 mg/mL PFSP-2溶液;PFSP-3组:灌胃0.3 mL质量浓度1 mg/mL PFSP-3溶液。
各实验组小鼠连续灌胃10 d,末次给药1 d后断颈处死并称体质量,摘除脾脏和胸腺用滤纸吸干血液,同时将实体瘤剥离,称质量,根据公式(1)~(3)分别计算脾指数、胸腺指数和抑瘤率。

1.3.7 血清细胞因子及肿瘤细胞蛋白质量浓度测定
将PFSP-2设定低、中、高剂量组,进一步探究PFSP-2对荷瘤小鼠血清细胞因子和肿瘤细胞蛋白的影响。低剂量组:灌胃0.1 mL质量浓度1 mg/mL PFSP-2溶液;中剂量组:灌胃0.3 mL质量浓度1 mg/mL PFSP-2溶液;高剂量组:灌胃0.5 mL质量浓度1 mg/mL PFSP-2溶液。
采用酶联免疫吸附测试法测定小鼠血清中细胞因子质量浓度。各实验组小鼠眼廓采血,3 000 r/min离心20 min取血清。按照试剂盒方法测定IL-2、TNF-α、IL-10、LDH及ALD的质量浓度。
按照试剂盒说明书收集肿瘤细胞,抽提细胞总蛋白,测定蛋白浓度。将蛋白放置在聚丙稀酰胺凝胶电泳膜上,并依次孵育一抗、二抗,经显影及定影后置于成像分析系统。扫描蛋白条带灰度,分析及比较各样本的目的蛋白及参照蛋白条带灰度,计算蛋白相对表达量。
1.3.8 肿瘤细胞形态观察
将肿瘤组织固定于体积分数10%甲醛溶液中渗透12 h,脱水后石蜡包埋,切片后利用苏木精-伊红(hematoxylin-eosin,HE)染色法进行染色,显微镜下观察肿瘤组织细胞形态(400×)。
1.4 数据统计与分析
使用SPSS 16.0软件进行分析,采用单因素方差分析(ANOVA)对所有数据进行统计学分析,所有实验重复进行3 次,结果用平均值±标准偏差表示,进行Fisher最小显著性差异检验和检验。<0.05表示具有统计学意义。
2 结果与分析
2.1 PFSP分离纯化组成
紫苏粕中粗多糖的得率为8.38%。粗多糖为浅棕色且呈海绵多孔状,室温下微溶于水。PFSP分离纯化结果如图1所示,利用DEAE-52纤维素柱对PFSP进行分离,粗多糖主要由3 种多糖组分构成,分别通过蒸馏水、0.2、0.4 mol/L NaCl溶液洗脱得到,说明组分1为中性多糖、组分2和3为酸性多糖。利用Sephadex G-100层析柱对3 种粗多糖组分进行纯化,每个粗多糖组分均为单一且较宽的洗脱峰。各多糖组分冷冻干燥后称质量,分别占粗多糖的23.22%、28.15%和20.32%。
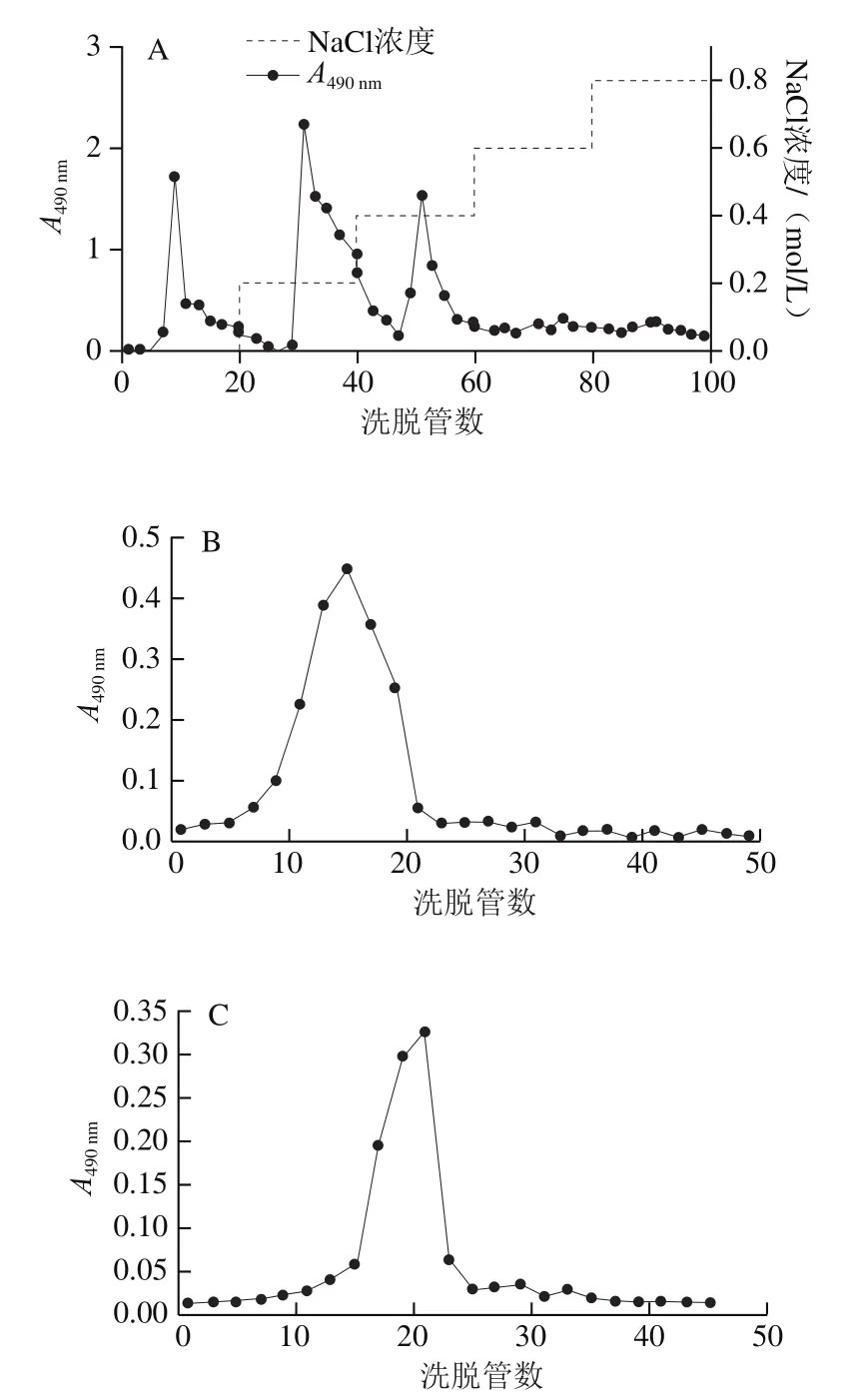
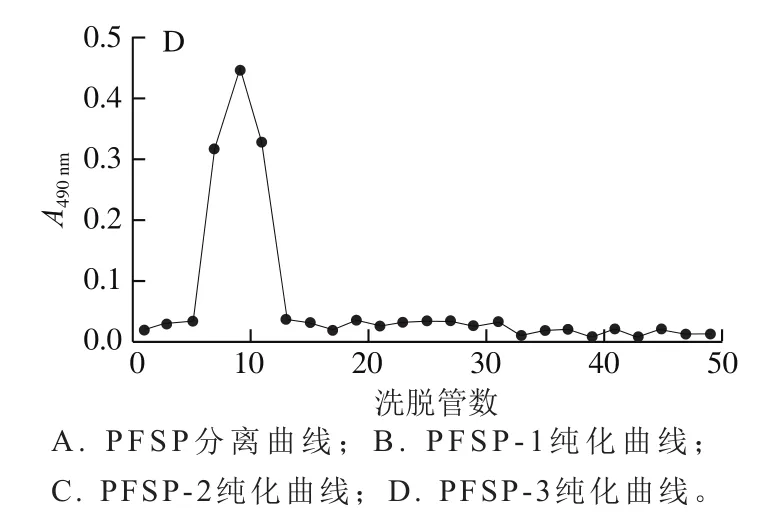
图1 PFSP的分离和纯化Fig. 1 Isolation and purification of Perilla frutescens seed polysaccharide
2.2 PFSP各组分相对分子质量
PFSP各组分经Sephadex G-200层析柱和苯酚-硫酸法跟踪检测,通过葡聚糖标准曲线方程=-1.763 2+7.171 3(=0.982 9),得到PFSP-1相对分子质量约为1.06×10,PFSP-2相对分子质量约为5.96×10,PFSP-3相对分子质量约为3.72×10。
2.3 PFSP各组分单糖组成
利用HPLC得到混合单糖标准品HPLC图(图2),并通过与单糖标准品HPLC图对比分析,可得到各多糖组分的单糖组成(图3)。由图3可知,PFSP-1由甘露糖、半乳糖、木糖和阿拉伯糖组成,其物质的量之比为0.01∶0.06∶0.11∶0.81;PFSP-2由甘露糖、木糖和阿拉伯糖组成,其物质的量比为0.28∶0.28∶0.41;PFSP-3由鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖组成,其物质的量之比为0.013∶0.024∶0.040∶0.080∶0.120∶0.700。由此可知,3 种多糖组分是由不同单糖及不同物质的量之比组成的杂多糖。
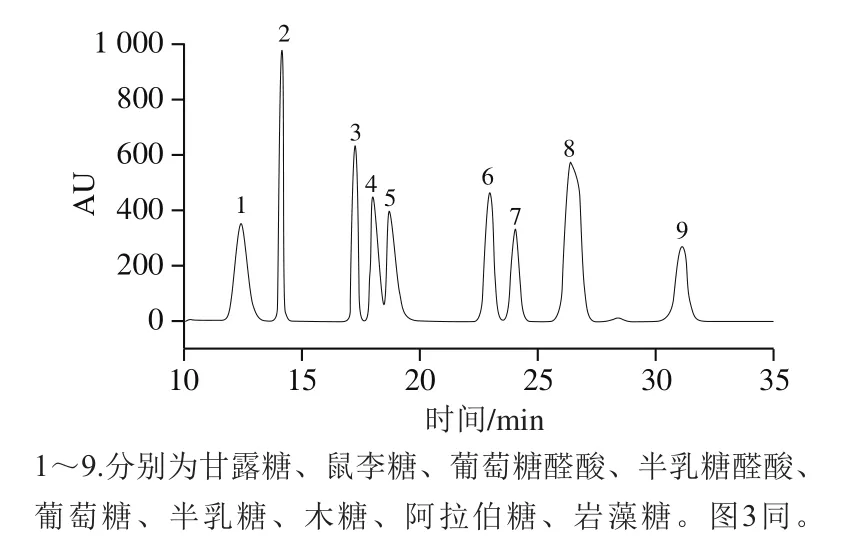
图2 混合单糖标准品HPLC图Fig. 2 High performance liquid chromatogram of mixed monosaccharide standard
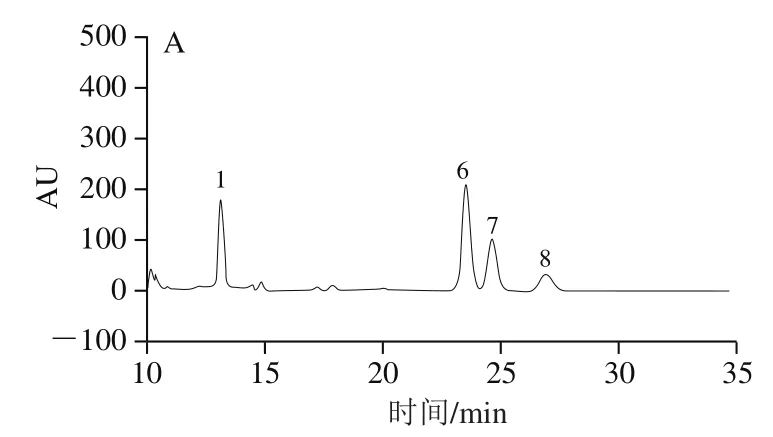
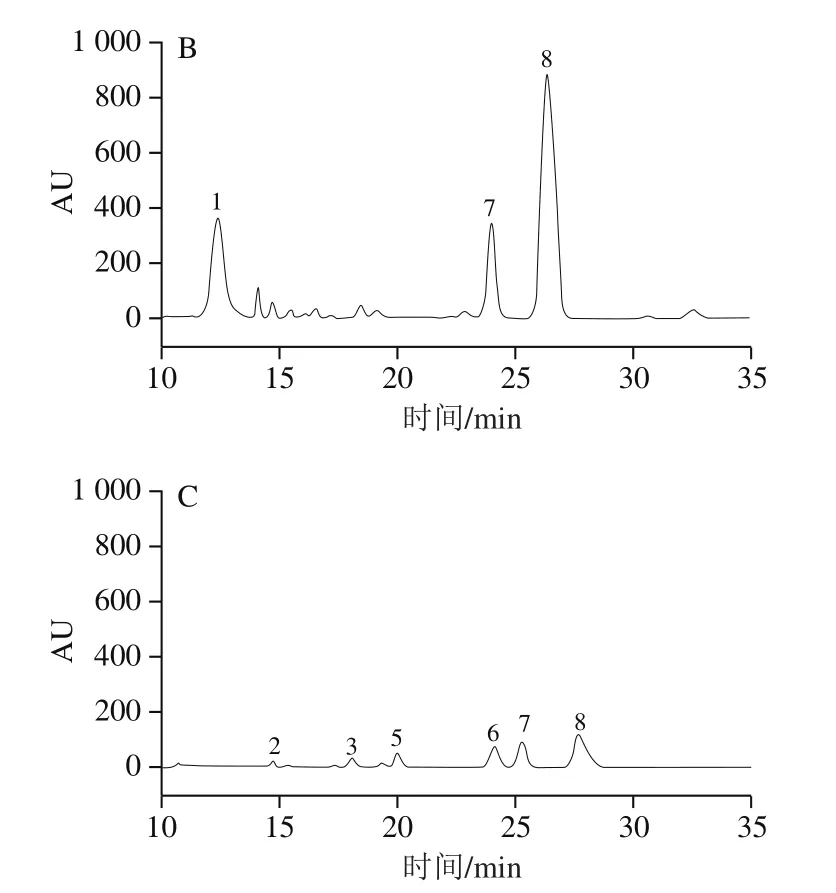
图3 PFSP-1(A)、PFSP-2(B)和PFSP-3(C)HPLC图Fig. 3 High performance liquid chromatograms of PFSP-1 (A), PFSP-2 (B)and PFSP-3 (C)
2.4 PFSP各组分傅里叶变换红外光谱分析
PFSP-1、PFSP-2和PFSP-3红外光谱如图4所示,各组分均具有多糖特征吸收峰,且PFSP-2特征吸收峰强度明显高于其他组分。在3 440 cm和2 925 cm处的吸收峰均为糖类化合物的特征吸收峰,分别是由于—OH拉伸振动和—CH或—CH中C—H的拉伸和弯曲振动引起,表明多糖中存在分子内和分子间氢键;在1 640 cm处的强吸收峰是C=O的不对称伸缩振动;在1 420 cm处的强吸收峰为变形的C—H键振动峰;在1 050 cm处的特征吸收峰,证明PFSP-1、PFSP-2和PFSP-3均含有吡喃糖环,为吡喃环型多糖。除以上均出现的吸收峰外,PFSP-2在1 250 cm和1 075 cm处存在吸收峰,说明在PFSP-2中含有C—O糖苷键,且分子中含有硫酸根。
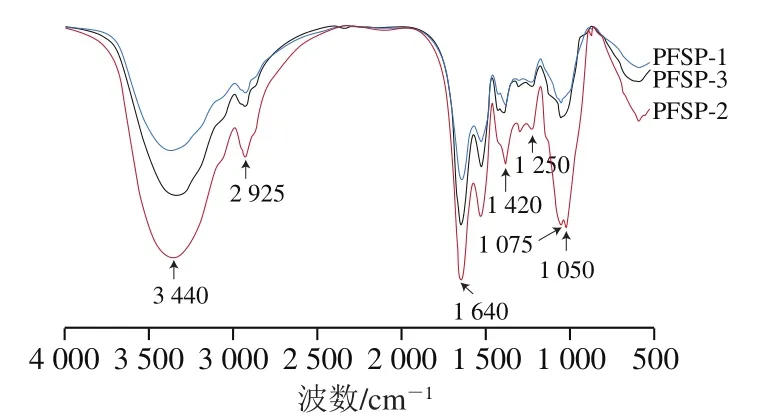
图4 PFSP-1、PFSP-2和PFSP-3傅里叶变换红外光谱图Fig. 4 Fourier transform infrared spectra of PFSP-1,PFSP-2 and PFSP-3
2.5 PFSP对小鼠免疫器官指数及抑瘤率的影响
免疫功能的下降与肿瘤的发生息息相关,脾指数和胸腺指数可反映机体免疫机能的强弱。如图5A、B所示,与正常组相比,模型组脾指数和胸腺指数均显著降低(<0.05),说明肿瘤细胞使小鼠的脾脏和胸腺生长发育受到抑制,进而造成脾脏和胸腺的质量降低。PFSP-1、PFSP-2组和PFSP-3组小鼠脾指数和胸腺指数均显著高于阳性对照组(<0.05),与正常组无显著差异(>0.05),表明PFSP能减少肿瘤细胞对小鼠脾脏和胸腺的损伤,使免疫器官质量增加,这与Liu Yanhong等的研究结果一致。3 个PFSP处理组间脾指数与胸腺指数也存在差异,但均呈现PFSP-2>PFSP-1>PFSP-3,说明PFSP-2对免疫器官的保护作用优于其他多糖组分。
如图5C所示,PFSP-2抑瘤率为30.14%,显著高于其他两组分(<0.05),这与脾指数和胸腺指数的变化趋势一致。在相同剂量浓度下,香菇多糖抑瘤率为23.31%,根据中草药抗肿瘤有效性的标准(抑瘤率>30%),说明PFSP-2具有较好的抑制肿瘤生长的作用。
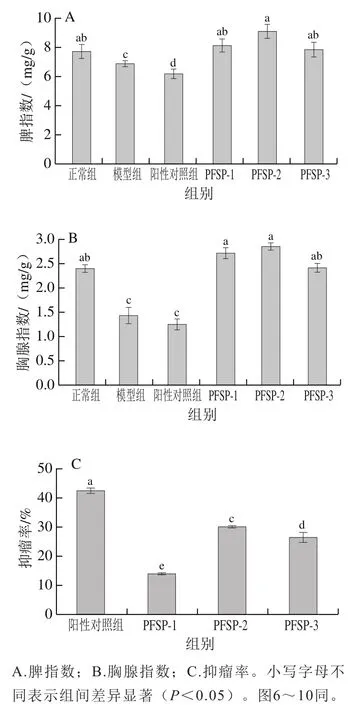
图5 PFSP对小鼠免疫器官指数及抑瘤率的影响Fig. 5 Effect of PFSP on immune organ indexes and tumor inhibition in mice
PFSP-2组免疫器官指数及抑瘤率均高于其他多糖组分,因此,本实验进一步探讨PFSP-2对H荷瘤小鼠免疫细胞因子和肿瘤细胞的影响。
2.6 PFSP-2对荷瘤小鼠血清细胞因子质量浓度的影响
细胞因子来源广泛,主要由造血系统和免疫系统等途径产生,可调节细胞增殖和分化,在不影响其他正常细胞生长和增殖的情况下,可杀伤肿瘤细胞。
2.6.1 PFSP-2对IL-2质量浓度的影响
如图6所示,随着PFSP-2剂量的增加,IL-2质量浓度逐渐上升,具有正向调节作用。模型组IL-2质量浓度显著低于正常组(<0.05),说明模型组肿瘤细胞生长,证明荷瘤小鼠建模成功。PFSP-2高剂量组IL-2质量浓度达到133.75 pg/mL,显著高于模型组(<0.05),与阳性对照组(质量浓度141.53 pg/mL)和正常组(质量浓度159.27 pg/mL)差异不显著(>0.05),说明高剂量PFSP-2增强了免疫因子的调节作用,推测是由于IL-2调节了T细胞和巨噬细胞的功能,使机体免疫系统的保护能力增强,进而对肿瘤细胞的生长起到了抑制效果。
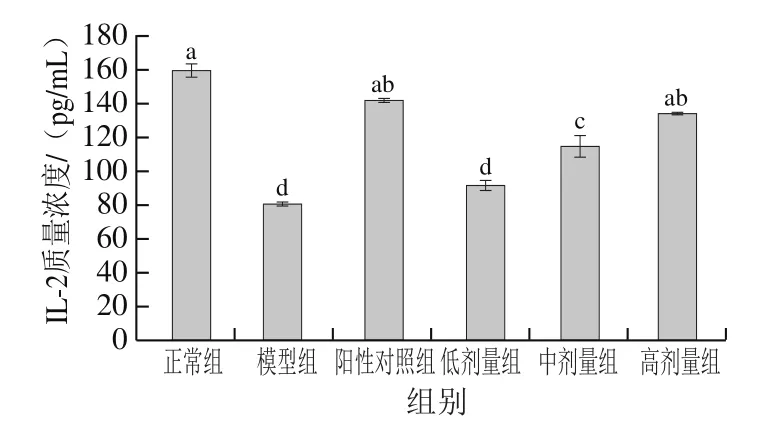
图6 不同剂量PFSP-2对荷瘤小鼠血清中IL-2质量浓度的影响Fig. 6 Effect of PFSP-2 at different concentrations on serum IL-2 concentration in tumor bearing mice
2.6.2 PFSP-2对TNF-α质量浓度的影响
如图7所示,随着PFSP-2剂量的增加,TNF-α质量浓度逐渐上升。PFSP-2低剂量、中剂量和高剂量组TNF-α质量浓度均显著高于模型组(质量浓度103.77 pg/mL)(<0.05),分别提高了53.59%、93.47%和130.74%,但显著低于阳性对照组和正常组(<0.05)。PFSP-2可能是通过促使TNF-α表达量升高,使肿瘤细胞的相关蛋白变性失活,使肿瘤细胞的生长受到抑制而无法存活。TNF-α质量浓度变化同IL-2呈现相同趋势,是由于TNF-α可促使巨噬细胞等免疫细胞活性增强,进一步使IL分泌量增加,两者协同促使肿瘤细胞凋亡。
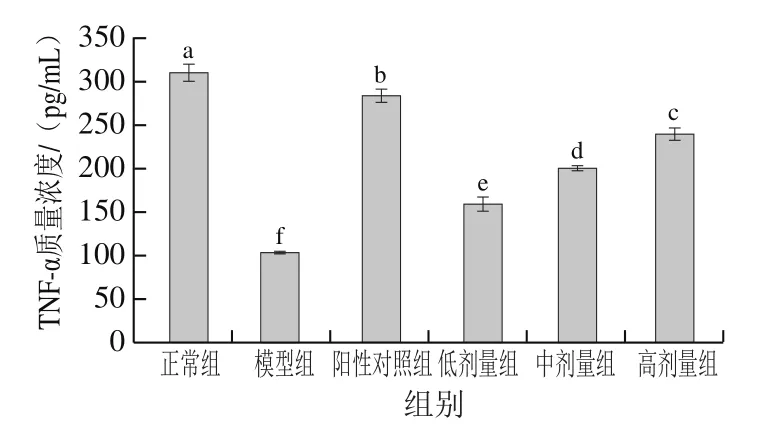
图7 不同剂量PFSP-2对荷瘤小鼠血清中TNF-α质量浓度的影响Fig. 7 Effect of PFSP-2 at different concentrations on serum TNF-α concentration in tumor bearing mice
2.6.3 PFSP-2对IL-10质量浓度的影响
如图8所示,随着PFSP-2剂量的增加,IL-10质量浓度逐渐降低,具有反向调节作用。PFSP-2低剂量、中剂量和高剂量组IL-10质量浓度显著低于模型组(<0.05),且PFSP-2高剂量组与阳性对照组无显著差异(>0.05),说明高剂量PFSP-2可大幅降低IL-10水平,与CTX治疗效果相当。各实验组IL-10质量浓度显著高于正常组(<0.05),说明各实验组荷瘤小鼠有肿瘤细胞生长,血清IL-10质量浓度升高,阳性对照组和高剂量组IL-10质量浓度上升较慢,说明肿瘤细胞数量减少。由此可知,当免疫系统启动时,IL-10质量浓度升高,以减轻外来异物对机体造成的损伤。IL-10可使巨噬细胞等多种免疫细胞产生细胞因子的能力受到抑制,抑制TNF-α的产生,IL-10质量浓度与本研究TNF-α变化趋势相反,这与Zhang Shaopeng等的研究结论一致。
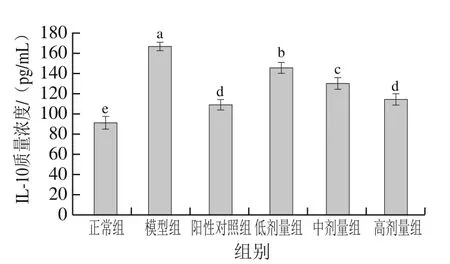
图8 不同剂量PFSP-2对荷瘤小鼠血清中IL-10质量浓度的影响Fig. 8 Effect of PFSP-2 at different concentrations on serum IL-10 concentration in tumor bearing mice
2.7 PFSP-2对LDH、ALD质量浓度的影响
如图9所示,随着PFSP-2剂量的增加,LDH和ALD的质量浓度逐渐降低,具有反向调节作用。与模型组相比,PFSP-2各剂量组LDH及ALD质量浓度均显著降低(<0.05),LDH质量浓度分别降低了21.96%、31.57%和41.91%,ALD质量浓度分别降低了17.84%、29.39%和43.96%。小鼠经接种肿瘤细胞悬液造模成功后,模型组LDH、ALD质量浓度显著升高,阳性对照组LDH、ALD质量浓度显著低于模型组(<0.05),说明CTX可降低肿瘤细胞的损伤作用,各剂量PFSP-2也具有降低LDH、ALD质量浓度的作用,但与阳性对照组相比,效果差异显著(<0.05)。
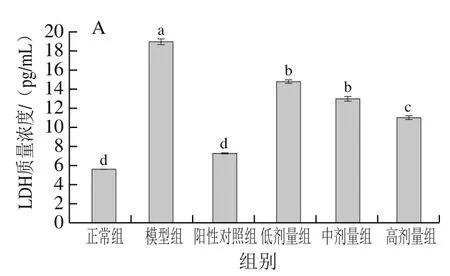
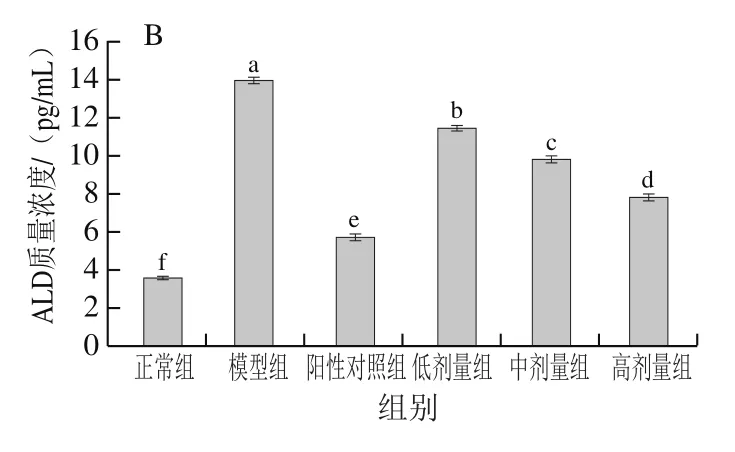
图9 不同浓度PFSP-2对荷瘤小鼠血清中LDH(A)和ALD(B)质量浓度的影响Fig. 9 Effect of PFSP-2 at different concentrations on LDH (A) and ALD (B) concentrations in tumor bearing mice
2.8 PFSP-2对细胞凋亡相关蛋白表达量的影响
由图10A、B可知,模型组,阳性对照组及PFSP-2低、中、高剂量组Bax相对表达量依次为0.03、0.45、0.04、0.08和0.23,Bcl-2相对表达量依次为1.26、0.26、0.71、0.55和0.36。与模型组相比,PFSP-2中剂量组和高剂量组Bax相对表达量显著提高(<0.05),而PFSP-2低剂量、中剂量组和高剂量组Bcl-2相对表达量显著降低(<0.05),由此说明,PFSP-2可上调肿瘤细胞中Bax蛋白的表达,下调Bcl-2蛋白的表达,即PFSP-2可增大肿瘤细胞中Bax/Bcl-2比例,比例的增大表示对肿瘤细胞的促凋亡作用增大。蛋白免疫印迹分析结果表明(图10C),PFSP-2各剂量组肿瘤细胞Bcl-2蛋白条带灰度逐渐变浅,说明Bcl-2表达量逐渐减少,而Bax相对表达量变化与Bcl-2相反。

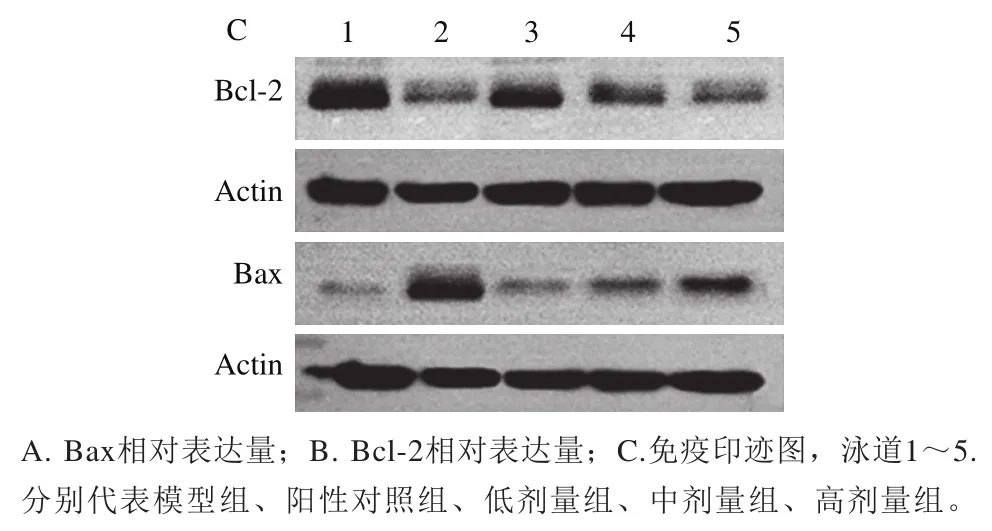
图10 不同浓度PFSP-2对荷瘤小鼠肿瘤细胞蛋白Bax、Bcl-2相对表达量的影响Fig. 10 Effect of PFSP-2 at different concentrations on the relative expression levels of Bax and Bcl-2 in tumor cells
2.9 PFSP-2对荷瘤小鼠肿瘤组织细胞形态的影响
各组小鼠肿瘤组织细胞切片结果如图11所示,经HE染色后肿瘤细胞的细胞核和细胞质呈现蓝色和粉红色。模型组肿瘤细胞形态比较整齐、结构清晰,肿瘤细胞异型性强,多见分裂相;阳性对照组肿瘤细胞出现细胞核固缩变小和染色加深等类似凋亡的特征,可见多处发生细胞坏死现象;随着PFSP-2剂量增加,肿瘤细胞逐渐疏松并膨大,直至破裂死亡,细胞质溶出,并伴有空泡产生。同时还能发现,PFSP-2组细胞凋亡现象与阳性对照组不同,这可能是由于两种不同作用机制所导致的细胞凋亡。综上,可推测PFSP-2可以通过调节机体内细胞因子分泌增强免疫调节能力,使肿瘤细胞发生破裂死亡。
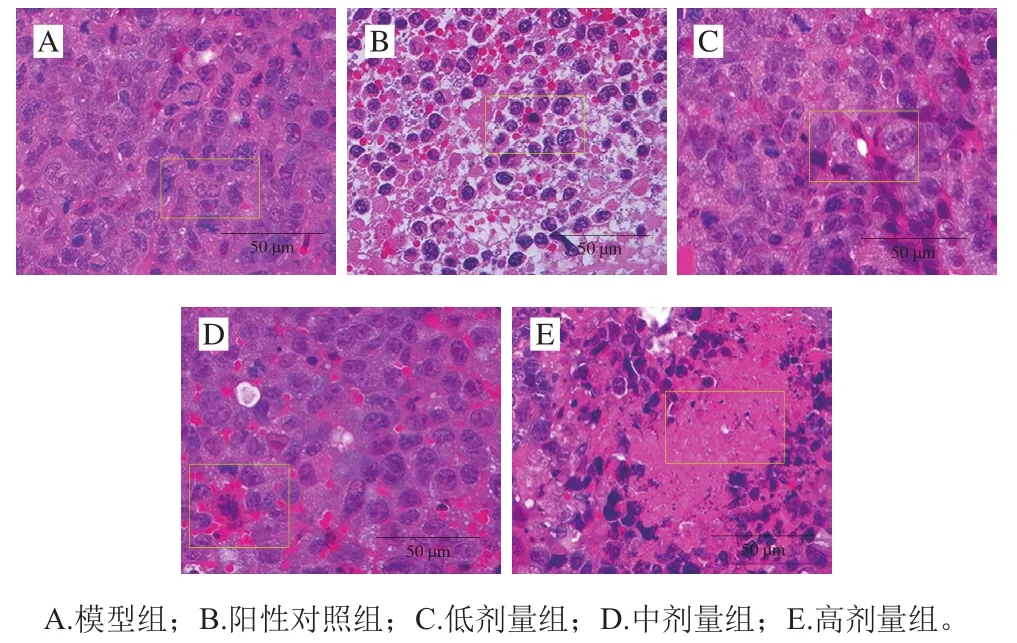
图11 H22荷瘤小鼠肿瘤组织细胞形态(400×)Fig. 11 Histomorphological results of tumor tissues in H22 tumorbearing mice (400 ×)
3 结 论
本实验从紫苏粕中提取粗多糖,经DEAE-52纤维素和葡聚糖G-100柱层析分离纯化后得到3 个组分,分别为中性多糖PFSP-1、酸性多糖PFSP-2和PFSP-3,这3 种多糖组分相对分子质量分别约为1.06×10、5.96×10、3.72×10。单糖组成分析得出,3 种多糖为多种不同单糖构成的杂多糖。傅里叶变换红外光谱表明,3 种多糖均具有多糖的特征性吸收峰,且推断出3 种多糖可能均属于吡喃环型多糖。免疫器官指数及抑瘤率结果表明,3 种多糖均可使模型小鼠脾指数和胸腺指数提高,PFSP-2提升幅度明显,且抑瘤率显著高于PFSP-1和PFSP-3。各剂量PFSP-2均可使荷瘤小鼠血清IL-2、TNF-α质量浓度显著升高(<0.05),IL-10质量浓度显著降低(<0.05),且变化趋势均呈剂量依赖性,说明PFSP-2能提高IL-2对淋巴细胞的刺激,起到预防和控制癌细胞增殖的作用;PFSP-2能促使T细胞杀伤肿瘤细胞,导致TNF-α质量浓度升高;PFSP-2可通过抑制IL-10质量浓度升高,减轻单核巨噬细胞的特异性免疫功能受损。荷瘤小鼠血清LDH、ALD质量浓度随PFSP-2剂量的升高而降低,说明PFSP-2可减轻肿瘤细胞的损伤,进而减少正常细胞破裂的发生。PFSP-2可下调荷瘤小鼠肿瘤细胞Bcl-2蛋白表达且上调Bax蛋白表达。肿瘤组织切片细胞形态表明,PFSP-2使肿瘤细胞产生膨大破裂导致凋亡,与CTX相比显示出不同的抑瘤机制。以上实验结果表明PFSP-2具有较好的抑瘤效果,推测可能是由于PFSP-2可更好地激活或调节免疫细胞产生细胞因子的能力,并通过免疫机制致使肿瘤细胞凋亡。PFSP有望开发为新型抗肿瘤药物佐剂。
