锂电池高比能量正极材料Cr8O21的制备及应用
2022-09-01陈淼淼邵钦君
锂离子电池具有能量密度高、循环寿命长和工作电压高等优点,被广泛应用于各种数码电子设备、电动汽车和电网储能等领域。在锂离子电池中,正极材料是决定其电化学性能的关键材料之一。因此,为满足对电池能量密度和功率密度日益增长的需求,研究开发新的高性能正极材料至关重要
。高价态铬基氧化物,由于可能的三电子反应具有较高的放电比容量,而被广泛关注。
CrO
中Cr元素虽为最高价态+6价,具有最高的理论比容量,但氧化性极强,易与电解液中的有机溶剂发生副反应并腐蚀集流体,难以用作电池的正极材料。已有研究显示,CrO
不完全分解的产物Cr
O
具有优良的稳定性
。Cr
O
中包含6 个Cr(Ⅵ)和2个Cr(Ⅲ),平均价态+5.25,其中Cr(Ⅵ)具有电化学活性
。如果Cr
O
中的6个Cr(Ⅵ)全部被还原为Cr(Ⅲ)时,材料的理论比容量可达642 mAh/g,是一种具有潜在应用前景的高比容量正极材料。
Cr
O
通常通过热解CrO
制得。CrO
在高温下分解析出氧气,生成Cr 的系列氧化物。当达到分解温度,CrO
首先分解生成Cr
O
,随着反应温度的提高,逐步生成Cr
O
、Cr
O
、CrO
和Cr
O
等系列铬的氧化物
,其中Cr
O
的平均价态最高。当上述材料用作电池正极时,Cr
O
表现出最高的放电比容量,且具有最高的放电电压平台
。然而,Cr
O
是CrO
热解的亚稳态中间产物,可以稳定存在的温度范围较窄(250~270℃),因此制备纯相的Cr
O
具有挑战性
。为获得纯相的Cr
O
,通常在高压或常压氧气气氛中热解CrO
,一方面实现CrO
完全分解,同时控制反应的进行程度和反应速率,抑制低价态Cr 氧化物的生成。例如,Arora等
将CrO
在500 psi(pounds per square inch, 1 psi=6.895 kPa)的高氧压反应釜中加热至270℃,制得的产物中Cr的平均价态为+5.28,仍含有未分解的CrO
。在0.1 mA/cm
的电流密度下,该材料首次放电比容量约为255 mAh/g。高温、高压氧反应工艺,使得操作难度和风险均较大。对于产物中未分解的CrO
,尽管可以采用去离子水或有机溶剂洗涤产物除去,但由于Cr
O
的层间距较大,水分子可能会破坏其晶体结构,导致材料的电化学性能下降
。因此,采用热解CrO
制备Cr
O
,热解反应的反应条件对产物的组成和电化学性能具有重要影响。同时,Cr
O
首次充放电的不可逆容量较大,且循环稳定性较差,50次循环后的可逆容量保持率仅约91%
。因此,目前Cr
O
通常用作一次电池的正极材料。此外,Cr
O
的电化学反应机理
尚不明确。
新鲜的黄牛肉呈棕色或暗红,剖面有光泽,结缔组织为白色,脂肪为黄色,肌肉间无脂肪杂质;新鲜的绵羊肉,肉质较坚实,颜色红润,纤维组织较细,略有些脂肪夹杂其间,膻味较重;新鲜的山羊肉,肉色比绵羊的肉质厚、略白,皮下脂肪和肌肉间脂肪少,膻味较轻。
针对上述问题,本工作在空气气氛中热解CrO
制备铬的氧化物,考察了反应温度和反应时间对产物组成和电化学性能的影响。优化合成方法,通过两步热解法制得了纯相Cr
O
,研究了其作为锂电池正极材料的充放电特性,并利用非原位XPS和XRD 技术研究了充放电过程中Cr
O
的电化学反应机制。
2016年,国家三部委出台了《住房城乡建设部 国家发展改革委 财政部关于开展特色小镇培育工作的通知》,这一通知的发布迎来了特色小镇建设的新纪元。截至目前,特色小镇已遍地开花。
1 实验方法
1.1 材料制备
称取约2.0 g 的CrO
(伊诺凯,99.50%)置于管式炉中,在空气气氛中,分别在260℃、270℃、280℃、300℃和320℃进行热解反应,升温速率5℃/min,保温12h。自然冷却后取出产物,在玛瑙研钵中研磨得到铬氧化物粉末。将产物分别记为260℃-12h、270℃-12h、280℃-12h、300℃-12h 和320℃-12h。将CrO
分别在260℃和270℃保温24h,产物分别记为260℃-24h 和270℃-24h;在270℃保温6h,产物记为270℃-6h。
将上述5 种产物样品制成扣式电池,以0.1 C倍率进行恒流放电测试。如图3(a)所示,样品260℃-12h、270℃-12h、280℃-12h、300℃-12h和320℃-12h的首次放电比容量分别为267.4 mAh/g、367.0 mAh/g、377.7 mAh/g、361.7 mAh/g 和216.0 mAh/g。样品320℃-12h 由于含有较多Cr
O
,材料的比容量显著降低。而260℃-12h 样品则由于残留未分解的CrO
,与电解液发生副反应,导致材料的电化学性能较差。
采用SPSS17.0软件处理实验数据,计数资料用%表示,采用χ2检验。(P<0.05差异有统计学意义)。
1.2 材料表征
课堂规则制定了,但是学生个性迥异,不是每个学生都会认真的遵守,这就要求教师要做好课堂监督,要预防和发现课堂中出现的一些纪律问题,教师要针对出现的纪律问题采取语言提示或目光的接触等方式提醒学生注意自己的行为。严格执行课堂规则,发挥规则的应有作用。
1.3 电池组装及电化学测试
将纯相Cr
O
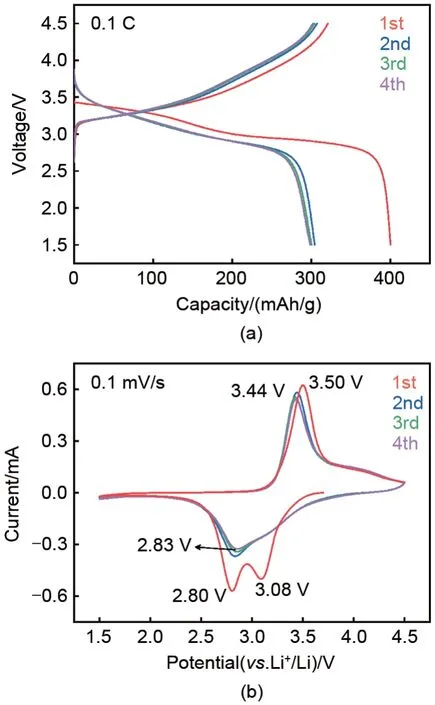
(260/270℃-2h)电池在0.1 C 倍率下进行充放电测试,图7(a)为前四圈充放电曲线。可以看出,Cr
O
材料的首次放电曲线分别在3.3 V 和2.9 V 附近出现两个电压平台;在随后的充放电过程中,放电容量衰减,出现在3.3 V 附近的电压平台几乎消失。所制备的Cr
O
材料的首次放电比容量为400.4 mAh/g,首次充电比容量为321.0 mAh/g,首圈不可逆容量为79.4 mAh/g,约占首次放电比容量的19.8%,优于文献[11]报道的29.0%。材料的第2~4圈充放电曲线比较重合,表明所制备的Cr
O
具有良好的可逆性。
使用PARSTAT MC 型多通道电化学工作站测试电池的循环伏安(CV)曲线和电化学阻抗谱(EIS),电势扫描速率为0.1 mV/s,测量的频率范围为0.1~10
。采用武汉蓝电CT2001A 型电池测试仪测试电池的恒流充放电性能。材料的比容量基于极片中Cr
O
的质量计算。所采用的充放电倍率基于Cr
O
的理论比容量642 mAh/g计算。
2 结果与讨论
2.1 热重分析
为揭示Cr
O
的充放电反应机制,首先对不同荷电状态的Cr
O
极片进行非原位XPS测试,考察在充放电过程中Cr
O
中Cr元素的价态变化(图8)。可以看出,在充放电后Cr
O
中的Cr元素只以Cr
和Cr
形式存在,没有观察到中间价态的Cr
和Cr
。将电池首次放电至1.5 V,Cr
O
中Cr
的峰强度减弱,Cr
峰增强。表明锂化后,仅部分Cr
被还原为Cr
,仍有部分Cr
无法被还原。当充电至4.5 V 时,Cr
的峰强度减弱,Cr
的峰强度增加,即Cr
又重新被氧化成Cr
。但与初始Cr
O
相比,满电态样品中的Cr
的峰强度有所降低,而Cr
的峰强度有所增加。说明首次放电过程中被还原的Cr
,在充电过程中未被完全氧化,表明存在不可逆反应,这与从充放电曲线和CV 曲线得出的结论基本一致。在铬基化合物中,Cr(Ⅲ)通常是八面体配位,Cr(Ⅵ)是四面体配位
。这意味着在充放电过程中,Cr
O
中Cr元素的配位构型发生Cr(Ⅵ)-O
四面体和Cr(Ⅲ)-O
八面体的相互转变,将产生较大的晶格应力。
采用瑞士TGA/DSC 3+型同步热分析仪分析CrO
在空气气氛中的热分解过程,升温速率2℃/min。采用荷兰帕纳科X'pert Pro 型X 射线衍射仪(XRD)分析材料的组成和晶体结构,测试条件为:Cu K
射线源,扫描速率6°/min。采用日本JEOL 的JSM-7800F型扫描电子显微镜(SEM)观察材料的微观形貌。采用美国赛默飞的Escalab 250Xi 型X 射线光电子能谱(XPS)分析材料的化学价态,射线源为Al K
。
2.2 纯相Cr8O21的制备
将采用不同反应温度和反应时间制得的产物进行XRD表征。如图2(a)所示,将CrO
分别在260℃、270℃、280℃、300℃和320℃下热解12h 均制得Cr
O
(PDF:80-2473),但样品260℃-12h 在21.3°和26.1°处分别出现了CrO
(PDF:32-0285)的(011)和(120)晶面的衍射峰,表明样品中含有未分解的CrO
。而在270℃、280℃、300℃和320℃下热解12h 制得样品的XRD 谱图中,虽然没有出现CrO
的衍射峰,但在10.5°和27.3°出现了归属于Cr
O
(PDF:36-1329)的(010)和(-221)晶面的衍射峰,且热处理温度越高,这两个衍射峰的强度越高。以上实验现象表明,当热处理温度大于270℃就生成了高温相Cr
O
。
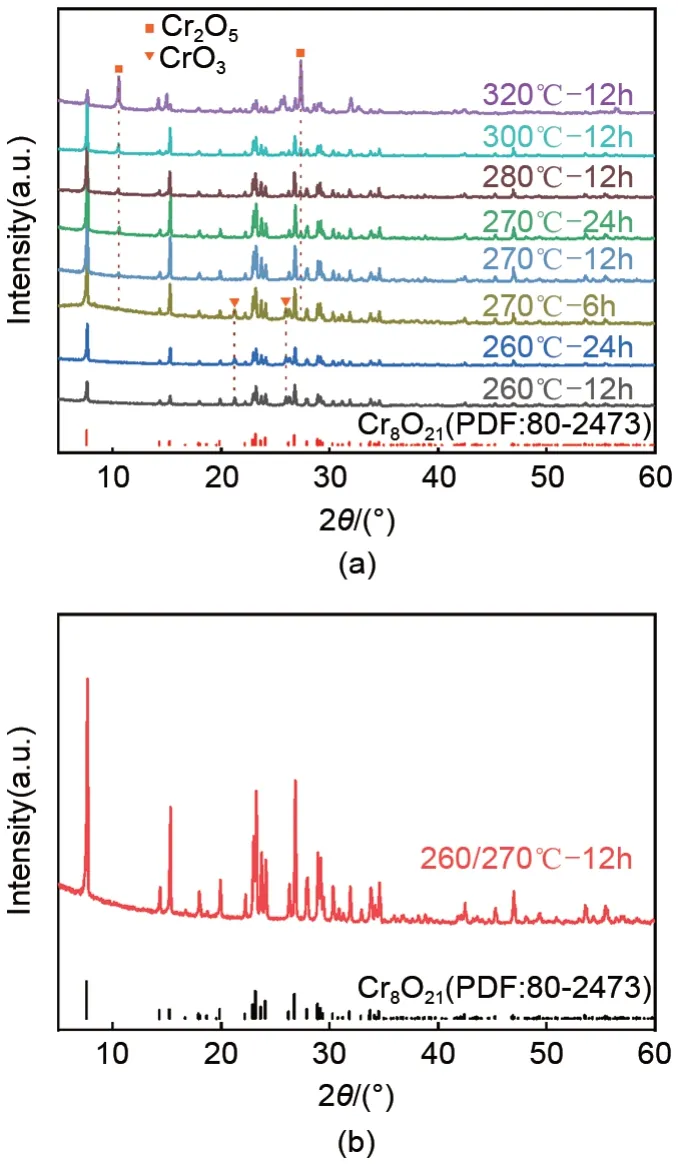
将按照上述方法制得的260℃-12h样品,进一步在270℃热解12h,产物记为260/270℃-12h。
为避免高温相的生成,同时实现CrO
的完全分解,进一步在260℃和270℃温度下热解CrO
,考察了反应时间对产物的影响。如图2(a)所示,当热解温度为260℃时,虽然延长反应时间至24h,但样品260℃-24h中仍含有未分解的CrO
。从材料的首次放电曲线[图3(b)]可以看出,样品260℃-24h的放电容量为349.0 mAh/g,较260℃-12h 样品的比容量267.4 mAh/g 明显提高。图2(a)还显示,当热解温度为270℃时,缩短热解时间至6h,产物270℃-6h 中不仅含有未分解的CrO
,还存在高温相Cr
O
。并且,样品270℃-6h的首次放电比容量仅为257.0 mAh/g,平均放电电压为2.89 V。在270℃延长反应时间至24h,产物270℃-24h 中的CrO
的衍射峰消失,但高温相Cr
O
的衍射峰增强,材料的首次放电比容量为374.4 mAh/g[图3(b)],与样品270℃-12h 基本相当。上述结果表明,在260℃时延长反应时间至24h,CrO
仍不能完全分解;在270℃时缩短反应时间至6h,仍生成了高温相Cr
O
;均未获得纯相的Cr
O
。

进一步优化反应条件,采用两步热解法制备Cr
O
,即在空气气氛中,首先将CrO
在260℃热解12h,待样品冷却后,将其研磨成粉末,并继续在270℃热解12h。得到的产物的XRD 谱图如图2(b)所示,所有衍射峰都归属于Cr
O
,未见CrO
和Cr
O
的特征峰。将CrO
在260℃热解12h 后,样品中除生成的Cr
O
,仍含有未分解的CrO
。再次研磨后,有利于未反应的CrO
与空气充分接触,在270℃热处理,通过控制反应的时间可以实现CrO
完全热解生成Cr
O
。另外,研磨处理还使得未反应的高价态的CrO
与Cr
O
均匀混合,避免已生成的Cr
O
被进一步还原成低价态的铬基氧化物,如Cr
O
等。因此,在空气气氛中,采用这种安全简单的两步热解法,既保证了CrO
的完全分解,又避免了高温相Cr
O
的生成,可制备出纯相的Cr
O
。如图3(b)所示,产物260/270℃-12h 的首次放电比容量为400.4 mAh/g,平均放电电压约为3.04 V,均明显高于采用其他条件制备的样品,表明所合成的纯相Cr
O
材料具有良好的电化学性能。
增殖细胞核抗原[13](PCNA)属于与细胞周期具有一定关联的蛋白,对机体中的相关细胞的再生过程进行调控,将其作为多聚酶的辅助因子,可以有效促使DNA聚合酶的再次出生,并使其实现细胞增生的作用。在AM中,内膜异位主要表现为周期性,增长期明显强于分泌期,无月经期[14]。内膜异位的腺上皮以及间质主要表现为水平较高,并使子宫内膜出现浸润、弥漫性生长。
2.3 Cr8O21的组成与形貌
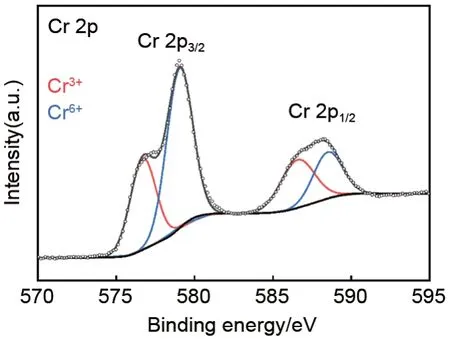
利用XPS表征所制备的纯相Cr
O
中Cr元素的化学状态,结果如图4所示。其中,Cr
O
的Cr 2p
轨道的结合能位于576.8 eV 和579.1 eV,Cr 2p
轨道的结合能位于586.6 eV 和588.6 eV,分别对应于Cr
和Cr
。这表明Cr
O
中Cr元素是Cr
和Cr
的混合氧化态,不存在中间价态Cr
和Cr
,与文献[13]报道的结果一致。
充电时,位于44.3°和64.2°处归属于LiCrO
的两个宽峰逐渐消失。同时,Cr
O
的(001)峰向低角度移动了0.1°。在第二次的放电-充电过程中,同样观察到(001)衍射峰的位移以及LiCrO
衍射峰可逆地出现和消失,证明了LiCrO
的分解和再生是材料具有可逆充放电性能的主要原因。这一点与Komaba等
的研究结果,即LiCrO
是一种电化学惰性材料不同。我们分析,这可能与首次放电后形成的产物也具有独特的三明治结构([CrO
]/LiCrO
+Li
O/[CrO
])有关,即[CrO
]和具有极小的晶粒尺寸的LiCrO
/Li
O之间存在某种相互作用,使LiCrO
具备电化学反应活性
。此外,(002)峰在首次充电结束后消失,且在后续循环过程中也未被观测到。这可能是在首次的放电-充电过程中,由于晶格应力,导致Cr
O
材料结构发生重构,有序度降低。

2.4 Cr8O21的电化学反应机理研究
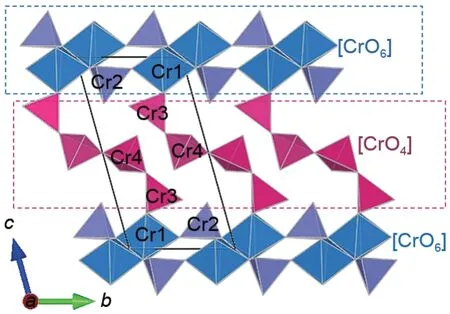
Cr
O
为三斜晶系,晶体结构包含2个Cr(Ⅲ)-O
八面体和6 个Cr(Ⅵ)-O
四面体
。如图6 所示,Cr
O
呈三明治状结构([CrO
]/[CrO
]/[CrO
]),由2 个[CrO
]亚晶格单元和1 个[CrO
]亚晶格单元组成。其中,[CrO
]亚晶格单元由共边的2个Cr(Ⅲ)-O
八面体(Cr1)与2个Cr(Ⅵ)-O
四面体(Cr2)相互连接形成;[CrO
]亚晶格单元为四铬基团链([Cr
O
]),由4 个Cr(Ⅵ)-O
四面体(Cr3 和Cr4)以共角形式连接构成。
按8∶1∶1 的质量比称取所制备的铬氧化物材料、乙炔黑(AB)和聚偏二氟乙烯(PVDF),转移至玛瑙研钵中,加入适量
-甲基吡咯烷酮(NMP),进行研磨混合,制得分散均匀的浆料。然后,使用刮刀将浆料刮涂在铝箔表面,置于75℃鼓风干燥箱中干燥4h,随后在100℃真空干燥箱中干燥12h。将干燥后的极片裁剪成直径为10 mm的圆片。将上述极片作为正极,锂片作为负极,Celgard 2500为隔膜,电解液采用1.0 mol/L LiPF
/EC∶EMC∶DMC(质量比为1∶1∶1),在氩气气氛手套箱中组装成CR2016型扣式电池。电池静置8h后,进行电化学测试。恒流放电和充电的电压范围为1.5~4.5 V。
图7(b)为Cr
O
电池的CV曲线。从首圈CV曲线的还原支可以看到,在3.08 V 和2.80 V 处分别出现两个明显的还原电流峰;在CV曲线的氧化支,位于3.50 V处出现了一个明显的氧化电流峰。在随后的CV曲线中位于3.08 V处的还原电流峰基本消失,表明这一步反应不可逆;而位于2.80 V处的还原电流峰减弱,峰电势少许正移至2.83 V,对应的氧化电流峰少许负移至3.44 V,表明这一电对的氧化还原反应的动力学有所提升。第2~4圈的CV曲线重合度较高,同样表明Cr
O
的反应可逆性较好。
CrO
在高温下分解,依次生成CrO
(Cr
O
),CrO
(Cr
O
),CrO
(CrO
)和CrO
(Cr
O
)
。为优化Cr
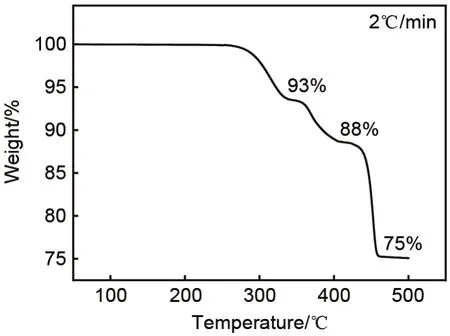
O
的合成温度,将CrO
粉末在空气气氛中,以2℃/min 的升温速率,进行热重分析。如图1 所示,当温度升至接近260℃时,CrO
开始失重,表明CrO
中部分Cr(Ⅵ)被还原并析出氧气。假设热解过程中的失重仅由析出O
所致,则热解产物Cr
O
,Cr
O
,CrO
和Cr
O
所对应的质量保持率的理论值分别为94%,92%,84%和76%。图1中,CrO
的热重曲线在330~360℃、400~430℃和>470℃出现三个平台。当温度>470℃时,CrO
分解为稳定的终产物Cr
O
,质量保持率为75%,略小于理论值76%,这可能是由于熔融的CrO
挥发所造成
。而在330~360℃和400~430℃温度区间出现了近似的平台,对应的质量保持率分别为93%和88%。似乎表明,在这两个温度区间,CrO
热解反应的中间产物共存。因此,我们选择在260~320℃的温度范围内热解CrO
,以避免生成更多的低价态铬的氧化物。
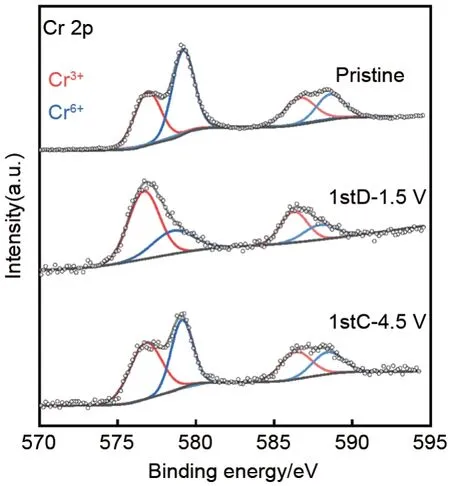
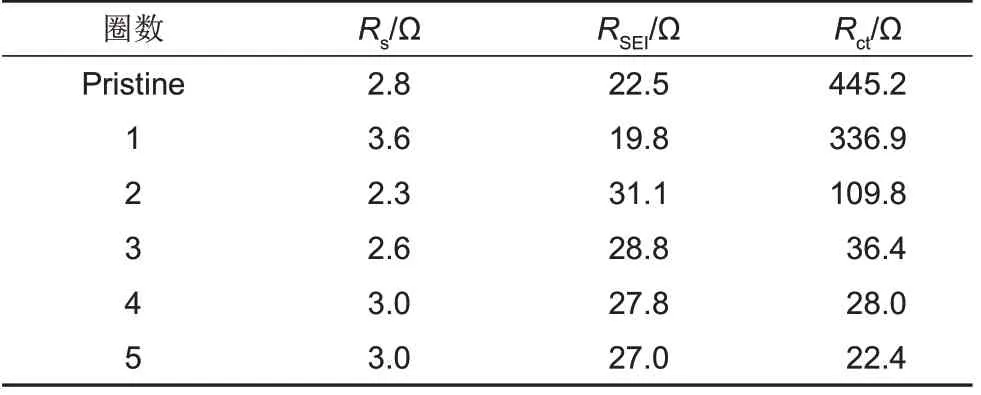
图9 是Cr
O
电池及其第1~5 次放电后的EIS谱图。从图中可以看出,所有的Nyquist 曲线都由中、高频区的半圆和低频区的直线组成。其中,高频区与
轴的截距代表电池的欧姆内阻(
),中频区的半圆包含电极材料表面膜中Li
的迁移阻抗(
)和电极反应的电荷转移电阻(
),而在低频区的直线则归因于半无限Warburg扩散。根据图中的等效电路,使用ZView软件对电化学阻抗谱进行拟合,所得结果列于表1 中。从图9 和表1 数据可知,随着放电次数的增加,电池的欧姆内阻
近乎不变;
略有增加,可能与在Cr
O
及金属锂表面生成的电解质界面层有关;而
较循环前明显降低,这可能是因为在充放电循环中,Cr
O
颗粒由于较大的晶格应力而产生裂纹,电极材料被电解液充分浸润并活化,加快了电极的反应速率
。

进一步对不同荷电状态的Cr
O
电极进行非原位XRD 测试,考察充放电过程中Cr
O
结构的变化。图10 是前2 次循环中的Cr
O
正极的XRD谱图。从图中可见,所有样品在65°附近都出现了集流体Al 的(220)峰。在首次放电曲线的第一个电压平台(3.0~3.4 V),Cr
O
的衍射峰除(001)和(002)之外,其余的逐渐减弱;当放电至3.0 V 时,这些衍射峰完全消失。(001)和(002)衍射峰代表Cr(Ⅲ)O
八面体中心的Cr1 层(见图6),这说明在嵌锂过程中,Li
嵌入[CrO
]亚晶格区的四铬基团链([Cr
O
]),而[CrO
]亚晶格层(图6 中Cr1 和Cr2)被保留。同时,(001)峰没有明显位移,表明[CrO
]亚晶格层的层间距没有发生变化。根据Cr
O
首次放电曲线第一个电压平台对应的放电比容量进行估算,这个反应涉及约3 个Li
嵌入Cr
O
。据此推测在Cr
O
电池首次放电过程中,首先发生3 个Li
嵌入[CrO
]亚晶格区的[Cr
O
],生成无定形的[Li
Cr
O
]。随着放电反应的继续进行,对应第二个电压平台区(1.5~3.0 V),XRD 谱图中在44.3°和64.2°处出现了两个新的宽峰,分别归属于LiCrO
(PDF: 24-0600)的(104)和(110)晶面
,表明[Li
Cr
O
]亚晶格进一步还原生成了LiCrO
。峰宽化的原因可能与LiCrO
形成于两个[CrO
]亚晶格层之间(层间距约为1.16 nm)导致晶粒尺寸较小有关。生成LiCrO
的同时,有可能还生成了无定形的Li
O。同时还观察到(001)峰向高角度移动了0.4°,这可能是由于LiCrO
的生成造成四铬基团链完全断裂,从而减小了[CrO
]亚晶格的层间距。
(3)热再生修补。该技术通过使用加热设备对路面进行就地热再生修补,可较好地解决接缝问题,同时提高施工质量,修补成本较低,经济效益较好。

利用扫描电镜观察所制备的纯相Cr
O
的形貌,如图5 所示。可以看到,Cr
O
材料主要由片层堆叠形成的不规则块状颗粒组成,颗粒尺寸为0.2~3 μm。这与Besenhard 等
在常压空气气氛中合成的材料的形貌相似。
BEPS行动计划的设计者和组织者应该借鉴美国和英国的成功经验,尽快将强制披露规则升级为“基本标准”,强制BEPS行动计划的参与国实施,以此强化国际税收透明度规则的约束力和质效。BEPS行动计划的参与者在国内税法对接转化强制披露规则,设计强制披露制度时,需要注意考虑以下要素:谁必须披露信息、必须申报哪些信息(申报义务的范围和内容)、何时申报信息、确认筹划方案使用者、执行及如何利用收集到的信息。同时,还要避免过度披露,避免给纳税人施加过重的遵从负担。
根据上述研究结果,我们推测在首次放电过程发生嵌入反应和转换反应,分别对应CV 曲线还原支位于3.08 V 和2.80 V 处的还原电流峰。首先,3 个Li
嵌入[CrO
]亚晶格区的[Cr
O
],生成无定形的[Li
Cr
O
],这个过程不可逆,是造成首圈不可逆容量较大的主要原因。这个过程中,Cr
O
晶体结构中的[CrO
]亚晶格层被保留,总体上呈“长程有序、短程无序”。随后,在两个[CrO
]层之间,无定形的[Li
Cr
O
]与Li
发生转换反应生成LiCrO
微晶和Li
O。充电反应是上述转换反应的逆过程,对应CV曲线氧化支位于3.50 V处的氧化电流峰。在随后的循环过程中,转换反应高度可逆。更详细的反应机制还有待进一步的研究。
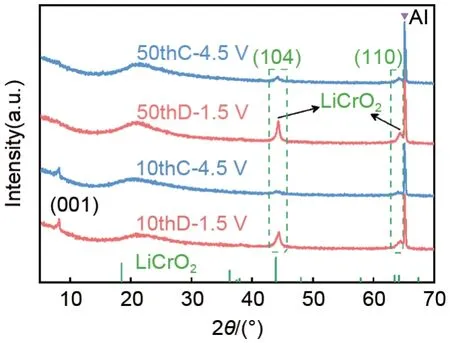
图11 为第10 次和第50 次循环后,Cr
O
极片的XRD 谱图。可以看出,10 次循环后,(001)峰的强度明显减弱;50 次循环后,(001)衍射峰完全消失;同时归属于LiCrO
的峰则有所增强。表明随着循环次数增加,亚晶格单元[CrO
]的晶体结构逐渐被破坏,同时材料的循环稳定性下降。产生这个现象的原因可能与发生在[CrO
]亚晶格区中的Cr(Ⅲ)和Cr(Ⅵ)之间的转换反应产生的晶格应力有关。
2.5 Cr8O21的电化学性能
图12(a)和(b)为纯相Cr
O
以不同倍率放电的第1和第2圈放电曲线。放电倍率分别为0.1、0.2、0.5、1.0 和2.0 C,充电倍率均为0.1 C。Cr
O
的首次放电比容量分别为400.4 mAh/g (0.1 C)、395.9 mAh/g (0.2 C)、 377.2 mAh/g (0.5 C)、363.3 mAh/g (1.0 C)和338.6 mAh/g (2.0 C)。第二次放电的比容量分别为304.4 mAh/g (0.1 C)、292.6 mAh/g (0.2 C)、 275.5 mAh/g (0.5 C)、265.4 mAh/g(1.0 C)和244.5 mAh/g(2.0 C)。材料首次放电时,2.0 C 的放电比容量为0.1 C 的84.6%;第二次放电时,2.0 C的放电比容量为0.1 C的80.3%。这些结果显示所制备的材料具有优良的倍率性能。
本次共入选受试者236例,其中试验组脱落9例、对照组脱落6例。最终208例患者进入符合方案数据集(PPS),221例患者进入全分析数据集(FAS),231例患者进入安全性数据集(SS)。全部病例均签署知情同意书。

进一步测量了Cr
O
的倍率循环性能,即将扣式电池首先在0.1 C倍率下循环10圈,然后依次以0.2 C、0.5 C、1.0 C 和2.0 C 分别循环5 圈,最后再次恢复至0.1 C。如图12(c)所示,以0.1 C、0.2 C、0.5 C、1.0 C 和2.0 C 倍率放电,材料的可逆放电比容量分别为296.5 mAh/g、 277.2 mAh/g、241.7 mAh/g、205.6 mAh/g 和153.6 mAh/g。当放电倍率重新恢复至0.1 C 时,可逆放电比容量恢复为294.2 mAh/g。表明Cr
O
材料具有较好的倍率放电性能。
图12(d)为纯相Cr
O
以0.1 C进行充放电循环的性能曲线。100次循环后,材料的可逆比容量降至269.9 mAh/g,容量保持率为88.7%(基于第二圈的可逆放电容量304.4 mAh/g计算)。经过前5次循环,材料的充放电库仑效率稳定在99%以上。与文献报道的其他铬基氧化物正极材料相比,本工作所制备的纯相Cr
O
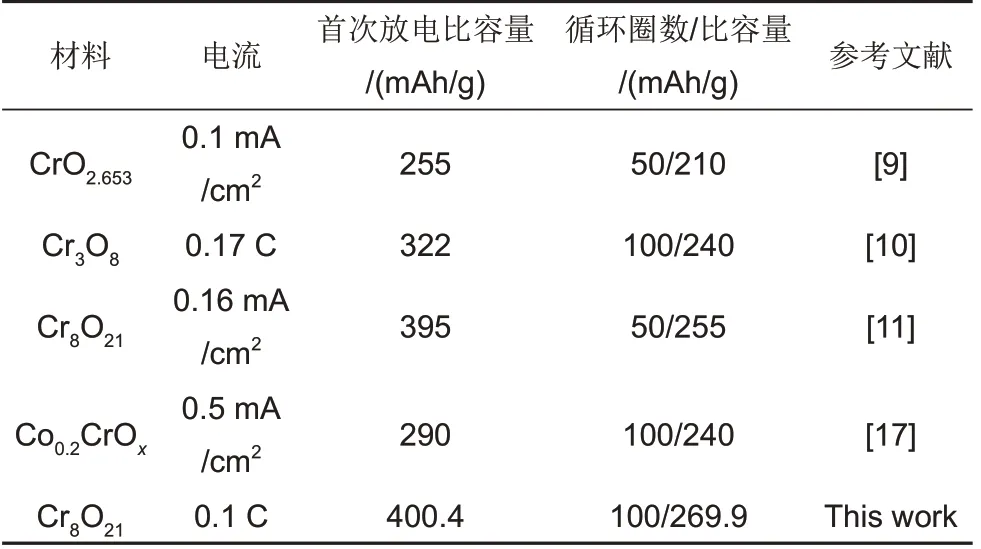
具有更高的放电比容量和循环稳定性(详见表2)。
3 结 论
在空气气氛中,通过两步热解CrO
成功制备了纯相Cr
O
。以0.1 C倍率放电,Cr
O
的首次放电比容量达400.4 mAh/g,平均放电电压为3.04 V,首圈不可逆容量仅为79.4 mAh/g,表现出良好的电化学性能。100次循环后,材料的可逆容量保持率为88.7%。材料的倍率性能优良,2.0 C的首次放电比容量为0.1 C 的84.6%。XPS 测试结果显示,Cr
O
的充放电过程发生Cr
/Cr
的三电子氧化还原反应。非原位XRD测试结果发现,在首次放电过程中,Li
嵌入[CrO
]亚晶格区中的[Cr
O
],生成无定形的[Li
Cr
O
],对应放电曲线位于3.3 V附近的第一个电压平台。这个反应也是造成材料首圈不可逆容量较大的主要原因。随着放电过程的继续,反应生成了微晶LiCrO
,且LiCrO
能够在两个[CrO
]夹层之间发生可逆的电化学氧化和还原反应,材料表现出良好的可充性。
[1] DUNN B, KAMATH H,TARASCON J M. Electrical energy storage for the grid: A battery of choices[J]. Science, 2011, 334(6058):928-935.
[2] CHU S, CUI Y, LIU N. The path towards sustainable energy[J].Nature Materials,2017,16(1):16-22.
[3] 李文俊,徐航宇,杨琪,等.高能量密度锂电池开发策略[J].储能科学与技术,2020,9(2):448-478.LI W J, XU H Y, YANG Q, et al. Development of strategies for high-energy-density lithium batteries[J]. Energy Storage Science and Technology,2020,9(2):448-478.
[4] BESENHARD J O, SCHÖLLHORN R. Chromium oxides as cathodes for secondary high energy density lithium batteries[J].Journal of the Electrochemical Society,1977,124(7):968-971.
[5] NORBY P, CHRISTENSEN A N, FJELLVÅG H, et al. The crystal structure of Cr
O
determined from powder diffraction data:Thermal transformation and magnetic properties of a chromiumchromate-tetrachromate[J]. Journal of Solid State Chemistry,1991,94(2):281-293.
[6] KUBOTA B. Decomposition of higher oxides of chromium under various pressures of oxygen[J]. Journal of the American Ceramic Society,1961,44(5):239-248.
[7] WILHELMI K A, EHRENBERG L, OLSON T, et al. Formation of chromium oxides in the Cr
O
-CrO
region at elevated pressures up to 4 kilobar[J]. Acta Chemica Scandinavica, 1968, 22: 2565-2573.
[8] TAKEDA Y, KANNO R, TSUJI Y, et al. Chromium oxides as cathodes for lithium cells[J]. Journal of Power Sources, 1983, 9(3):325-328.
[9] ARORA P. Chromium oxides and lithiated chromium oxides.promising cathode materials for secondary lithium batteries[J].Electrochemical and Solid-State Letters,1999,1(6):249.
[10]RAMASAMY R P, RAMADASS P, HARAN B S, et al. Synthesis,characterization and cycling performance of novel chromium oxide cathode materials for lithium batteries[J]. Journal of Power Sources,2003,124(1):155-162.
[11]LIU J Y, WANG Z X, LI H, et al. Synthesis and characterization of Cr
O
as cathode material for rechargeable lithium batteries[J].Solid State Ionics,2006,177(26/27/28/29/30/31/32):2675-2678.
[12]FENG G X, LI L F, LIU J Y, et al. Enhanced electrochemical lithium storage activity of LiCrO
by size effect[J].Journal of Materials Chemistry,2009,19(19):2993.
[13]TAKEDA Y, KANNO R, TSUJI Y, et al. Rechargeable lithium/chromium oxide cells[J]. Journal of the Electrochemical Society,1984,131(9):2006-2010.
[14]BESENHARD J O, SCHWAKE M, MISAILIDIS N. Modified chromium oxides for high-rate lithium intercalation cathodes[J]. Journal of Power Sources,1989,26(3/4):409-414.
[15]KOMABA S, TAKEI C, NAKAYAMA T, et al. Electrochemical intercalation activity of layered NaCrO
vs. LiCrO
[J].Electrochemistry Communications,2010,12(3):355-358.
[16]ZHAO D,QIN J W,ZHENG L R,et al.Amorphous vanadium oxide/molybdenum oxide hybrid with three-dimensional ordered hierarchically porous structure as a high-performance Li-ion battery anode[J].Chemistry of Materials,2016,28(12):4180-4190.
[17]ZHANG D, POPOV B N, PODRAZHANSKY Y M, et al. Cobalt doped chromium oxides as cathode materials for secondary lithium batteries[J]. Journal of Power Sources, 1999, 83(1/2):121-127.
