绵羊Myl3基因启动子区的克隆、分析及蛋白表达
2022-08-31张春兰
张春兰
(潍坊学院 生物与海洋学院,山东 潍坊 261061)
肌球蛋白轻链3基因(Myosin light chain3,Myl3)是动物体肌肉组织中编码肌球蛋白的基因之一。研究发现该基因及其编码蛋白(MYL3)主要在小鼠[1]和牛[2]的心肌细胞中表达,MYL3蛋白C端Ser残基的磷酸化与心肌收缩有关[3],并且发现该基因突变与心肌的增生有密切关系[4~6]。
虽然大量研究表明该基因在心肌的分化和发育中发挥了重要作用,但是对其表达调控的研究甚少,在羊上还鲜有报道。前期研究中在绵羊骨骼肌组织中利用5′和3′RACE法克隆得到了该基因的全长cDNA序列[7]。本试验以获得的cDNA序列为参考,对其启动子区序列进行了克隆和分析,并利用Western blotting法对其编码蛋白在小尾寒羊各种组织中的表达情况进行分析,从而为深入研究其功能和调控机理建立基础。
1 材料与方法
1.1 试验动物及样品采集
试验用小尾寒羊来自山东鲁良优质肉羊科技示范有限公司。从纯种群中选取3只11月龄母羊,宰杀后迅速采取心、肝、肺等组织并立即投入液氮保存备用。
1.2 启动子区的克隆及特征分析
1.2.1 引物设计
将前其获得的绵羊Myl3的cDNA序列(Genbank登录号KJ710703)与NCBI中的预测序列加以比对,查找起始密码子。以起始密码子上游序列为参考,以Primer Premier 5和DNAClub软件设计引物(F:5′-ATGTGCCAACCAGAGGAG 3′,R:5′-GAGAAGGAAGCCGAAAGC 3′),并交由上海生物工程有限公司合成。
1.2.2 PCR 扩增及测序
依照PCR MasterMix试剂盒(TIANGEN,KT201)说明书,以小尾寒羊基因组DNA为模板扩增获得Myl3基因的启动子区序列,并依照AxyPrep DNA凝胶回收试剂盒(AXYGEN,#0691)说明书对PCR产物进行纯化和回收。将阳性克隆送于上海生物工程有限公司进行测序,以DNAman7.0软件查看测序峰图及测序序列。
1.2.3 生物信息学分析
将测序所得序列以CpGislands(http://www.bioinformatics.org/sms2/cpg_islands.html) 和 CpGPlot(https://www.ebi.ac.uk/emboss/cpgplot) 分析其CpG岛(设定参数值为CG%>50%,Obs/Exp>0.65,序列长度≥200 bp); 以 Neural Network Promoter Prediction(http://www.fruitfly.org/seq_tools/promoter.html)预测启动子;以McPromote在线工具预测转录起始位点;提交至http://www.dan.affrc.go.jp/PLACE/分析其潜在的顺式作用元件;并以 AliBaba(http://gene-regulation.com/pub/programs/alibaba2/index.html)对转录因子结合位点加以分析。
1.3 蛋白表达分析
取小尾寒羊各种组织,以RIPA裂解液(Solarbio,R0010)提取总蛋白后进行SDS-PAGE电泳分离。分离条带经电转移法转移至PVDF膜上,以兔MYL3多克隆抗体(Proteintech,10913-1-AP)进行一抗孵育。然后以山羊抗兔二抗(上海雅酶生物科技有限公司,LF102)孵育后,加入ELC Plus超敏发光液(Solarbio,PE0010)进行显影和拍照。以GAPDH蛋白的表达水平为参考,通过ImageJ软件分析条带的灰度值。
2 结果与分析
2.1 启动子区序列
经琼脂糖凝胶电泳,该基因启动子区序列扩增条带单一。该单一条带经克隆测序,获得长为990 bp的序列(图1)。
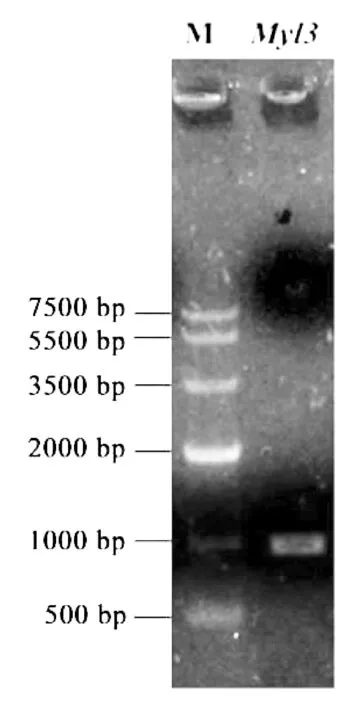
图1 Myl3基因启动子区的PCR扩增
2.2 生物信息学分析
如图2所示,该序列有1个CpG岛,位于15~216 bp处;存在1个基础启动子,位于803~853 bp处;在其34 bp处有1个TATA-box;有4个CAAT-box,分别位于3、308、794和835 bp处;并在536 bp处有1个GC模序。

图2 Myl3基因启动子区的生物信息学分析
经分析发现,该序列有多种转录因子的结合位点。其中结合位点较多的转录因子有Sp1、MyoD、NF1、AP1等。
2.3 小尾寒羊不同组织MYL3蛋白表达差异
如表1和图3所示,MYL3蛋白分子量约为22KD,主要在小尾寒羊的心肌中表达,其次为骨骼肌;在脾和卵巢组织中有少量表达,而在其他组织中均无表达。

表1 小尾寒羊各种组织中MYL3蛋白的表达量(×104)
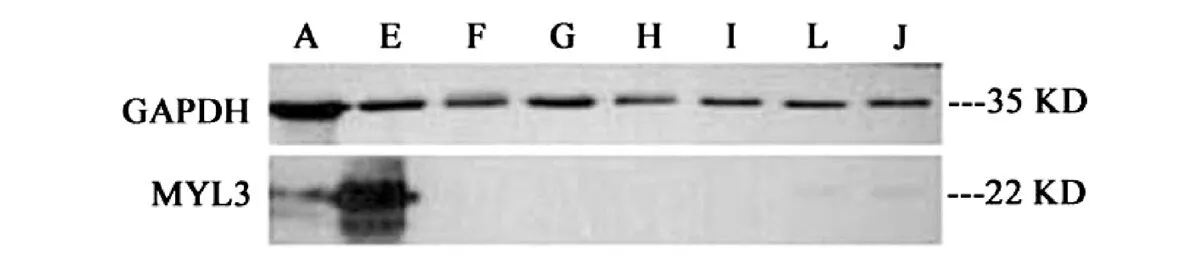
图3 MYL3蛋白在小尾寒羊各组织中的表达
3 讨论
典型的真核生物基因启动子主要包括TATA-box、CAAT-box、GC-box等顺式作用元件。这些元件在基因的转录过程中具有重要的调控作用。本试验获得的绵羊Myl3基因启动子区序列中拥有这些元件,并且具有多个CAAT-box,说明该基因可能具有较高的转录频率。但是,由于多数CAAT-box距离转录起始位点较远,它们能否增加该基因的转录频率还有待于进一步研究证明。
真核生物许多管家基因的启动子区通常存在CpG岛。转录因子Sp1在动物体多种组织中均有表达,并且结合于许多管家基因的启动子中[8]。本试验分析发现,在该基因启动子区序列中存在有CpG岛,并且含有多个Sp1转录因子的结合位点,说明该基因是一个管家基因,其表达方式为组成型表达。
Sp1广泛参与了细胞的增殖、分化和调亡等多种代谢活动[8]。在小鼠[8]和大鼠[9]中均发现Sp1可通过调控相关基因的转录进而调控骨骼肌的生长。多个研究表明,MyoD作为一种转录调控因子,在骨骼肌中进行特异性表达,对骨骼肌的生成和分化具有重要的调控作用[10,11]。本试验在绵羊Myl3的转录调控区域发现有多处Sp1和MyoD转录因子的结合位点,从而认为Sp1、MyoD和Myl3基因在绵羊骨骼肌的生长和发育中具有协调的调控作用。
本试验发现绵羊MYL3蛋白分子量约为22kD,这与前期根据编码的氨基酸预测得到该蛋白分子量为21.961kD相一致[7]。蛋白表达谱显示该基因编码蛋白主要在绵羊的心肌中表达、其次为背最长肌,这与在小鼠[1]、牛[2]和猪[12]中的发现相一致。综上分析推测认为,绵羊Myl3基因的表达可能在Sp1、MyoD等转录因子的调控下对骨骼肌和心肌组织的生长和发育具有重要的调节作用。
4 结论
绵羊Myl3基因启动子区序列有一个基础启动子和一个CpG岛,是一个管家基因。绵羊MYL3蛋白分子量约为22 kDa,在心肌组织中表达量最高,其次为骨骼肌。Myl3基因的表达可能受到Sp1、MyoD等转录因子的调控。
