仔猪空肠和回肠微生物多样性分析
2022-08-31路畅郭玉龙郭艳博刘婷高鹏飞李步高郭晓红
路畅,郭玉龙,郭艳博,刘婷,高鹏飞,李步高,郭晓红
(山西农业大学 动物科学学院,山西 晋中 030801)
哺乳动物胃肠道是一个多功能器官,拥有复杂的动态微生物群落,是营养物质消化、吸收和代谢的主要场所,同时在生理、免疫等方面发挥重要作用[1-2]。肠道微生物的早期定殖是动物生长发育及后期生产性能充分发挥保障的基础[3]。猪肠道菌群定殖过程受诸多因素影响,断奶、饲料更换以及环境的改变均会导致群落结构发生显著变化,很容易影响肠道发育及黏膜免疫系统的形成[4-6]。预先了解仔猪肠道群落形成特点,分析影响肠道健康发育的菌群,有助于制定促进早期肠道内环境稳态发展的策略,及时对仔猪肠道菌群进行有效干预,改善仔猪肠道健康,提高生长速度和后期生产性能。
动物在出生前肠道属于无菌状态,出生后受到母体及周围环境影响,各种微生物快速在肠道定殖[7]。仔猪阶段是肠道微生物早期定殖的关键时期,由于仔猪各肠段功能不同,微生物菌群结构具有显著差异,小肠和大肠之间以及管腔和粘膜之间微生物分布都不相同,而且粪便与肠道菌群组成也存在差异[8-10]。研究发现,梭菌属、乳酸菌、幽门螺杆菌等作为厚壁菌门的主要成员在回肠中大量富集,拟杆菌在盲肠及结肠的腔内和黏膜中丰度显著增加,在不同发育阶段菌群丰度及多样性随年龄增长而增加[11-14]。此外,肠道微生物能够通过其代谢产物促进肠干细胞增殖,如乳酸菌可促进仔猪早期肠黏膜结构发育,同时能使Wnt/βcatenin 通路活化导致肠上皮细胞再生,最终维持细胞稳态[15-16]。
目前虽然围绕肠道菌群对宿主的影响开展了许多研究,但仔猪阶段微生物对肠道结构发育的作用还未明确。马身猪作为山西地方猪种,具有产仔多、肉品质好、耐粗饲、抗逆性强等优点,但其生长速度较慢,脂肪沉积严重且瘦肉率低;晋汾白猪是以马身猪、二花脸猪、长白猪和大白猪为亲本选育而成的新品种,具有生长发育速度快、肉质好等特点[17]。本研究将马身猪(地方品种)和晋汾白猪(培育品种)仔猪作为研究对象,对初生(1 日龄)、哺育末期(28 日龄)、保育末期(70 日龄)3 个关键时期空肠和回肠微生物菌群结构进行分析,探究不同猪种肠道微生物特点及小肠结构发育与微生物多样性的关系,以期发现仔猪肠道发育过程中重要的微生物,旨在为后期仔猪健康饲养提供理论依据。
1 材料和方法
1.1 试验动物和样品采集
本研究于2018 年8-11 月在山西省大同市种猪场进行,每个品种各选择3 头健康母猪,围产期饲料中不添加抗生素或其它药物以及益生菌等影响肠道微生物结构的物质。选择第4 胎次的仔猪,在喂养28 d 断奶后单窝喂养。在出生第1 天、28 天(哺育结束)和70 天(保育结束)时,分别在各窝随机选择3 头公猪进行屠宰,取空肠、回肠内容物收集于1.5 mL 冻存管中,液氮保存。每头猪分别采集1 cm 的空肠与回肠组织,去除内容物并放入多聚甲醛固定液保存备用。
1.2 小肠绒毛结构测定
按常规步骤将取样组织制作成石蜡块,在室温下切出厚度为7 μm 的空肠、回肠组织石蜡切片(每头猪各做2 张),并用伊红-苏木精(HE)试剂染色。后对切片中方向相同的5 根绒毛测量其绒毛长度(Vlength)和隐窝深度(Cdepth),并计算绒隐比(V/C)[17]。
1.3 DNA 抽提、PCR 扩增和测序
按照天根试剂盒说明书的方法与步骤,分别对200 mg 空肠与回肠内容物提取DNA。利用引物 对 微 生 物 的V3-V4 区 进 行 扩 增(341F:5’-ACTCCTACGGGAGGCAGCAG-3’和 806R:5’-GGACTACHVGGGTWTCTAAT-3’)。具体步骤同郭晓红等已发表论文方法与材料部分[17]。回收试剂盒对微生物PCR 产物切胶回收,并用浓度为2%的琼脂糖凝胶电泳对仔猪肠道微生物DNA 检测。随后将微生物样品在Miseq PE300 平台进行建库并测序。下机数据得到Clean Data 使用FLASH 软件组装读段(reads)。
1.4 OTU 聚类分析
使用UPARSE 软件将高质量的reads 从头拼接并富集成OTU(operational taxonomic units)代表序列。将优化序列与OTU 代表序列比对,进行序列分类,以相似度97%作为分类标准。
1.5 肠道微生物多样性分析
利用Mothur 软件(v.1.34.0)计算α 多样性指数[18],分析仔猪肠道菌群多样性,并绘制OUT 稀疏曲线和Rank 丰度曲线。利用R(v.3.0.2)基于加权的UniFrac 距离进行主成分分析(posterior cerebral artery,PCA)。
1.6 样本组成及差异分析
将步骤1.5 中得到的OTU 序列进行分类(比对SILVA 数据库),分别在门(Phylum)和属(Genus)水平统计马身猪和晋汾白猪仔猪空肠与回肠微生物构成,并绘制Venn 图。
1.7 环境因子相关分析
使用R 软件中vegan 包对环境因子(包括肠道绒毛结构和血清免疫指标)与肠道微生物在门和属的相关性分析。计算菌群微生物与肠道绒毛结构和血清免疫指标的Spearman 相关性系数,选择前15 个相关性最高的微生物绘制相关性热图。
2 结果与分析
2.1 仔猪回肠与空肠形态结构比较分析
2.1.1 肠道组织切片结果分析
由图1 组织切片可见,随着日龄增加,2 品种仔猪空肠与回肠绒毛长度逐渐变短,但横切面呈现逐渐变宽的趋势。晋汾白猪仔猪初生(1 d)时小肠已经出现肠道褶皱,而在马身猪仔猪肠道中未发现此现象;此外,马身猪仔猪初生(1 d)时空肠与回肠绒毛较长,而在哺育与保育末期(28 d 和70 d)晋汾白猪的肠绒毛长度大于马身猪(图1)。
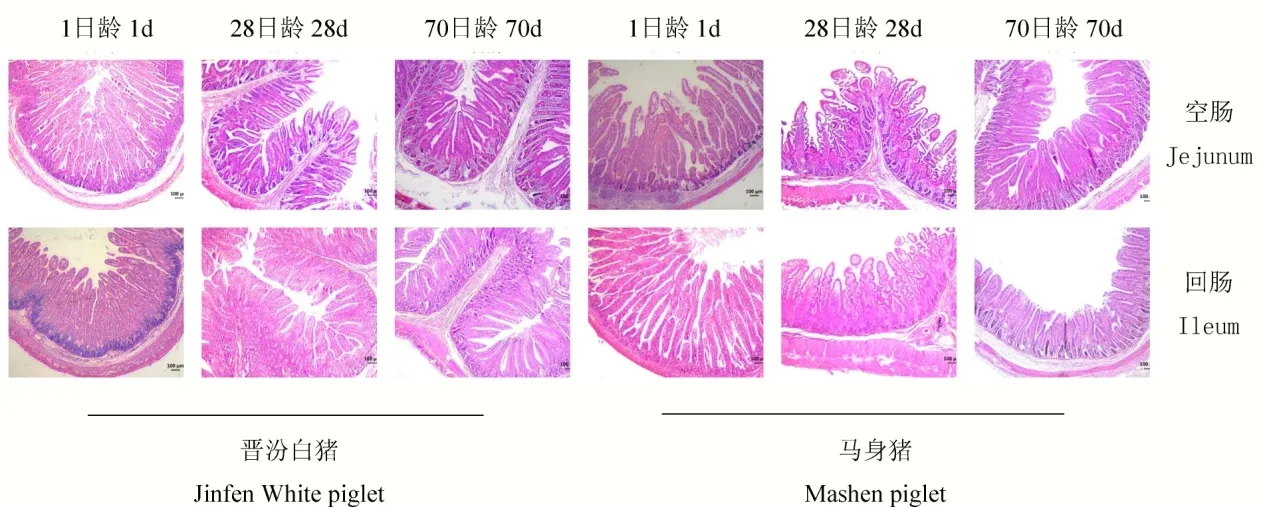
图1 马身猪和晋汾白猪空肠与回肠组织切片(200×)Fig.1 Jejunum and ileum biopsy of Mashen and Jinfen White piglets(200×)
2.1.2 仔猪肠绒毛高度和隐窝深度比较
从初生到70 日龄,2 品种猪(除马身猪回肠)空肠和回肠绒毛呈逐渐降低趋势,且初生时的回肠绒毛高度极显著高于28 日龄和70 日龄(图2A、图2D,P<0.01)。此外,2 品种猪空肠隐窝深度随仔猪生长发育也不断加深,70 日龄的小肠隐窝深度最高(图2B、图2E)。空肠和回肠的绒隐比(Villus/Crypt)随日龄增加呈极显著递减趋势(图2C、图2F)。
通过品种间进行比较发现,马身猪仔猪空肠绒毛长度在1 日龄和28 日龄时极显著高于晋汾白猪(图2A,P<0.01)。2 品种仔猪回肠绒毛长度在初生时没有差异,但在28 日龄时马身猪回肠绒毛高度极显著高于晋汾白猪(P<0.01),在70 日龄时却显著低于晋汾白猪(图2D,P<0.05)。比较隐窝深度发现,马身猪仔猪空肠隐窝深度极显著高于晋汾白猪(除28 日龄回肠),但在保育末期(70 日龄)却显著低于晋汾白猪(图2B,P<0.05)。与空肠不同,1 日龄和70 日龄马身猪仔猪回肠隐窝深度显著高于晋汾白猪(P<0.05),28 日龄却无显著差异(图2E)。马身猪在哺育末期空肠与回肠组织的绒隐比显著高于晋汾白猪(图2C、图2F,P<0.05)。
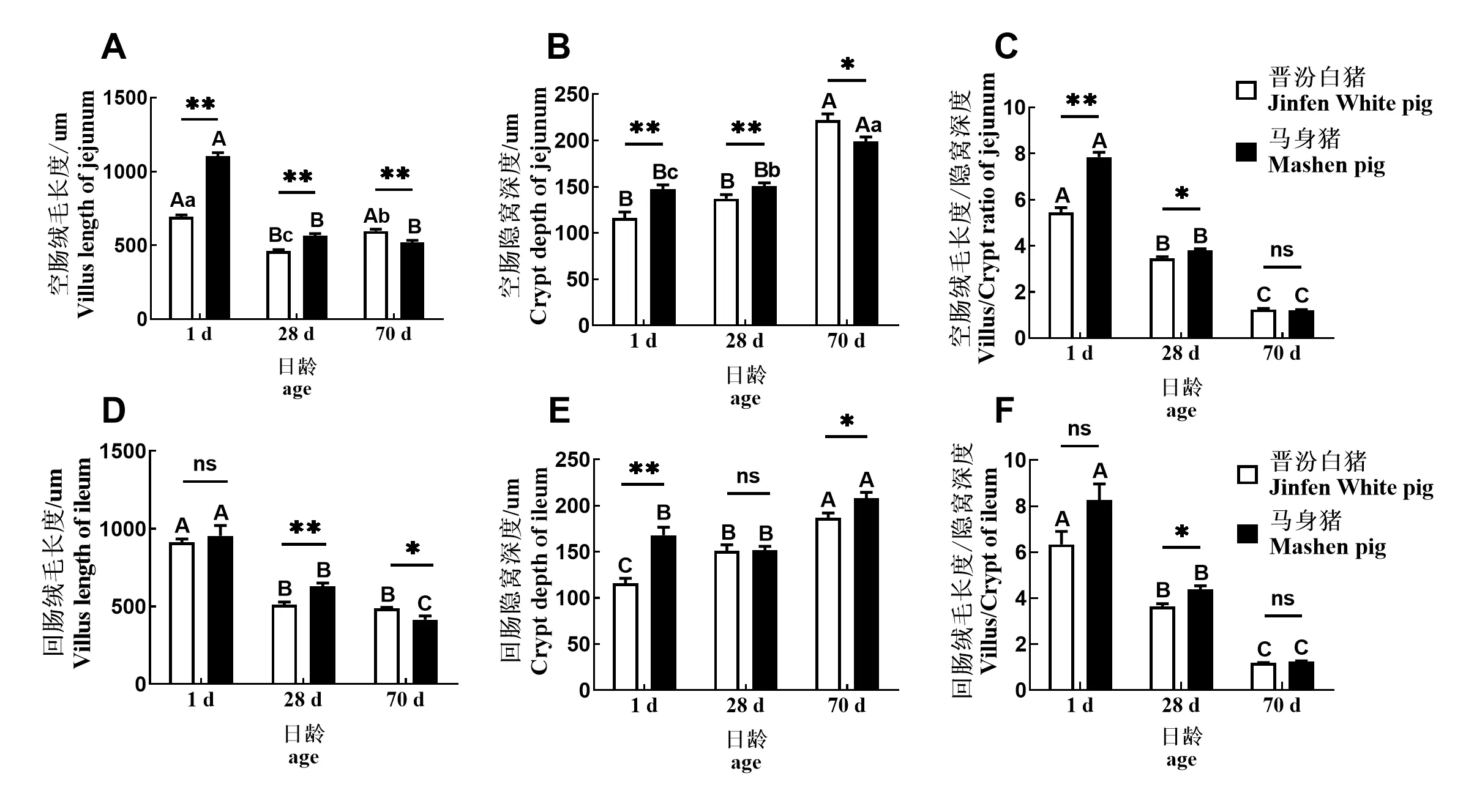
图2 马身猪和晋汾白猪小肠绒毛结构Fig.2 The intestinal morphology of Mashen and Jinfen White piglets
2.2 样本物种注释与评估
对马身猪和晋汾白猪仔猪肠道内容物样品进行测序,共检测到1 872 432 个高质量序列,得到2032 个OUTs,其中2 个品种共有核心OTU 840个,940 个为晋汾白猪所特有,252 个为马身猪特有,核心OTUs 占晋汾白猪(马身猪)总OTUs 的47.19%(76.92%)。将97%相似水平的OTU 代表序列匹配到已知细菌的序列,在晋汾白猪中检测 到28 个 门,55 个 纲,106 个目,205 个 科 和518 个属,在马身猪中检测到19 个门,35 个纲,66 个目,124 个 科 和325 个 属。
2.3 肠道群落多样性分析
对肠道微生物主成分分析,发现2 品种仔猪肠道整体菌群相似且区分不明显(图3A),与之前结肠中的研究结果一致[17]。马身猪空肠、回肠3 个发育时期菌群结构差异明显能够完全区分,而空肠与回肠菌群结构相似不能完全区分,说明晋汾白猪肠道菌群与马身猪相似(图3B)。通过对肠道微生 物α 多 样 性分 析 发 现,除Simpson 以 外,ACE、Chao、Shannon 变化趋势较相似(图3C)。晋汾白猪28 日龄时空肠菌群多样性显著减少,70 日龄时显著增加,马身猪仔猪3 个发育阶段肠道菌群变化稳定,无显著差异。此外,晋汾白猪仔猪回肠菌群多样性随日龄逐渐增加,而马身猪回肠菌群多样性在70 日龄时显著减少(P<0.05),并在保育结束(70 日龄)时微生物多样性极显著低于晋汾白猪(图3C,P<0.01)。
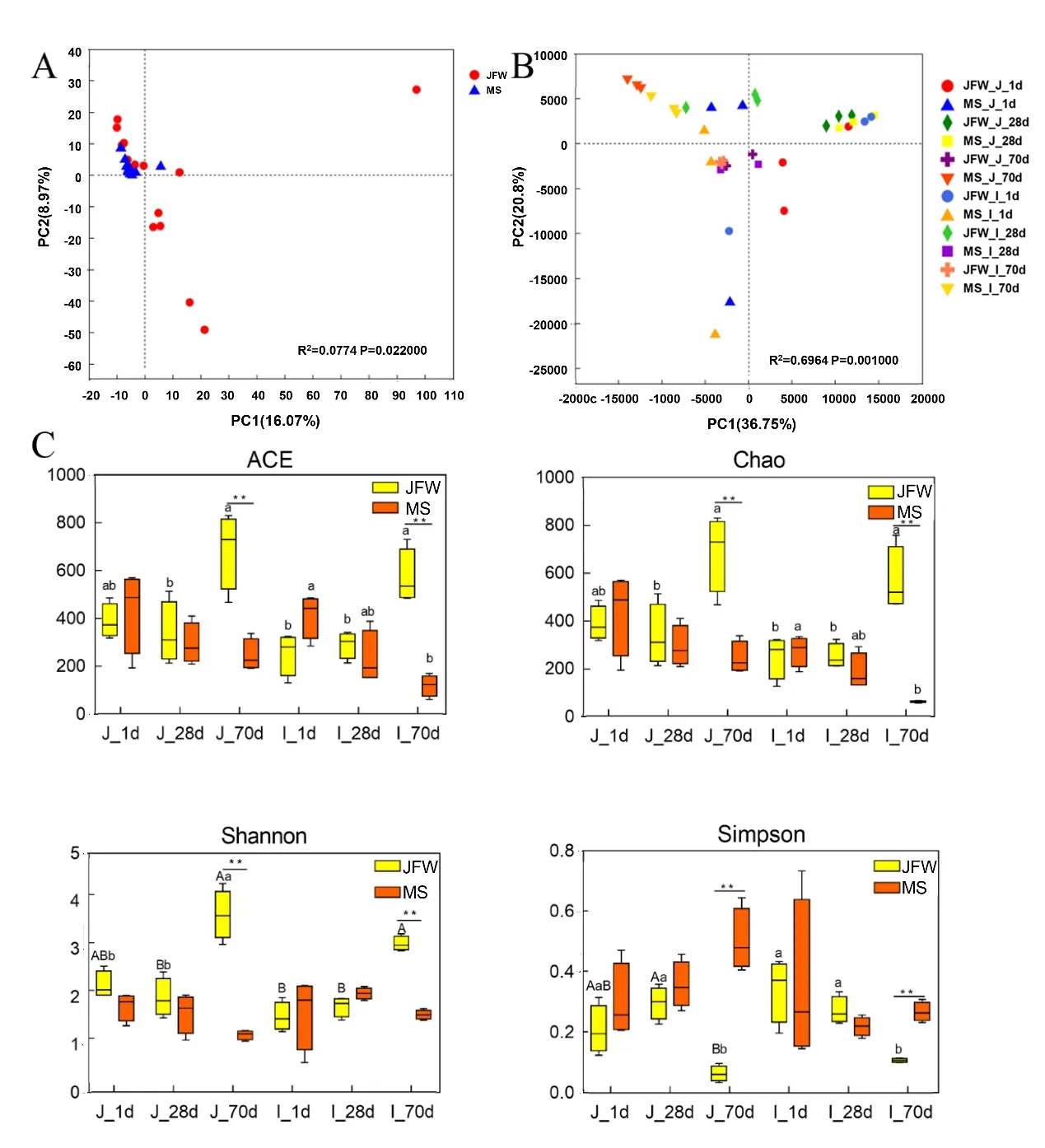
图3 马身猪和晋汾白猪空肠、回肠微生物多样性分析Fig.3 Microbial diversity in jejunum and ileum of Mashen and Jinfen White piglets
2.4 肠道菌群组成分析
通过微生物组成分析,发现晋汾白猪和马身猪仔猪肠道微生物主要包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)。其中,厚壁菌门随仔猪发育丰度逐渐增加,保育结束(70 日龄)所占比例最大。2 品种仔猪回肠厚壁菌门丰度均高于空肠,而且晋汾白猪肠道该菌比例(32.29%~54.92%)显著低于马身猪(61.34%~87.67%)。变形菌门在哺育结束(28 日龄)时丰度达到最高,在70 日龄时急剧减少,初生时晋汾白猪该菌丰度(72.29%)显著高于马身猪(15.60%)。两品种仔猪肠道中拟杆菌门丰度变化与厚壁菌门相反,空肠中拟杆菌门所占比例均高于回肠,晋汾白猪肠道中所占比例(0.70%~3.89%)高于马身猪(0.11%~1.9%)(图4A)。
晋汾白猪和马身猪仔猪肠道微生物群中共鉴定出518 和325 个属,晋汾白猪肠道菌属多样性显著高于马身猪(图4B)。乳酸杆菌(Lactobacillus)、假单胞菌(Pseudomonas)、狭义梭菌属1(Clostridium_sensu_stricto_1)在2 品种仔猪肠道中所占比例较高。马身猪仔猪肠道中的乳酸菌在初生和保育结束时丰度比较高,该菌在空肠这2 阶段丰度平均占比分别为46.76%、95.25%,回肠中分别占37.37%、86.75%,且晋汾白猪乳酸杆菌含量均显著低于马身猪。假单胞菌作为变形菌门中的主要菌属,晋汾白猪仔猪肠道中其丰度占比是马身猪仔猪的2 倍,哺育结束时该菌含量显著增加。分析发现,狭义梭菌属在马身猪仔猪初生时丰度较高,随后很快消失,1 日龄马身猪仔猪该菌丰度是晋汾白猪的1.7 倍;晋汾白猪肠道中该菌在各个时期均存在且丰度较高。2 个品种保育结束(70 日龄)时链球菌属(Streptococcus)出现较高丰度,在晋汾白猪中的含量是马身猪的3~4 倍(图4B)。
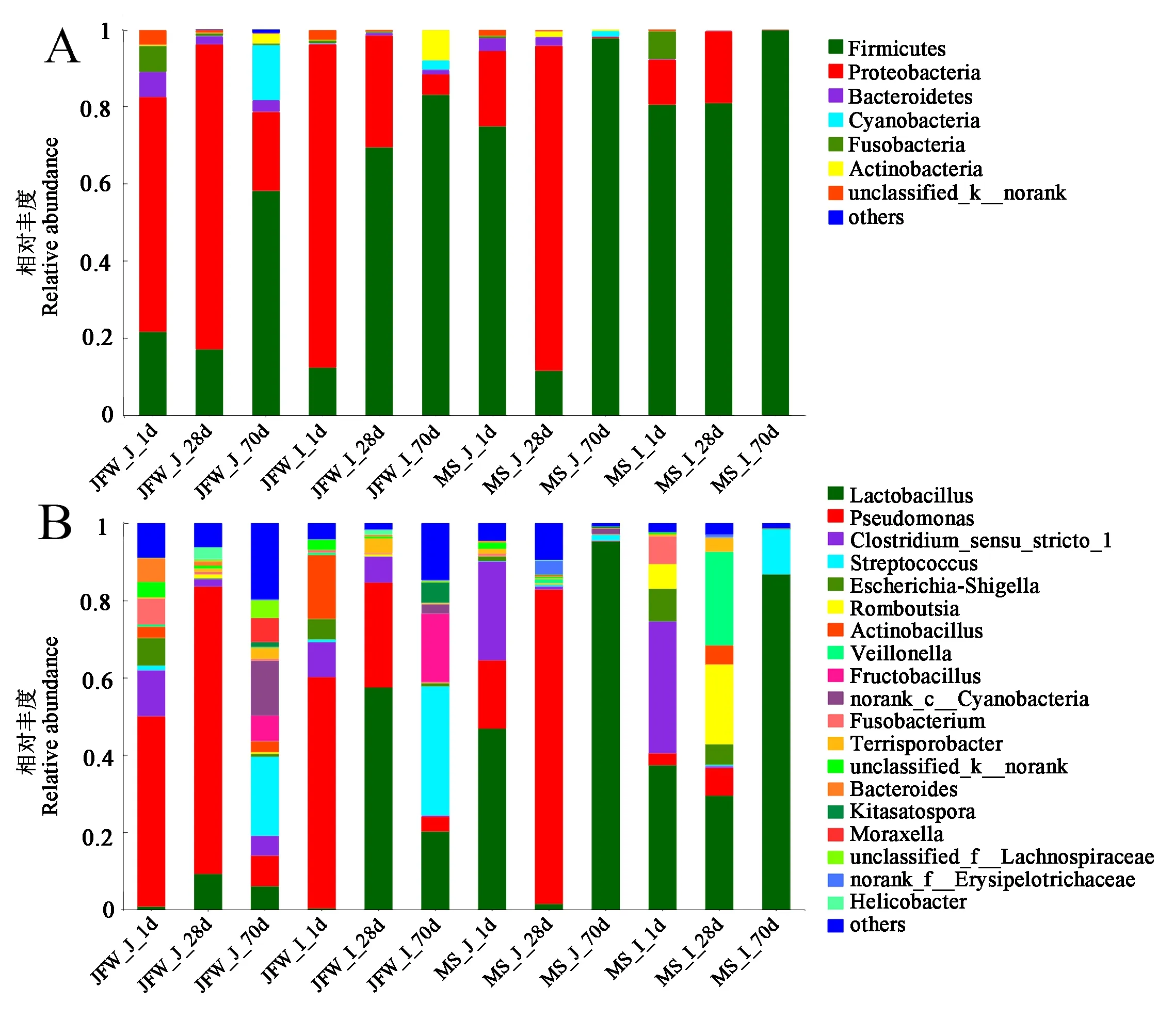
图4 马身猪和晋汾白猪小肠微生物组成Fig.4 The composition of intestinal microbes between Mashen and Jinfen White piglet
2.5 空肠和回肠特有肠道菌群分析
对2 个品种仔猪空肠和回肠特异菌属进行分析,在晋汾白猪空肠和回肠中分别检测到453 种和373 种菌属,而在马身猪空肠和回肠中仅发现307种和183 种菌属。其中,晋汾白猪特有菌属221种,马身猪特有菌属仅25 种,说明晋汾白猪肠道微生物多样性显著高于马身猪(图5)。
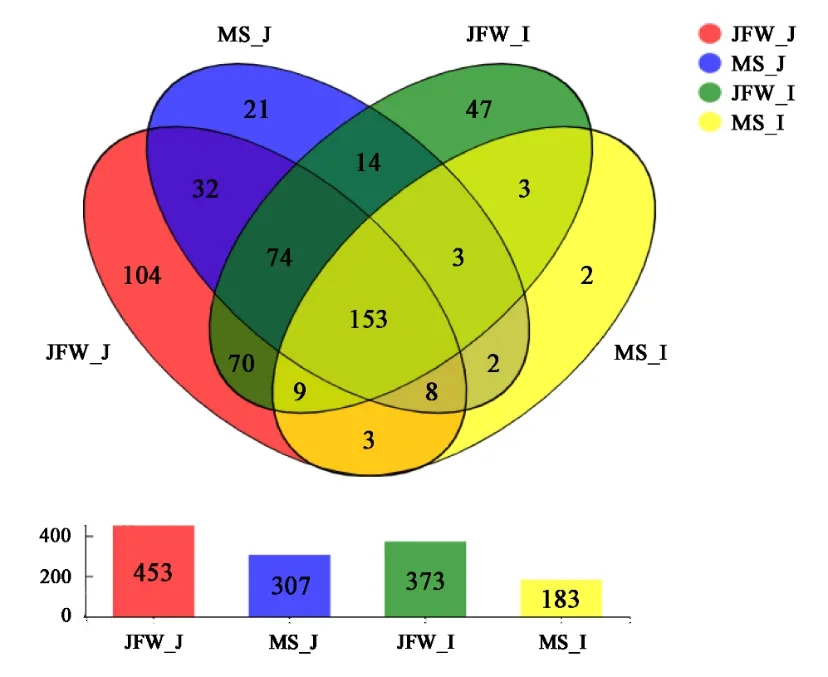
图5 马身猪和晋汾白猪仔猪空肠与回肠微生物数量(属水平)Fig.5 The number of microbiota in the jejunum and ileum of two breeds at genus level
通过对小肠特有菌群分析,发现空肠与回肠特有菌属所属门类差异较大。在门水平,晋汾白猪肠道特异菌群主要集中在放线菌门、厚壁菌门、拟杆菌门、酸杆菌门(Acidobacteria)、Parcubacteria、绿弯菌门(Chloroflexi)等8 个菌门;而马身猪肠道特有菌群主要分布于变形菌门、厚壁菌门、疣微菌门、拟杆菌门、绿菌门、绿弯菌门、蓝藻门(Cyanobacteria)等9 个菌门(图6)。在属水平,Quinella、游动放线菌(Actinoplanes)、气微菌属(Aeromicrobium)、动胶菌属(Zoogloea)等菌属特异性富集于在晋汾白猪仔猪回肠与空肠中(图6A);马身猪仔猪空肠和回肠特有菌属主要包括粘螺旋藻(Mucispirillum)、Thiopseudomonas、Sinibacillus、索 氏菌属(Thauera)、气斯氏菌属(Aerisardovi)、Anaerofilum等(图6B)。
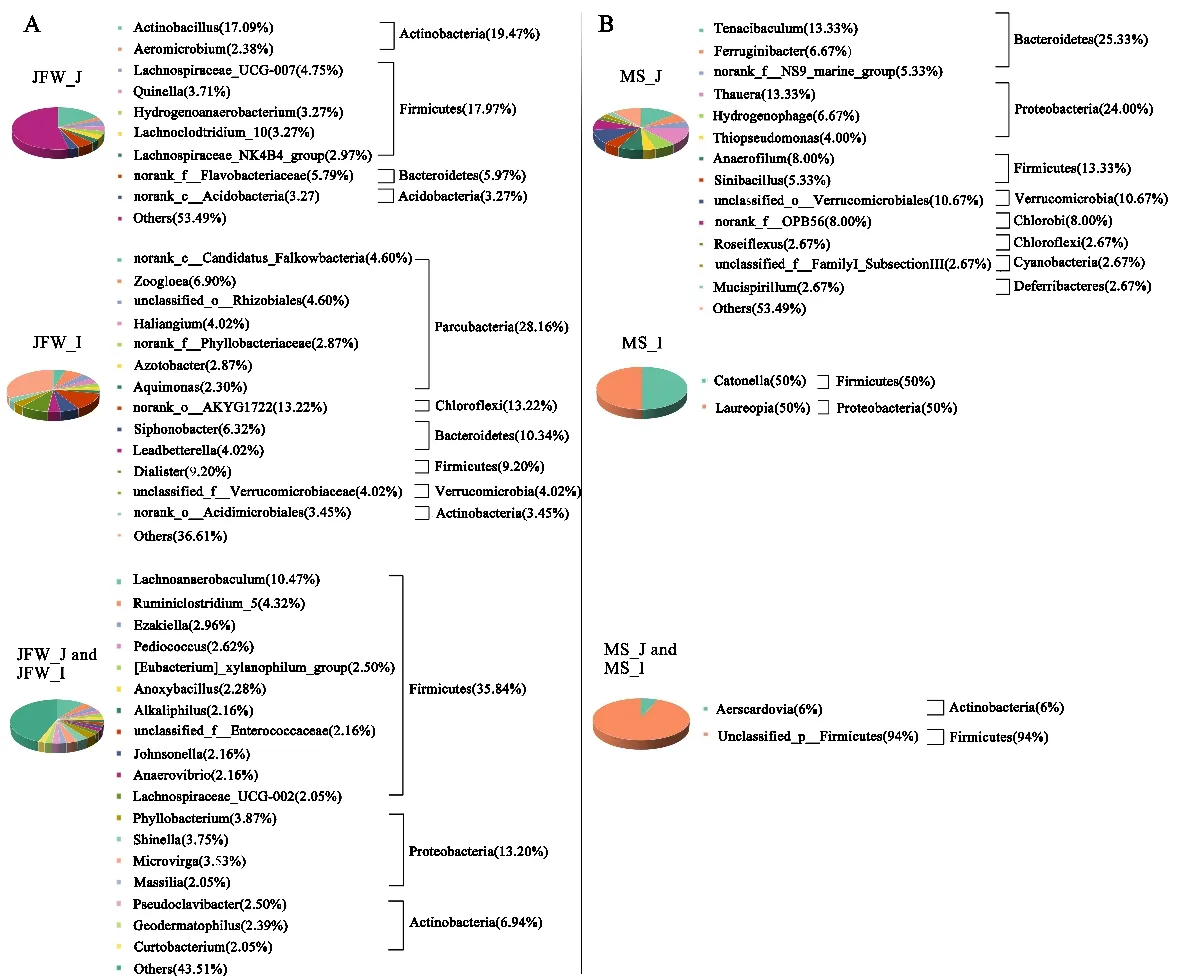
图6 晋汾白猪和马身猪空肠、回肠特有微生物组成Fig.6 The component of peculiar microorganisms in jejunum and ileum of Jinfen White and Mashen piglets
2.6 微生物与肠道指标关联分析结果
通过对肠道微生物菌群与肠绒毛结构和血清生化指标进行相关性分析(图7),发现马身猪仔猪血清中脂多糖(LPS)、二胺氧化酶(DAO)、绒毛长度(Vlength)关联的菌群与D 乳酸(D-LA)、白介素6(IL-6)、肿瘤坏死因子α(TNF-α)、隐窝深度(Cdepth)关联的菌群相关性结果相反,但在晋汾白猪仔猪中区分度不明显。其中,马身猪仔猪的肠道绒毛长度和隐窝深度与15 个菌属的相关性呈现相反的趋势,绒毛长度与链球菌、unclassfied_o_Lactobacillales极显著正相关,但隐窝深度与二者极显著负相关(P<0.001)。D-LA 与4 种菌显著负相关(P<0.05),但仅与乳酸杆菌显著正相关(图7A,P<0.01)。对于晋汾白猪而言,链球菌、北里孢菌(Kitasatospora)、罗氏菌(Rothia)、莫拉 氏 菌(Moraxella)和 魏 斯 氏 菌(Weissella)与TNF-α 和隐窝深度显著正相关,但与D-LA、IL-6以及LPS 显著负相关(图7B,P<0.05)。此外,链球菌在2 品种仔猪中均与DAO 和LPS 负相关,与TNF-α 和Cdepth 显著正相关(P<0.05)。乳酸杆菌与DAO 在马身猪中极显著正相关却在晋汾白猪中极显著负相关(P<0.001),但与LPS 在2 品种猪中显著负相关(P<0.05)。
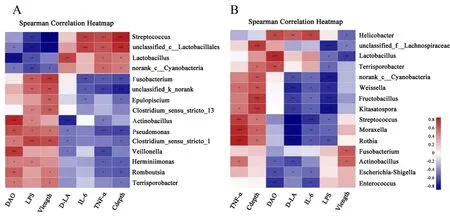
图7 马身猪和晋汾白猪肠道微生物与指标相关性分析(属水平)Fig.7 Spearman correlation analysis between microbiota and environmental variables in two pig breeds at genus level
3 讨论
中国地方猪种在抵抗外界压力和疾病的能力得到广泛认可[19-20],其中肠道微生态在维持健康和抵抗疾病方面发挥不容忽视的作用[21]。研究表明,仔猪肠道微生物多样性会随日龄增加发生显著变化,此过程受饲料及遗传等多种因素影响[6,22]。本研究发现,晋汾白猪与马身猪仔猪小肠微生物结构相似,但3 个时间点的肠道微生物多样性差异显著,说明肠道微生物的形成受到饲料、环境等因素的影响较大。其中,日龄和饮食是引起菌群差异的重要驱动因素,而马身猪仔猪的肠道菌群分类比晋汾白猪少,更稳定,也可能是地方品种对环境改变有较强的适应能力的原因。
有研究指出,猪肠道中有大量的厚壁菌门、拟杆菌门和变形菌门微生物,本研究结果与以上相符[23-24]。厚壁菌门具有获取食物能量的潜力[25-26],马身猪仔猪肠道厚壁菌门丰度显著高于晋汾白猪,高丰度的厚壁菌门可能促进了马身猪脂肪积累。此外,乳酸杆菌是哺乳动物肠道中的主要菌属,在母乳及植物性食物的代谢中发挥着重要的作用[27]。在本研究中马身猪仔猪肠道中的乳酸杆菌丰度较高,这对于维护肠道健康及营养物质的消化吸收有重要作用。Romboutsia能够降低血浆中促炎细胞因子水平,而假单胞菌属、狭义梭菌属等是肠道潜在致病菌[28]。本研究中这些菌属在2品种仔猪各时期均有较高丰度,提示仔猪阶段要注意环境和饲料等外界因素的影响,应加强仔猪护理防止肠道疾病的发生。从整体来看,马身猪有益菌群丰度占比高于晋汾白猪,说明马身猪肠道微生物在其抗逆性方面发挥重要作用。
本研究分析表明,肠道菌群与肠道发育以及机体免疫之间存在相关性,其中血清DAO、D-LA和LPS 含量可以改变肠道通透性肠黏膜功能[29-30]。乳酸杆菌的代谢产物具有抑菌、屏障保护作用,可以竞争致病菌的黏附位置并减少致病菌的黏附侵害,减少致病菌LPS 的产生[31-32]。此外,魏斯氏菌对肠黏膜具有抗炎和保护作用,在小鼠中可抑制脂多糖诱导巨噬细胞产生NO 和IL-6,而在人中主要抑制上皮细胞产生IL-8[33]。本研究通过关联分析发现狭义梭菌属、假单胞菌属等微生物与这些指标显著正相关,而乳酸杆菌、魏斯氏菌等有益菌是负相关,所以在实际生产中应注意对仔猪肠道微生物调控,促进有益菌大量富集,维护肠道健康。
4 结论
本研究通过比较马身猪和晋汾白猪仔阶段小肠微生物多样性,分析了仔猪关键生长阶段的菌属变化情况,与晋汾白猪相比,马身猪仔猪肠道菌群组成更加保守,微生物多样性显著小于晋汾白猪。乳酸杆菌、Ferruginibacter、Thiopseudomonas、索氏菌属、粘螺旋藻等是马身猪的特异菌群,可能对马身猪抗逆性能具有影响。Quinella、Haliangium、动胶菌属、Anoxybacillus、毛螺菌科等为晋汾白猪特异菌属,对营养吸收代谢具有重要作用。微生物对仔猪健康及后期生产性能的发挥具有重要作用,本研究结果可为不同品种仔猪肠道微生态的调控研究及仔猪健康饲养提供参考。
