不同干扰强度对华北落叶松-云杉混交林土壤细菌群落组成及多样性的影响
2022-08-31闫海冰李璟陈颂周朵朵
闫海冰,李璟,陈颂,周朵朵
(1.太原工业学院 环境与安全工程系,山西 太原 030008;2.中国林业科学研究院 森林生态环境与自然保护研究所,北京 100000;3.山西农业大学 林学院,山西 晋中 030801)
土壤微生物参与了土壤中腐殖质形成[1]、有机质分解[2]、养分循环[3]等过程,在土壤生态系统中发挥重要作用[4]。其中,土壤细菌作为土壤微生物的重要组成部分,在数量上占有绝对优势[5],细菌群落的组成及多样性结构与其直接参与的枯落物分解、生物固氮、无机营养释放等一系列土壤生态学过程密切相关[6]。研究表明,植物基因型显著影响土壤细菌群落结构[7];Guoyu 等[8]认为,细菌群落分布的尺度变化存在历史偶然性,小尺度范围的差异受到季节变化的显著影响;Yunfu 等[9]研究发现,土壤环境的改变是导致土壤细菌群落结构变化的重要因素。在华北关帝山林区,乔莎莎等[10]发现不同林下土壤细菌群落结构和多样性的显著差异是由扩散限制环境的选择造成的。在此基础上,周永娜等[11]的研究结果表明林下土壤细菌群落结构受土壤理化性质的影响较大。然而,森林生态系统多元复杂,林分类型变化多样,林分状况参差不齐,导致森林土壤理化性质在区域尺度或局域尺度均有差异[12]。因此,森林土壤细菌群落分布与森林树木的存在密切相关。
有研究表明,干扰改变了森林植被的存在格局[13],与森林生物群落的多样性和分布特征紧密相关[14]。干扰通过改变森林植被的分布特征而影响林分的密度、郁闭度、林下光照等林分因子,从而影响植物-土壤的互作关系及土壤的水养循环,造成森林地上及地下生物多样性发生变化。近年来,诸多学者开展了有关土壤细菌群落对干扰的响应研究。骆娟等[15]的研究表明旅游活动显著影响了土壤细菌群落多样性;陈香碧等[16]的研究发现,变形菌门的相对丰度在人为干扰的生态系统中显著减少。还有学者认为,人为或植物干扰会使土壤pH 值、有机质等土壤因素发生改变,进而影响土壤细菌群落的分布[17-18]。这些研究有助于我们深入了解干扰在土壤细菌群落结构和功能演变中发挥的重要作用。然而,针对干扰对我国华北亚高山暖温带寒温性森林土壤细菌群落分布的影响及其驱动机制的研究尚未见报道。
关帝山华北落叶松(Larix principis-rupprechtii)-云杉(Picea asperata)混交林是我国华北地区典型的山地暖温带寒温性森林类型,对华北山地森林生物多样性维持具有重要意义[19]。基于此,本研究在山西省关帝山庞泉沟国家级自然保护区建立不同干扰等级的华北落叶松-云杉混交林样地,并在对样地本底调查基础上进行土壤采样工作。通过土壤细菌高通量测序及9 个土壤理化性质的测定工作,对比分析不同干扰等级林下土壤细菌群落的相对丰度及多样性的差异,并探究土壤理化性质对细菌群落分布的相对贡献。结果有助于深入了解华北亚高山森林土壤细菌群落分布特征对干扰的响应及其潜在的生态学驱动机制,对进一步探测森林土壤生态系统发生规律具有重要意义。
1 研究地区与研究方法
1.1 研究区概况
研究地位于山西省关帝山庞泉沟国家级自然保护区(11°22′E~111°33′E,37°45′N~37°55′N)。本地区属暖温带大陆性季风气候,具有典型的山地气候特征。年平均气温低(4.3 ℃),1 月最低气温可达-23 ℃,7 月最高气温30.5 ℃,年平均降水量和蒸发量分别为822.6 mm 和1268 mm。土层平均厚度为70~80 cm,其中腐殖质层厚度为10 cm[20]。
1.2 研究方法
1.2.1 样地设置与样地调查
2020 年选择保护区内柴禄沟分布的华北落叶松-云杉混交林为样地布设点(图1A),根据林分密度、郁闭度及伐桩数量,建立3 个不同干扰程度的研究样地(40 m×40 m),利用全站仪将每个样地划分为4 个20 m×20 m 样方,然后将每个样方划分为16 个小5 m×5 m 小样方并以顺时针方向进行本地调查。准确测量并记录每个小样方内所有乔木(胸径≥1 cm)的种名、胸径、树高,同时记录了海拔、坡度、郁闭度和伐桩数量等环境因子,调查结果见表1。3 个样地主要乔木树种为云杉和华北落叶松,伴生种有白桦(Betula platyphylla)、山杨(Populus davidiana)等;灌木主要有刺梅(Euphorbia Milii)、土庄绣线菊(Spiraea pubesceni)、华北卫矛(Euonymus maackii)等;草本主要有藜芦(Veratrum nigrum)、茜草(Rubia cordifolia)、野草莓(Fragaria vesca)等。
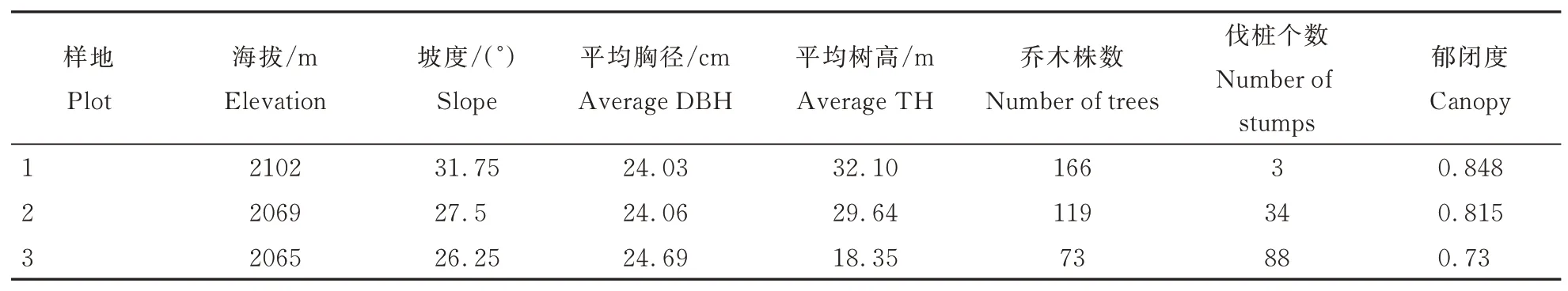
表1 不同干扰等级样地概况Table 1 Overview of plots with different interference level
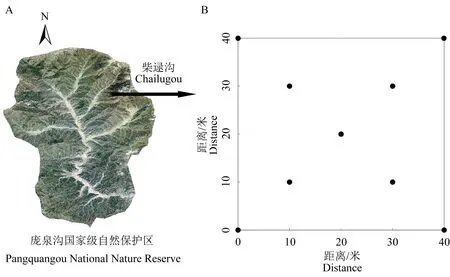
图1 样地选址及土壤采样点Fig.1 Plot selection and soil sampling sites
依据各样地调查结果,计算相对郁闭度、相对林分平均密度和相对伐桩密度。以郁闭度最小的3 号样地为参照(相对郁闭度为1.00),求得1、2 号样地相对郁闭度分别为1.16(0.848/0.730)和1.11(0.815/0.730),依此方法分别计算各指标相对值。各样地干扰度值为样地各指标相对值之和。参照左政等[21]干扰等级分类标准,划分3 个样地为不同的干扰等级并进行命名(表2),其中,1 号样地(N)干扰度值为4.43(FDI<13.4),其干扰等级命名为“未干扰(NI 级)”;2 号样地(S1)干扰度值为14.07(13.4≤FDI<30.9),为“Ⅰ级干扰”;3号 样 地(S2)干 扰 度 值 为31.33(30.9≤FDI<48.5),为“Ⅱ级干扰”。
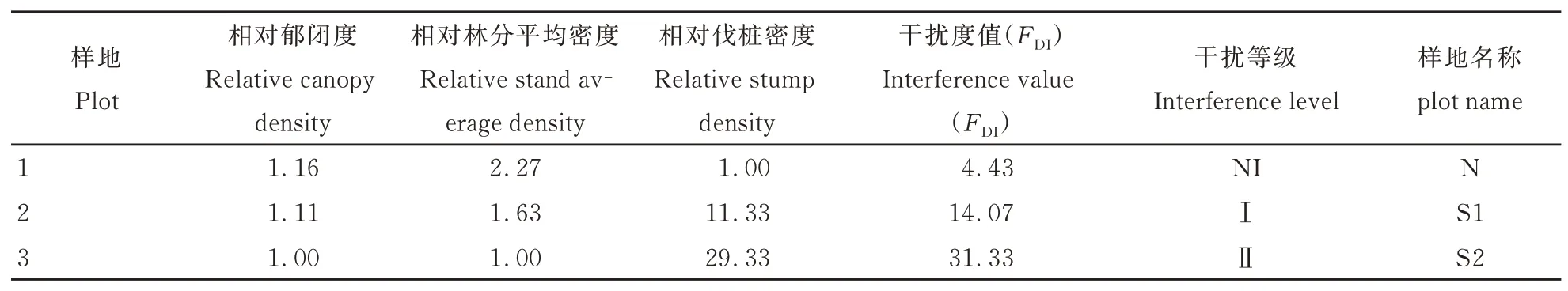
表2 各样地的干扰程度Table 2 Disturbance intensity of various plots
1.2.2 土壤采样及有关指标的测定
参照5 点取样法土壤取样技术规范,在每个样地的4 个顶点及中心点处进行取样。为保证所取土壤样本能更好地代表样地内土壤状况,将每个样地划分成4 个均等的20 m×20 m 的小样方,至少于每个小样方的中心点取样,并在样方内其它位置随机取样,由此共计每个样地至少9 个取样点(图1B)。每个取样点的取样面积为0.2 m×0.2 m,取样厚度为0~10 cm(去除凋落物层),取样同时测量并记录各采样点土壤温度(T),由WET-2-K1 分析仪(英国)测得。将采得的土壤样品带回实验室,去除枝条、根系等杂质后过2 mm 筛并备份2份,分别用于土壤细菌的高通量测序(保存至-80 ℃环境)及土壤理化性质的测定。
土壤细菌测定采用16S rRNA 扩增子技术[22]对超低温保存的土壤细菌样本进行高通量测序。分别利用特定引物-338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA 的V3-V4区进行测序。测序工作由上海阿趣生物科技有限公司完成(http://www. biotree. cn),测序获取内容为各采样点的土壤细菌多样性、细菌在各生物分类级别中的相对丰度(门、纲、目、科、属、种)等。
土壤理化性质参照鲍士旦[23]《土壤农化分析》(第三版)对常温保存的土壤样本进行土壤理化性质测定,包括土壤含水率(SMC)、土壤pH 值、土壤有机质(OM)、土壤有效氮(AN)、土壤有效磷(AP)、土壤有效钾(AK)、土壤有效锌(AZn)、土壤有效铁(AFe)。
1.3 数据处理
1.3.1 经典统计学分析
利用经典统计学分析,对每个样地内各采样点所测土壤细菌群落的相对丰度进行均值处理,在门水平(Phylum)、属水平(Genus)分别统计各样点相对丰度>1%的土壤细菌,以反映不同干扰等级样地内土壤细菌群落的总体分布状况。数据分析由R 4.0.3 实现。
1.3.2 方差显著性分析
计算各样地OTU 水平上的细菌群落在97%一致性阈值下的Alpha 多样性指数。其中,ACE指数表示一个群落中OTU 数量的估计值;Chao 1指数表示细菌群落样本中包含物种总数的值;Simpson 指数体现了细菌群落分布的多样性和均匀性;Shannon 指数表示样本中分类的总数和比例;PD_whole tree 指数表示各细菌群落内物种的关系-谱系多样性。数据分析由Mothur 1.30实现。
基于此,分别将不同样地间各细菌群落丰度、各Alpha 多样性指数、各土壤理化性质进行单因素方差(One-Way ANOVA)分析,以反映不同干扰情况下土壤细菌群落Alpha 多样性、土壤理化性质的差异性(置信区间为95%)。 数据分析由R 4.0.3 实现。
1.3.3 非度量多维尺度分析
对各样地细菌群落进行非度量多维尺度(NMDS,Non-Metric Multi-Dimensional Scaling)分析,通过对比二维排序图上点与点间的距离,反映不同样本间的差异程度,以进一步说明不同干扰等级下土壤细菌结构的相异性。数据分析由R4.0.3实现。
1.3.4 冗余分析
利用冗余分析(Redundancy analysis,RDA),将各样地内相对丰度>1%的土壤优势细菌门和土壤优势细菌属与土壤理化性质进行RDA 排序,通过999 次蒙特卡洛(Monte Carlo)随机置换检验环境因子与土壤细菌群落分布的显著性,并在RDA 中 使用层次分 割(Hierarchical partitioning,HP)分析土壤理化性质分别对土壤细菌门水平和属水平的贡献度和重要性[24],进而探究华北亚高山森林土壤细菌群落分布的驱动因素。数据分析由R 4.0.3 实现。
2 结果与分析
2.1 不同干扰强度下土壤细菌的群落组成
由图2 可见,3 种干扰强度的华北落叶松-云杉混交林样地土壤细菌组成有差异。在门水平上,3个样地主要细菌有:变形菌门(Proteobacteria)相对丰度变化范围为:23.71%~24.90%,N>S2>S1;未明确细菌门(unidentified_Bacteria)相对丰度变化范围为:19.78%~20.45%,S1>S2>N;放线菌门(Actinobacteriota)相对丰度变化范围为:13.57%~15.95%,N>S1>S2;酸杆菌门(Acidobacteriota)相对丰度变化范围为:12.09%~13.33%,S1>S2>N;疣微菌门(Verrucomicrobiota)相对丰度变化范围为:4.25%~4.98%,S2>N>S1;绿弯菌门(Chloroflexi)相对丰度变化范围为:3.79%~4.03%,S1>N>S2;粘 球 菌 门(Myxococcota)相对丰度变化范围为:2.59%~2.94%,S1>S2>N;拟杆菌门(Bacteroidota)相对丰度变化范围为:2.33%~2.80%,N>S1>S2(图2A)。在属水平上,3 个样地土壤细菌主要以RB41属相对丰度变化范围为:3.55%~5.97%,S1>N>S2;Candidatus_Udaeobacter属相对丰度变化范围为:2.33%~2.94%,N>S2>S1;大豆根瘤菌属(Bradyrhizobium)相对丰度变化范围为:2.21%~2.88%,N>S2>S1;MND1属相对丰度变 化 范 围 为1.08%~1.62%,S2>S1>N;Ellin6067属相对丰度变化范围为:1.16%~1.47%,S2>S1>N。(图2B)。结果表明,在门水平上,变形菌门、未明确细菌门、放线菌门、酸杆菌门是3 个样地土壤中最丰富的细菌群,其中,3 种干扰强度土壤样品细菌群落丰度在酸杆菌门呈显著性差异(P<0.05);在 属 水 平 上,RB41属、Candidatus_Udaeobacter属、大豆根瘤菌 属、MND1属 是3个样地土壤中最丰富的细菌群,其中,3 种干扰强度土壤样品细菌群落丰度在RB41属、MND1属呈显著性差异(P<0.05)。

图2 不同干扰等级样地细菌门水平(A)和属水平(B)的组成Fig.2 Composition of bacteria at Phylum level(A)and Genus level(B)in plots with different interference gradients
2.2 不同干扰等级下土壤细菌群落Alpha 多样性
对不同干扰等级的3 个样地内土壤细菌群落进行Alpha 多样性分析,结果如表3 所示,未干扰样地各项多样性指数均显著低于Ⅰ、Ⅱ级干扰样地(P<0.05),而Ⅰ、Ⅱ级干扰样地间的各项多样性指数差异均不显著(P>0.05)。在未干扰样地中,OTU 个数(2 679.05)、ACE 指数(3 204.38)和Chao 1 指数(3 090.88)与其余2 个样地的差异说明,在未干扰的条件下,土壤细菌群落的物种数目相对较低;Simpson 指数(0.995 0)和Shannon 指数(9.59)的差异则说明,未干扰的样地中物种丰富度和均匀度相对较低。而Ⅰ、Ⅱ级干扰样地间,Ⅰ级干扰样地的各项指数均高于Ⅱ级干扰样地,结合上述结果表明,随干扰的增强,土壤细菌群落Alpha 多样性各项指数呈先增后降的趋势。

表3 不同干扰等级样地土壤细菌群落多样性Table 3 Diversity of soil bacterial community in plots with different interference gradients
2.3 不同干扰强度下土壤细菌群落差异分析
在OTU 水平上,采用基于Bray-Curtis 距离的非度量多维尺度分析(NMDS)分析了不同干扰强度下土壤细菌群落结构的差异(图3),模型应力函数值Stress<0.2,说明排序模型合理。结果表明,Ⅰ级干扰样地和Ⅱ级干扰样地样点分布相对独立,而未干扰样地样点分布相对较为分散。利用相似性分析(ANOSIM)进一步对3 个干扰等级样地土壤细菌群落的群落结构差异性进行了分析。结果显示,土壤细菌群落组成有显著性差异(R=0.145,P=0.002),R>0,说明组间差异大于组内差异。其中,Ⅰ级干扰样地和Ⅱ级干扰样地呈显著性差异;Ⅱ级干扰样地和未干扰样地呈显著性差异;Ⅰ级干扰样地和未干扰样地差异不显著(表4)。这表明干扰影响了土壤细菌群落结构,随干扰强度增大,干扰对细菌群落结构的影响变得显著。
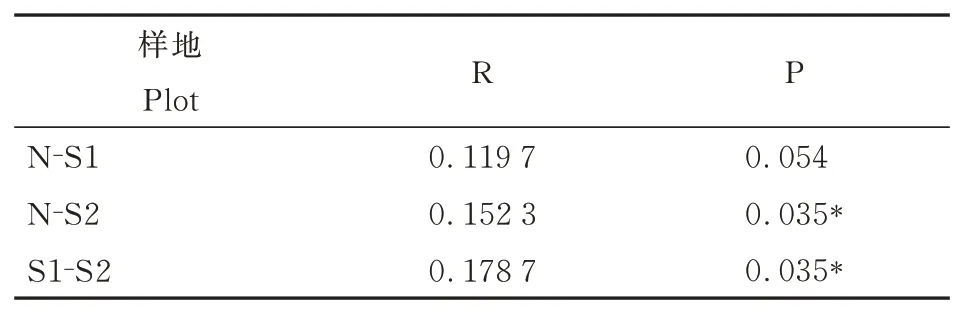
表4 不同干扰等级样地土壤细菌群落ANOSIM 两两比较分析Table 4 Pairable ANOSIM comparative analysis of soil bacterial community of plots with different interference gradients
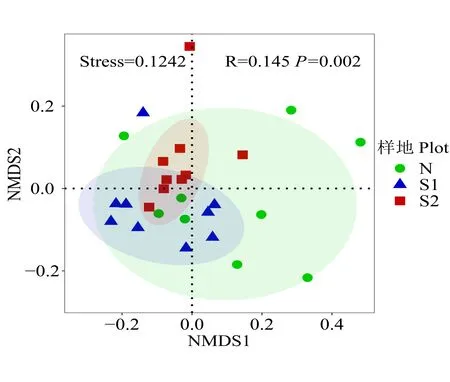
图3 土壤细菌群落非度量多维尺度分析(NMDS)分析Fig.3 Non-metric multidimensional scaling(NMDS)of soil bacterial community
2.4 不同干扰强度土壤理化性质分析
在不同干扰等级的样地中,土壤理化性质存在差异(表5)。其中,未干扰样地的土壤有机质含量(114.96 g·kg-1)和有效钾含量(195.23 mg·kg-1)显著高于Ⅰ、Ⅱ级干扰样地;Ⅰ级干扰强度样地的土壤有效氮含量(125.74 mg·kg-1)显著低于未干扰和Ⅱ及干扰样地;Ⅱ级干扰样地的土壤温度(13.79℃)显著低于未干扰和Ⅰ级干扰样地。土壤含水率、pH 值、有效锌和有效铁在各干扰等级样地中含量的差异均不显著。土壤含水率和pH 值随干扰等级的增加呈现递增趋势;土壤温度和土壤有效磷随干扰等级的增加呈现递减趋势;土壤有机质、有效氮、有效钾、有效锌和有效铁随干扰等级的增加呈现先减后增趋势,但增幅较低。这表明,干扰的增加是导致土壤理化性质变化的关键因素。

表5 不同干扰等级样地土壤理化性质Table 5 Soil physicochemical properties in plots with different interference gradients
2.5 土壤细菌群落与土壤理化性质的冗余分析
为进一步明确样地尺度上(40 m×40 m)造成土壤细菌群落结构差异的关键环境因子,分别对土壤细菌群落优势细菌门和优势细菌属与土壤理化性质进行冗余分析。结果表明,在门水平上(图4A),模型总解释量为63.13%,第1 轴和第2 轴的解释量分别为45.01%和13.18%。置换检验结果显示,土壤含水率、土壤温度、有效氮、有效磷、有效钾、有效锌与优势细菌门分布显著相关,其中变形菌门与有效磷呈正相关,与土壤温度呈负相关;放线菌门与土壤温度、有效氮、有效磷、有效钾、有效锌呈正相关,与土壤含水率呈负相关;酸杆菌门与土壤含水率呈正相关,与有效氮、有效磷、有效钾、有效锌呈负相关。在属水平上(图4B),模型总解释量为60.66%,第一轴和第二轴的解释量分别为44.34%和7.75%。置换检验结果显示,有效氮、有效磷、有机质与优势细菌属分布显著相关,其中RB41属与有机质、有效氮、有效磷呈负相关;Candidatus_Udaeobacter属与有效磷呈负相关;大豆根瘤菌属与有机质、有效氮呈正相关。其余优势菌门与优势均属均集中分布在原点周围,表明其在3 个干扰等级样地内均呈均匀分布。同时对模型的层次分割分析表明,在模型包含的环境因素中,有效氮对土壤细菌群落结构影响最大,解释了土壤细菌群落结构的15.61%(门水平)和18.56%(属水平)(图5),说明有效氮是影响土壤细菌群落结构的关键因素。
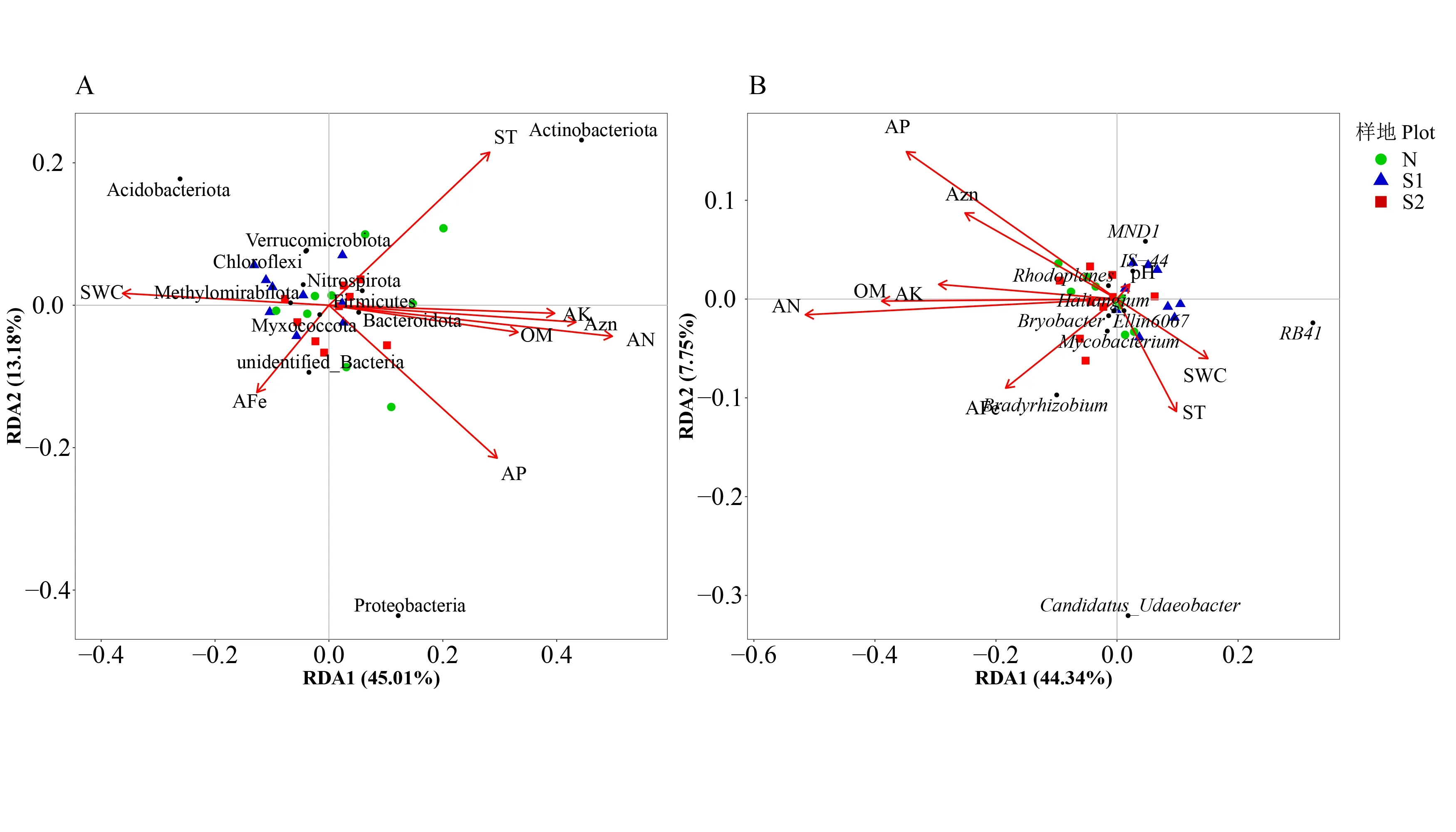
图4 优势细菌门(A)、优势细菌属(B)与土壤环境因子冗余分析Fig.4 Redundancy analysis(RDA)on soil dominant bacteria phyla(A)and soil dominant bacteria genus(B)constrained by soil variables

图5 土壤环境因子对优势细菌门(A)、优势细菌属(B)群落结构影响的解释量Fig.5 Interpretation of the effects of soil variables on the community structure of soil dominant bacteria phyla(A)and soil dominant bacteria genus(B)
3 讨论
有研究表明,变形菌门和放线菌门主要参与有机质分解,是土壤中最丰富的细菌类群[25]。Fierer 等[26]研究发现在温带森林中酸杆菌是土壤中的优势菌门。刘洋等[27]研究发现黄土高原不同乔木林下土壤细菌群落中变形菌门为最主要的优势菌门。本研究中,华北亚高山华北落叶松-云杉混交林不同干扰强度下3 块样地的土壤细菌群落在门水平上具有相似性,均以变形菌门、未明确细菌门、放线菌门、酸杆菌门为主要菌门,与之前研究结果基本一致。本研究重点关注了不同强度干扰对森林土壤细菌群落结构的影响,结果表明,3 种干扰强度土壤样品细菌群落丰度在酸杆菌门呈显著性差异,在RB41属、MND1属呈显著性差异(P<0.05)。这说明干扰影响了森林土壤细菌的群落组成,不同干扰强度引起了土壤中主要菌群在细菌群落中的占比发生变化。对3 个样地土壤细菌群落Alpha 多样性分析表明,干扰影响了森林土壤细菌群落的分布。未干扰样地(N)物种丰富度和均匀度相对较低,随干扰加大,Ⅰ级干扰样地(S1)各项Alpha 多样性指数均显著提高。但随着干扰强度由Ⅰ级增加至Ⅱ级,对应干扰样地S2 各项指数较S1 有所下降,这与王永强[28]的研究结果一致。表明干扰对土壤细菌群落多样性的影响也符合“中度干扰假说”,适度的干扰可以提高土壤细菌多样性,过轻或过重的干扰都将使土壤细菌多样性降低[29]。对3 个样地细菌群落的差异性分析发现,随干扰强度增大,干扰对细菌群落结构的影响变得显著。
土壤作为细菌赖以生存的重要基础,土壤理化因子是影响土壤细菌群落分布[30]和细菌群落多样性[31]的关键因素。冗余分析表明,土壤含水量、土壤温度、有机质、有效氮、有效磷、有效钾、有效锌对土壤细菌群落(门水平和属水平)结构影响显著,这与乔莎莎[10]在关帝山的研究结果基本一致。土壤含水量的变化会改变土壤孔隙度,进而影响土壤细菌呼吸,导致其生物量[32]及活性变化[33]。土壤温度影响土壤细菌的活性,能够改变土壤细菌群落的多样性[34]。土壤pH 是土壤微生物重要的影响因子[35]。大多数土壤细菌通过分解有机质获得能量,有机质是土壤细菌群落关键的生态驱动因素[36]。土壤碳、氮循环及转化过程离不开土壤细菌的参与,同时又影响着细菌在土壤中的活动和群落构建[37]。有效锌对土壤细菌群落结构有影响,可能原因与重金属胁迫或者土壤细菌参与重金属降解作用有关[38]。本研究发现,变形菌门与有效磷呈正相关,与土壤温度呈负相关;放线菌门与土壤温度、有效氮、有效磷、有效钾、有效锌呈正相关,与土壤含水率呈负相关;酸杆菌门与土壤含水率呈正相关,与有效氮、有效磷、有效钾、有效锌呈负相关。结果符合具有典型r-策略(富营养细菌)和k-策略(贫营养细菌)生态属性的微生物群落理论[39]。富营养细菌需要高营养条件,如果资源充足,会保持高增长率,占据群落的优势地位。在低资源浓度的胁迫条件下,贫营养细菌可能比富营养细菌更有竞争力。变形菌门在富营养的环境中生长迅速,其相对丰度随土壤碳、氮含量增加而增加[40],而酸杆菌门是一种低营养环境占据优势的贫营养细菌[41]。放线菌则生态幅较宽,对贫、富营养土壤环境均有较好适应性[42-44],本研究中放线菌属于富营养细菌。RB41属、Candidatus_Udaeobacter属、大豆根瘤菌属仅表现出与有效氮等土壤养分因子的相关性,相较优势细菌门,土壤细菌群落在属水平上更高的多样性可能是造成其与土壤含水量、土壤温度等不相关的原因。研究未发现土壤pH 与细菌群落的相关性,可能与土壤pH 随干扰强度变化不显著有关。定量分析土壤变量对土壤细菌群落结构的解释度发现,有效氮对细菌群落结构的影响最大,表明有效氮为多数细菌利用的营养元素,影响多数细菌的生存[45],也证明土壤碳氮循环与土壤细菌之间的密切联系。
干扰改变了林分密度、林分郁闭度,进而导致林分中林窗大小、植被凋落物组成及含量发生变化,土壤理化性质也因此而发生变化。本研究中,与未干扰样地相比,受干扰样地(Ⅰ、Ⅱ级干扰样地)土壤温度显著下降,土壤有机质、有效氮、有效钾、有效锌随干扰等级的增加呈现先减后增的变化趋势,为具有不同策略的细菌生存创造了条件,因此细菌群落的多样性较未干扰样地反而升高。干扰改变了华北亚高山森林土壤细菌生存的土壤环境[46-48],从而影响了细菌群落组成及多样性结构。本文NMDS 结果也证明,对林分的不同干扰强度造成了土壤细菌群落结构在空间上存在显著差异。
4 结论
(1)亚高山华北落叶松-云杉混交林土壤细菌门水平上,变形菌门、未明确细菌门、放线菌门、酸杆菌门是3 个样地土壤中最丰富的细菌群,其中,3种干扰强度土壤样品细菌群落丰度在酸杆菌门呈显著性差异;属水平上,RB41属、Candidatus_Udaeobacter属、大豆根瘤菌属、MND1属是3个样地土壤中最丰富的细菌群,其中,3 种干扰强度土壤样品细菌群落丰度在RB41属、MND1属差异显著。
(2)未干扰样地(N)土壤细菌物种丰富度和均匀度较低,随干扰加大,Ⅰ级干扰样地(S1)各项Alpha 多样性指数均显著提高。随干扰强度由Ⅰ级增至Ⅱ级,对应干扰样地S2 各项指数较S1 有所下降。适度干扰可提高土壤细菌多样性,过轻或过重的干扰都将使土壤细菌多样性降低。对3 个样地细菌群落的差异分析表明,随干扰强度增大,干扰对细菌群落结构的影响变得显著。
(3)与未干扰样地相比,受干扰样地(Ⅰ、Ⅱ级干扰样地)土壤温度显著下降,土壤有机质、有效氮、有效钾、有效锌随干扰等级的增加呈现先减后增的变化趋势。这些土壤因子对土壤细菌群落(门水平和属水平)结构影响显著。土壤理化性质对细菌群落在门水平的模型解释量为63.13%,属水平的解释量为60.66%。其中有效氮对土壤细菌群落结构影响最大,可解释15.61%(门水平)和18.56%(属水平)的土壤细菌群落结构。
