芽孢杆菌加强菌对酱香型白酒酒醅微生物群落及蛋白酶活力的影响
2022-08-31聂士昊张志伟汪俊卿王瑞明张子洋申作树王龙祥李丕武
聂士昊,张志伟,汪俊卿,王瑞明,张子洋,申作树,王龙祥,李丕武
(1.齐鲁工业大学 生物工程学院 山东省微生物工程重点实验室,山东 济南 250300;2.山东福瑞王酒业有限公司,山东 临沂 276600)
酱香型白酒在我国已有上千年历史,因其香味独特、应用广泛、独具魅力而受到大众喜爱,同时其产香机理及风味成分复杂,使得众多研究者致力于酱香风味成分的研究[1-4]。酱香型白酒具有“高温制曲、高温堆积、高温发酵、高温馏酒、生产周期长、贮存周期长”四高两长的工艺特点[5]。以耐热真菌、细菌为主的发酵菌群形成了酱香型白酒独特的风味,其酒体具有“酱香突出,幽雅细腻,酒体醇厚,空杯留香持久”的风味特征,深受消费者青睐[6]。
微生物及其酶系的作用关系是影响香型白酒风味特征形成的重要因素。这些微生物产酶及代谢活动相互作用,最终形成了白酒特殊风味物质。酿酒微生物研究水平直接影响白酒生产技术水平,进而影响白酒的质量、微生物群落结构,尤其是风味微生物菌群结构,对于白酒的产量与质量起着决定性的作用。酱香型白酒特殊的酒体风格就在于其独特酿造工艺所形成的特殊微生物区系[7]。酸性蛋白酶首先能够促进微生物生长;其次能够提高原材料的利用率;还能够提供生香前体物质和风味物质。目前,已有关于产酱香微生物的研究报道,结果表明,芽孢杆菌与产酱香风味关联度比较大[8-9],这些微生物的代谢活动与发酵过程中物理化学反应的相互重迭作用,最终形成了酱香型白酒中一系列特殊的风味物质[10]。王鹏[11]将地衣芽孢杆菌强化后的大曲应用到窖池中,改变了酒醅微生物群落结构,显著提高了酒醅中芳香族化合物的含量。黄晓宁等[12]将优选得到的具有产淀粉酶和蛋白酶能力的地衣芽孢杆菌(Bacillus licheniformis)B.L-1和枯草芽孢杆菌(Bacillus subtilis)B.S-1分别应用于清香型白酒酿造过程中,发现经过强化发酵后均出现了差异代谢物,且4-乙基-2-甲氧基苯酚、辛酸乙酯、3-甲基丁酸乙酯和四甲基吡嗪含量均显著增加。胡宝东等[13]从酱香型大曲中分离出了甲基营养型芽孢杆菌(Bacillus methylotrophicus)(现已归属于贝莱斯芽孢杆菌(Bacillus velezensis)),因其能产高活性的中性蛋白酶、糖化酶、纤维素酶和脂肪酶等,对提高酱香型大曲的品质具有广阔的应用前景。芽孢杆菌的种类和数量将直接决定曲的优劣,在白酒发酵中起着增香、特别是改善白酒后味的重要作用,进而影响酒醅发酵程度和酒的风格特征。关于堆积发酵和窖池发酵过程酒醅中的微生物群落结构研究有利于进一步认识酱香型白酒发酵机理及生产特性[14]。
高通量测序(high-throughput sequencing,HTS)技术,又称第二代测序技术,可以对一个物种的转录组和基因组进行深入、细致、全面的分析,因此也有人把它称为深度测序[15]。目前,高通量测序技术在各个分子生物学领域已经有很广泛的应用[16],如人体微生物、水中微生物、土壤微生物等领域[17-18]。高通量测序技术用于环境微生物群落结构研究具有明显的先进性和优势,它能够快捷方便地读取样品中复杂的微生物菌群结构,有利于对样品中微生物群落多样性进行全面、系统的分析,具有高通量、速度快、准确定量、实时检测等优点[19-20]。通过高通量测序技术,能够从种的水平上鉴定出样品中微生物菌种的组成,并能体现出生产工艺对菌属数量变化的影响,为更好地研究酱香型白酒微生物的功能、对酱香风味的贡献提供技术支持[21]。
为改善白酒酒醅的菌系组成,本研究将芽孢杆菌加强菌接种至白酒酒醅中,通过高通量测序技术考察其对酒醅微生物Alpha多样性及群落结构影响,通过解析第五轮次出池酒醅中微生物群落结构的变化规律提高酒醅蛋白酶活力,以期达到提高酱香型白酒品质及产率的目的,进一步为芽孢杆菌加强菌在酿造酱香型白酒中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
第五轮次出池酒醅样品:由山东福瑞王酒业有限公司和济南瑞丰生物工程有限公司提供。芽孢杆菌(Bacillus):从高温大曲中筛选出的芽孢杆菌。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):北京百奥莱博科技有限公司;氯化钠(分析纯):浙江吉诺生物医药技术有限公司;MagPure土壤脱氧核糖核酸(deoxyribonucleic acid,DNA)LQ试剂盒:翌圣生物科技(上海)股份有限公司;量子比特dsDNA检测试剂盒:上海典森科技有限公司;Tks Gflex DNA聚合酶:日本Takara公司。
1.2 仪器与设备
Biotek SynergyNeo2多功能酶标仪:美国伯腾仪器有限公司;HH-8电热恒温水槽:江苏金坛市金城国胜实验仪器厂;FA2204B欧莱博精密天平:济南来宝医疗器械有限公司;580BR10905聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-rad公司;NextSeq 500高通量测序仪:美国illumlina公司;Nanodrop 2000超微量紫外分光光度计:上海在途生物科技有限公司。
1.3 方法
1.3.1 样品的前处理[22-23]
福瑞王1号和瑞丰1号酒醅:未加入芽孢杆菌加强菌;福瑞王2号和瑞丰2号酒醅:加入芽孢杆菌加强菌。首先分别取酒醅固体样品各5 g分别放入4个100 mL的烧杯中,分别向4个烧杯中加入0.9%NaCl溶液各50 mL,并在每个烧杯中加入玻璃珠后放入涡旋振荡器中搅拌30 min后,放入离心管中在6 000 r/min 条件下冷冻离心8 min,取上清液10 mL于离心管中,备用。
1.3.2 酒醅样品的DNA提取及扩增子测序
采用DNA抽提试剂盒对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳和NanoDrop2000检测DNA的浓度。以酒醅样品的基因组DNA为模板,根据测序区域的选择,使用带barcode的特异引物进行PCR扩增,以确保扩增效率和准确性。所有细菌使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')[19]扩增V4高变区。真菌使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和2043R(5'-GCTGCGTTCTTCATCGATGC-3')[24]扩增高变区。PCR产物使用电泳检测,检测后使用磁珠纯化,纯化后作为二轮PCR模板,并采用上述方法进行二轮PCR扩增,并再次使用电泳检测,检测后使用磁珠纯化,纯化后对PCR扩增产物进行Qubit定量。根据PCR产物浓度进行等量混样,通过Illumina MiSeq 2500平台对文库进行测序。
1.3.3 序列分析
原始数据为FASTQ格式。使用Trimmomatic软件[25]对原始双端序列进行去杂,去杂后的双端序列利用FLASH[26]软件(1.2.11)进行拼接后进行精准去杂,利用UCHIME检测并去除序列中的嵌合体序列。测序数据进行预处理生成优质序列之后,采用Vsearch软件[27](2.8.1),根据序列的相似性,将序列归为多个操作分类单元(operational taxonomic unit,OTU),参数为序列相似度≥97%被归为一个OTU。使用QIIME2(v2020.11)软件包[28]挑选出各个OTU的代表序列,并将所有代表序列与数据库进行比对注释。16S rRNA、18S rRNA使用Silva(version138)数据库比对,物种比对注释使用核糖体数据库项目(ribosomal database project,RDP)classifier[29]软件插件的join-pairs、quantity-filter、dereplicatesequences模块对去除引物的双端序列进行拼接、质控和去冗余,保留置信区间>0.7的注释结果。引物内转录间隔区(internaltranscribed spacer,ITS)使用Unite数据库比对。物种比对注释使用基本局部比对搜索工具(basic local alignment search tool,BLAST)[30]软件。基于以上检测结果计算Alpha多样性指数。本研究将在酒醅中存在且平均相对丰度>1%的细菌和真菌的门、属定义为优势细菌和真菌的门、属;在酒醅中存在且平均相对丰度>30%的细菌和真菌的门、属定义为第一优势细菌和真菌的门、属。
1.3.4 酸性蛋白酶活力的测定
酸性蛋白酶活力的测定:参照GB/T 23527—2009《蛋白酶制剂》。蛋白酶活力定义:在一定pH值和温度条件下,1 mL酶液每分钟内酪蛋白水解所产生1 μg酪氨酸的酶量为1个酶活力单位(U/mL)。
2 结果与分析
2.1 酒醅样品中真菌及细菌菌群Alpha多样性分析结果
2.1.1 酒醅样品中真菌和细菌群落分布丰度
用Chao1算法估计群落中含OTU数目的指数,Chao1指数在生态学中常用来估计物种总数,Chao1指数越大,说明群落分布丰度越高[31]。酒醅样品中真菌和细菌群落的Chao1指数见表1。

表1 酒醅样品中真菌和细菌群落的Chao1指数Table 1 Chao1 index of fungal and bacterial communities in fermented grains samples
由表1可知,在群落丰度方面,加入芽孢杆菌的酒醅样品(福瑞王2号和瑞丰2号)真菌菌群的Chao1值分别为174.6、55,细菌菌群的Chao1指数分别为200.4、218.9,均高于未加入芽孢杆菌的酒醅样品(福瑞王1号和瑞丰1号)的真菌、细菌菌群Chao1指数,说明加入芽孢杆菌能够提高微生物群落丰度。
2.1.2 酒醅样品中真菌和细菌群落分布多样性
Shannon指数用来估算样品中微生物多样性指数之一。Shannon指数越大,说明群落多样性越高[32]。酒醅样品中真菌和细菌群落的Shannon指数见表2。

表2 酒醅样品中真菌和细菌群落的Shannon指数Table 2 Shannon index of fungal and bacterial communities in fermented grains samples
由表2可知,在群落分布多样性方面,加入芽孢杆菌的酒醅样品(福瑞王2号和瑞丰2号)真菌菌群Shannon指数分别为3.08、0.96,细菌菌群Shannon指数分别为1.29、2.91,均高于未加入芽孢杆菌的酒醅样品(福瑞王1号和瑞丰1号)的真菌、细菌菌群Shannon指数,说明加入芽孢杆菌能够提高微生物群落分布多样性。
2.2 不同酒醅样品微生物群落结构分析结果
2.2.1 福瑞王样品基于门、属水平真菌菌群分析结果
分别在门水平和属水平上计算福瑞王样本真菌菌群物种的相对丰度,结果见图1。
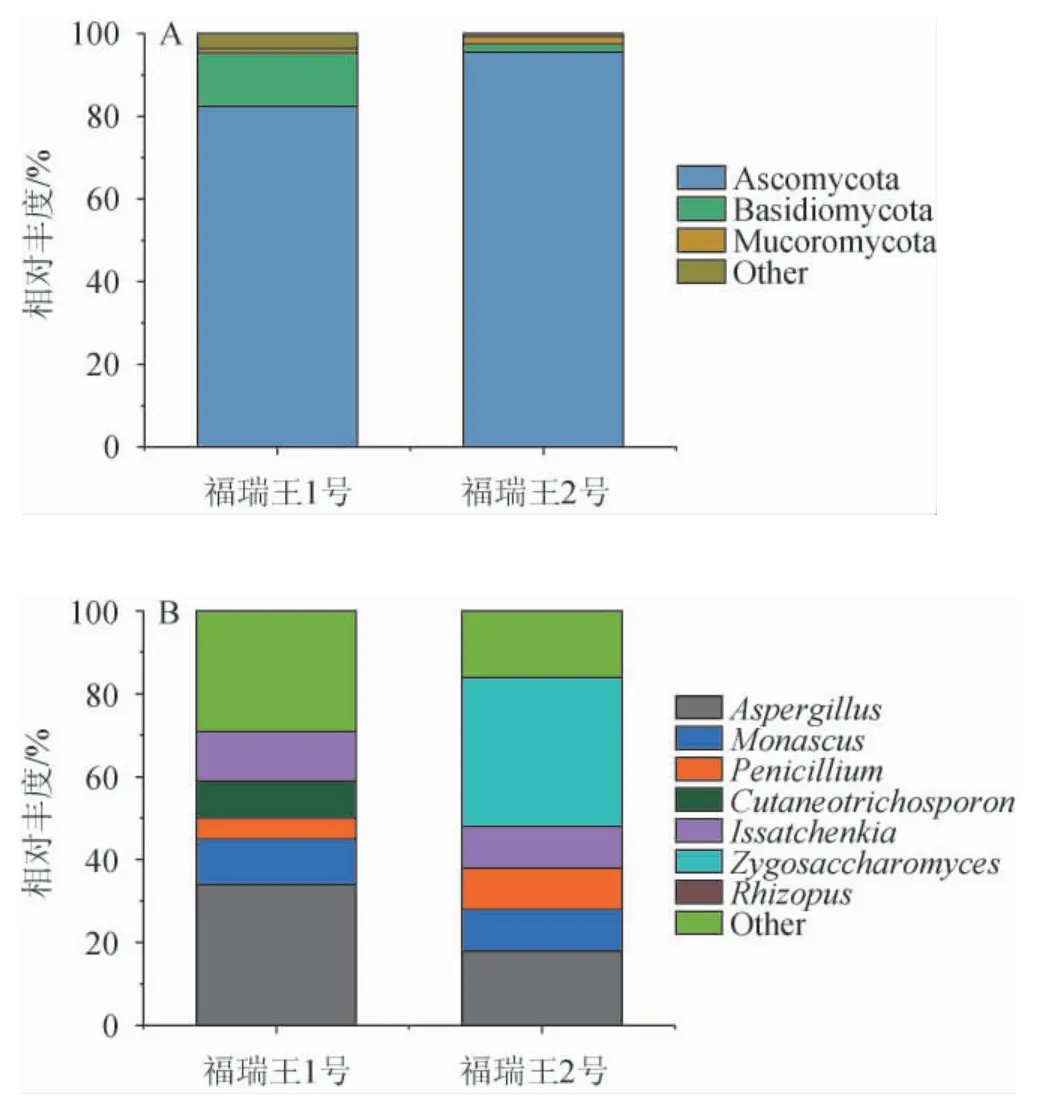
图1 基于门水平(A)和属水平(B)福瑞王酒醅样品中真菌群落结构的分析结果Fig. 1 Analysis results of fungal community structure in Furuiwang fermented grains samples based on phylum (A) and genus (B) level
由图1(A)可知,福瑞王1号共检出3个优势真菌门,包括子囊菌门(Ascomycota)(82.53%)、担子菌门(Basidiomy cota)(13%)、毛霉菌门(Mucoromycota)(1.10%);福瑞王2号共检出3个优势真菌门,包括子囊菌门(Ascomycota)(95.54%)、担子菌门(Basidiomycota)(2%)、毛霉菌门(Mucoromycota)(1.8%)。在两个样品中,第一优势真菌门均为子囊菌门(Ascomycota)。
由图1(B)可知,福瑞王1号共检出5个优势真菌属,包括曲霉属(Aspergillus)(34%)、伊萨酵母菌属(Issatchenkia)(12%)、红曲菌属(Monascus)(11%)、皮丝孢子菌属(Cutaneotrichosporon)(9%)、青霉属(Penicillium)(5%),第一优势真菌属为曲霉属(Aspergillus);福瑞王2号共检出5个优势真菌属,包括接合酵母属(Zygosaccharomyces)(36%)、曲霉属(Aspergillus)(18%)、红曲菌属(Monascus)(10%)、青霉属(Penicillium)(10%)、伊萨酵母菌属(Issatchenkia)(10%),第一优势真菌属为接合酵母属(Zygosaccharomyces)。
2.2.2 福瑞王样品基于门、属水平细菌菌群分析结果
分别在门水平和属水平上计算福瑞王样本细菌菌群物种的相对丰度,结果见图2。
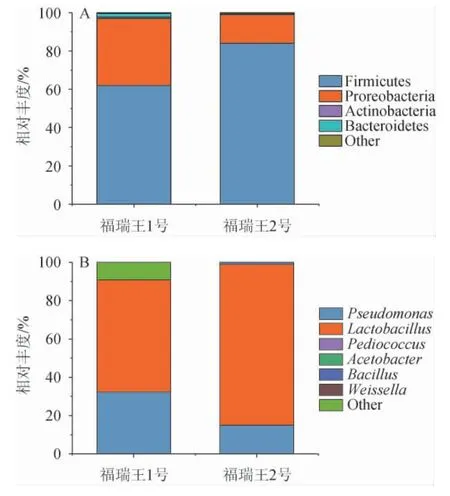
图2 基于门水平(A)和属水平(B)福瑞王酒醅样品中细菌群落结构的分析结果Fig. 2 Analysis results of bacterial community structure in Furuiwang fermented grains samples based on phylum (A) and genus (B) level
由图2(A)可知,福瑞王1号共检出3个优势细菌门,包括厚壁菌门(Firmicutes)(62%)、变形菌门(Proreobacteria)(35%)、拟杆菌门(Bacteroidetes)(2%);福瑞王2号共检出2个优势细菌门,包括厚壁菌门(Firmicutes)(84%)、变形菌门(Proreobacteria)(15%),第一优势细菌门均为厚壁菌门(Firmicutes)。
由图2(B)可知,福瑞王1号共检出2个优势细菌属,包括乳杆菌属(Lactobacillus)(58%)、假单胞菌属(Pseudomonas)(32%);福瑞王2号共检出3个优势细菌属,包括乳杆菌属(Lactobacillus)(84%)、假单胞菌属(Pseudomonas)(15%)、芽孢杆菌属(Bacillus)(1%),第一优势细菌属均为乳杆菌属(Lactobacillus)。
2.2.3 瑞丰样品基于门、属水平真菌菌群分析结果
分别在门水平和属水平上计算瑞丰样本真菌菌群物种的相对丰度,结果见图3。
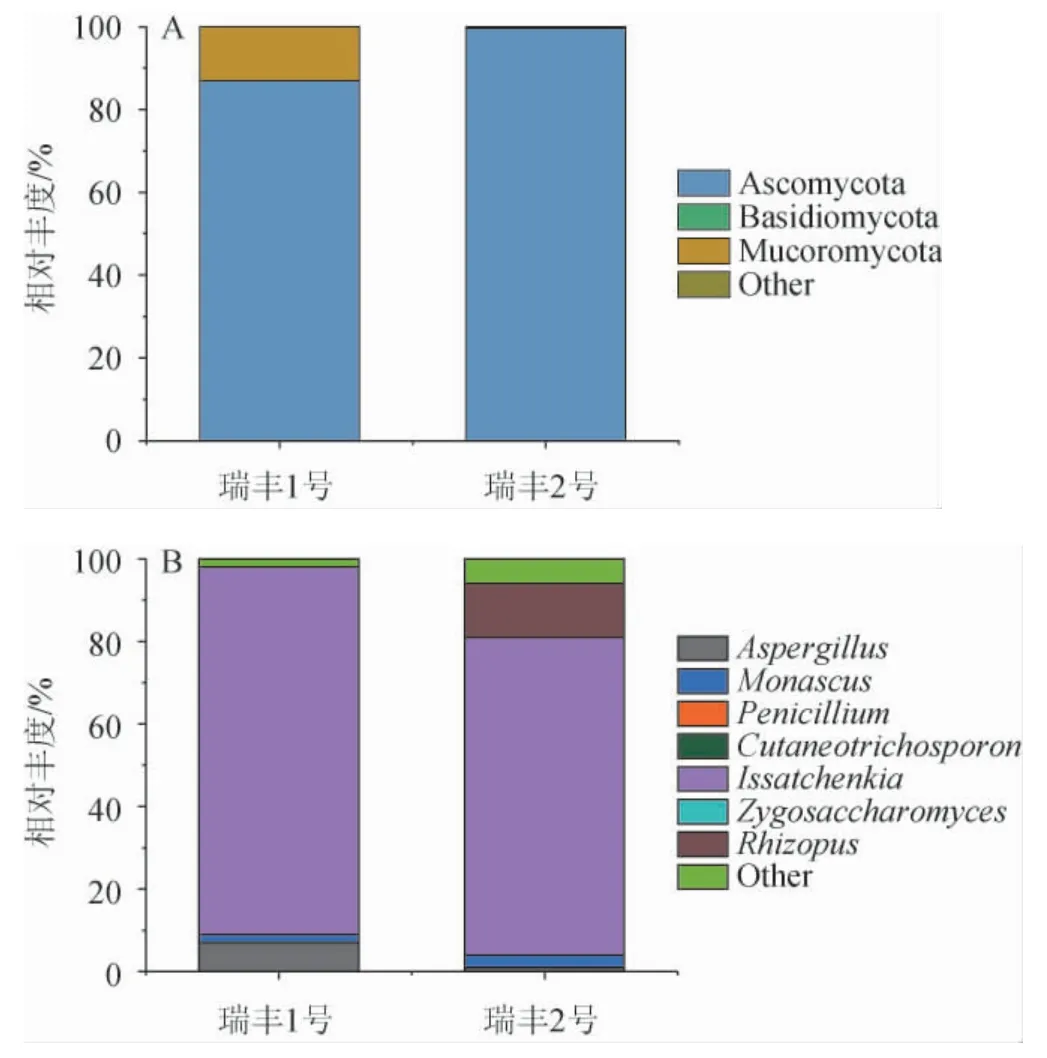
图3 基于门水平(A)和属水平(B)瑞丰酒醅样品中真菌群落结构的分析结果Fig. 3 Analysis results of fungal community structure in Ruifeng fermented grains samples based on phylum (A) and genus (B) levels
由图3(A)可知,瑞丰1号共检出2个优势真菌门,包括子囊菌门(Ascomycota)(86.98%)、毛霉菌门(Mucoromycota)(13%);瑞丰2号共检出1个优势真菌门,为子囊菌门(Ascomycota)(99.7%)。在两个样品中,第一优势真菌门均为子囊菌门(Ascomycota)。
由图3(B)可知,瑞丰1号共检出3个优势真菌属,包括伊萨酵母菌属(Issatchenkia)(89%)、曲霉属(Aspergillus)(7%)、红曲菌属(Monascus)(2%);瑞丰2号共检出3个优势真菌属,包括伊萨酵母菌属(Issatchenkia)(77%)、根酶属(Rhizopus)(13%)、红曲菌属(Monascus)(3%)。在两个样品中,第一优势真菌属均为伊萨酵母菌属(Issatchenkia)。
2.2.4 瑞丰样品基于门、属水平细菌菌群分析结果
分别在门水平和属水平上计算瑞丰样本细菌菌群物种的相对丰度,结果见图4。
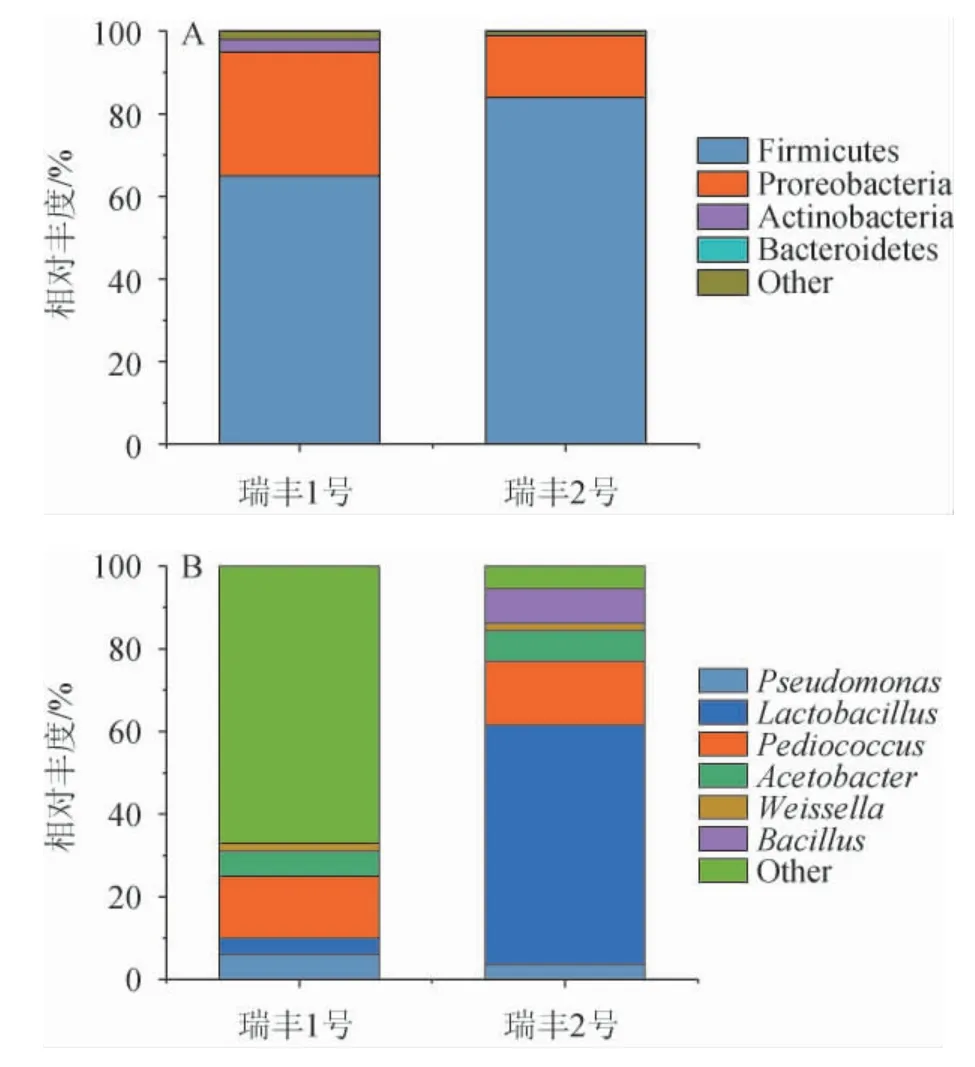
图4 基于门水平(A)和属水平(B)瑞丰酒醅样品中细菌群落结构的分析结果Fig. 4 Analysis results of bacterial community structure in Ruifeng fermented grains samples based on phylum (A) and genus level (B)
由图4(A)可知,瑞丰1号共检出3个优势细菌门,包括厚壁菌门(Firmicutes)(65%)、变形菌门(Proreobacteria)(30%)、放线菌门(Actinobacteria)(3%);瑞丰2号共检出2个优势细菌门,包括厚壁菌门(Firmicutes)(84%)、变形菌门(Proreobacteria)(15%)。在两个样品中,第一优势细菌门均为厚壁菌门(Firmicutes)。
由图4(B)可知,瑞丰1号共检出5个优势细菌属,包括片球菌属(Pediococcus)(15%)、醋酸杆菌属(Acetobacter)(6%)、假单胞菌属(Pseudomonas)(6%)、乳杆菌属(Lactobacillus)(4%)、魏斯式菌属(Weissella)(2%);瑞丰2号共检出6个优势细菌属,包括乳杆菌属(Lactobacillus)(55%)、片球菌属(Pediococcus)(17%)、芽孢杆菌属(Bacillus)(9%)、醋酸杆菌属(Acetobacter)(8%)、假单胞菌属(Pseudomonas)(4%)、魏斯氏菌属(Weissella)(2%),第一优势细菌属为乳杆菌属(Lactobacillus)。
2.3 酒醅样品的酸性蛋白酶活力
福瑞王1号样品的酸性蛋白酶活力为2.04×104U/mL,福瑞王2号样品的酸性蛋白酶活力为3.00×104U/mL,蛋白酶活力提高了9.6×103U/mL。瑞丰1号酸性蛋白酶活力为3.22×104U/mL,瑞丰2号样品酸性蛋白酶活力为3.57×104U/mL,蛋白酶活力提高了3.5×103U/mL。其中,福瑞王2号样品的酸性蛋白酶活力提高尤为明显,增加了47.1%。因此,加入芽孢杆菌加强菌可以明显影响样品中酸性蛋白酶的活力,可以使样品中酸性蛋白酶的活力明显提高。
3 结论
从高通量测序结果分析来看,加强菌芽孢杆菌的加入明显提升了微生物群落的分布丰度和群落分布多样性,同时促进了微生物的生长,进而能够更好的提高白酒的风味与品质;加入芽孢杆菌加强菌的实验组样品的酸性蛋白酶活力均明显高于未加入芽孢杆菌的空白组样品,其中,福瑞王样品的酸性蛋白酶活力提高尤为明显,增加了47.1%。该研究可为酱香型白酒品质和风味的提高鉴定理论研究基础。
