传统牦牛酸奶中产细菌素乳酸菌的筛选及鉴定
2022-08-31梁小东雷江英沈凡钰陈德纯
梁小东,汤 承,2,雷江英,沈凡钰,陈德纯,2
(1.西南民族大学 畜牧兽医学院,四川 成都 610041;2.动物医学四川省高校重点实验室,四川 成都 610041)
传统发酵牦牛酸奶由天然发酵的方式制备,富含丰富的微生物菌群,由于西藏地区地势海拔高、空气稀薄,长期处于该环境下的菌种多具备独特的生理机能[1],而传统发酵方式较好地保存了自然环境下的微生物,尤其是乳酸菌。乳酸菌(lactic acid bacteria)是一类利用碳水化合物产生乳酸的细菌总称[2],被公认为安全性微生物[3],种类多样、数量庞大,具备拮抗病原菌、调节肠道微生物平衡等多种益生功能[4]。已有关于具备益生功能乳酸菌的研究报道,如黄坚等[5]从传统牦牛发酵酸奶中筛选出能提高动物生长性能和免疫功能的耐久肠球菌(Enterococcus durans);董翎逸等[6]对益生性屎肠球菌(Enterococcus faecium)WEFA23和海氏肠球菌(Enterococcus hirae)WEHI01的荷叶发酵上清液进行抑菌及抗氧化性能评价;许英瑞等[7]以野生黑枸杞为原料,优化超声波提取黑枸杞多糖的工艺条件,研究黑枸杞多糖对嗜热链球菌(Streptococcus thermophilus)G2与副干酪乳杆菌(Lactobacillus paracasei)L9生长特性的影响以及对2株乳酸菌抗氧化能力的影响。
细菌素是由乳酸菌核糖体合成的一类抑菌肽,具有无毒无害、高效抑菌性能、不易残留、不产生抗性等特点受到广泛关注[8]。细菌素可通过阻碍病原菌细胞壁的合成,形成质膜孔道;还能阻止病原菌遗传物质的复制,以及蛋白质的脂质合成等方式对病原菌产生抑制作用[9]。细菌素主要由多肽或抗菌蛋白组成,不产生抗性,也是天然的防腐剂[10]。近年来,不合理的抗生素使用及耐药基因的遗传导致抗生素耐药问题严重[11-13],对养殖产业造成严重影响,甚至危害人体健康,因此,寻找抗生素的替代品尤为重要,而细菌素可以成为未来抗生素最有效的替代品[14]。目前国内外关于产细菌素乳酸菌的研究报道有很多,用产细菌素乳酸菌改善发酵食品的风味和质量[15]、抑制病原微生物[16-17]等,但关于牦牛源乳制品产细菌素乳酸菌的研究较少。
本研究采用含0.5%CaCO3的MRS固体培养基结合溴甲酚紫葡萄糖蛋白胨水(bromocresol purple glucose peptone water,BCP)培养基对来自青海海南藏族自治区、四川阿坝、甘孜理塘的传统牦牛酸奶中的乳酸菌进行分离筛选,采用形态学观察和16S rRNA序列分析对筛选菌株进行鉴定,并测定筛选菌株上清液对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)抑菌性能;考察筛选菌株上清液对蛋白酶的耐受性及对抗生素的敏感性,并确定细菌素种类。以期为细菌素的产品开发寻找安全有效的益生菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
传统牦牛酸奶样本:来自四川阿坝州红原县1份(编号为1#)、甘孜州理塘县4份(编号为2#~5#)、青海海南藏族自治区2份(编号为6#~7#)。
金黄色葡萄球菌ATCC25923、大肠杆菌ATCC25922:由西南民族大学动物医学实验室提供。
1.1.2 试剂
蛋白酶K(30 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(15 000 U/mg)、脱氧核糖核酸(deoxyribonucleic acid,DNA)标记MarkerA、聚合酶链式反应(polymerase chain reaction,PCR)、2×TaqPCR Master Mix及16S引物:上海生工生物工程股份有限公司;庆大霉素、米诺环素、四环素、氯霉素、诺氟霉素、环丙沙星、氨苄西林药敏纸片:杭州微生物试剂有限公司;盐酸(1 mol/L)、氢氧化钠(2 mol/L)、过氧化氢酶(5 000 U/mg)、DNA提取液、10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、氯化钠:索莱宝生物科技有限公司。本实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
BCP培养基、莫匹罗星锂盐和半胱氨酸盐酸盐MRS肉汤培养基、莫匹罗星锂盐和半胱氨酸盐酸盐MRS固体培养基:上海生工生物工程股份有限公司;水解酪蛋白(mueller hinton,MH)培养基、营养琼脂(nutrient agar,NA)培养基、胰酪胨大豆肉汤(trypticase soy broth,TSB)培养基:青岛海博生物科技有限公司。
1.2 仪器与设备
ZQLY-180S 振荡培养箱:上海知楚仪器有限公司;DYY-3C型电泳仪:北京六一仪器厂;TGL-16K医用离心机:湖南湘仪实验室仪器开发有限公司;NAnoDROP ONE超微量核酸蛋白测定仪、VeritiTM聚合酶链式反应(PCR)核酸扩增仪:赛默飞世尔科技(中国)有限公司;UV-6100紫外可见分光光度仪:上海仪电分析仪器有限公司;FR-980A生物电泳图像分析系统:上海复日科技有限公司;牛津杯(内径6 mm,外径8 mm,高10 mm):成都诺舟生物技术有限公司。
1.3 方法
1.3.1 乳酸菌的分离与纯化
取1 mL酸奶样品于9 mL的无菌水中,振荡混合均匀,按照10倍系列梯度稀释。分别吸取0.3 mL乳酸菌数为104CFU/mL、105CFU/mL、106CFU/mL的样品涂布于含0.5%CaCO3的MRS培养基[18],在37 ℃培养48 h后观察结果。挑选具有溶钙圈的菌落,再分别挑选不同菌落形态的单菌落涂布于含溴甲酚紫的BCP培养基中,37 ℃培养48 h,挑选能使BCP培养基颜色由紫变黄的菌落[19],且在MRS培养基上划线、培养,反复纯化,得到单个菌落。将纯化的单菌落用甘油保存于-20 ℃冰箱,备用。
1.3.2 产细菌素乳酸菌的鉴定
(1)形态学观察
将筛选菌株的单菌落接种于MRS固体培养基,37 ℃培养24 h,采用革兰氏染液进行染色并进行显微镜观察,根据《伯杰细菌鉴定手册》对乳酸菌进行菌落及细胞形态观察。
(2)分子生物学鉴定
DNA的提取:通过酚-氯仿法提取具有抑菌活性的菌株DNA,用超微量核酸蛋白测定仪检测DNA浓度和纯度,以A260nm/A280nm>1.8和A260nm/A230nm>2.0为判定标准。
PCR扩增:以提取的菌株DNA为模板,选择16S rRNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系为:DNA模板1 μL,2×TaqPCR Master Mix10 μL,27F 0.5 μL,1492R 0.5 μL,双蒸水(ddH2O)补齐20 μL,PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,70 ℃延伸45 s,30个循环;70 ℃再延伸5 min。
琼脂糖凝胶电泳:使用浓度为2%的琼脂糖凝胶,以1×TAE缓冲液为电泳介质对PCR扩增产物进行检测。电泳条件:电压120 V,电流200 mA,时间25 min[20]。选择目标条带产物分子质量大小在1 500 bp的样品送擎科生物有限公司双向测序,测序结果选用软件SeqMan 6.0进行序列拼接,并剪去多余的片段,将测序结果提交至美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)中的GenBank数据库中进行局部比对基本检索工具(basic local alignment search tool,BLAST)比对,利用MEGA 11软件的邻接(neighbor-joining,NJ)法bootstrap method值为1 000构建系统发育树,确定菌株种属关系。
1.3.3 产细菌素乳酸菌抑菌活性的测定
筛选菌株发酵上清液制备:挑选筛选菌株的单个菌落接种到MRS液体培养基中,37 ℃恒温箱静置培养24 h后,得到菌株种子液。采用高速冷冻离心机于10 000 r/min、4 ℃离心15 min获得上清液。用0.22 μm一次性无菌过滤器除去上清液中的菌体及其他杂质之后保存备用[21]。
质控菌株菌悬液的制备:吸取金黄色葡萄球菌和大肠杆菌冻存菌液,TSB培养基传2~3代,使菌液活性得到恢复,然后按1%的比例重新接种TSB培养基,37 ℃培养6 h,调整菌悬液OD600nm值为0.5,备用。
抑菌性能测定:采用牛津杯法[22]抑菌试验筛选菌株发酵上清液的抑菌能力,检测平板选用NA培养基。
1.3.4 有机酸和过氧化氢排除实验
通过pH计测定各产细菌素菌株无细胞培养液的pH,将上清液pH值用盐酸和氢氧化钠调到6.0[23],并且滴加过氧化氢酶进行处理,37 ℃水浴2 h,以同样pH值的MRS肉汤培养基进行对比。质控菌株选用金黄色葡萄球菌和大肠杆菌做牛津杯抑菌试验[24]。
1.3.5 细菌素对蛋白酶的耐受性
取3份等量的上清液,用氢氧化钠和盐酸将上清液的pH值调到蛋白酶K、胰蛋白酶、胃蛋白酶的最适pH值,分别为7.6、7.6、3.0,将各蛋白酶用无菌水溶解成质量浓度为2 mg/mL的母液,等体积加入发酵上清液中[25],37 ℃水浴孵育1 h后,使蛋白酶失活。以未处理的上清液为对照,将pH值调至6.0,采用牛津杯法做抑菌试验[26]。
1.3.6 抗生素敏感性实验
采用K-B纸片法检测筛选菌株对常见抗生素的敏感性[27],根据美国临床和实验室标准协会(clinical and laboratory shandards institute,CLSI)标准判断受试菌株氨苄西林等7种抗菌药物的药敏性[28]。将方法1.3.3筛选菌株的种子液按1%(V/V)的比例接种于MRS肉汤培养基,37 ℃恒温培养箱培养12 h。取0.1 mL菌悬液接种于TSB培养基中,200 r/min恒温摇床振荡6 h后,采用无菌水将菌悬液浓度校正为0.5麦氏比浊度。用一次性无菌棉签蘸取混合均匀的菌悬液,均匀涂布于MH培养基,待表面菌液稍稍干燥,药敏片依次贴于培养基表面,每个平皿平均分4个区域,于各中间位置放置,并轻按药敏片,使药敏片与培养基之间不留空隙,单层放置于37 ℃恒温培养箱中培养16~18 h,测量抑菌圈直径[29],记录结果。
1.3.7 细菌素基因的确定
按照1.3.2的方法提取筛选菌株的DNA,参考王晓蕊等[30]的方法设计目的基因引物,由上海生工生物工程股份有限公司合成肠球菌素相关的9种引物,具体引物设计见表1。以提取的DNA为模板,对目的基因进行PCR扩增,扩增体系为模板1 μL,2×TaqPCR Master Mix10 μL,上下游引物各0.5 μL,双蒸水(ddH2O)补齐20 μL,PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,退火温度见表1,退火30 s,70 ℃延伸45 s,30个循环;70 ℃再延伸5 min,所得PCR产物用3.5%琼脂糖凝胶电泳检测。

表1 肠球菌素相关引物设计Table 1 Design of enterococcin related primers
2 结果与分析
2.1 乳酸菌的分离纯化与形态学观察
从7份传统牦牛酸奶样品中共分离得到6株有明显溶钙圈的菌株,将分离自四川阿坝样本的菌株分别命名为菌株A1、A2,分离自甘孜理塘样本的菌株命名为G1、G2、G3和G4,代表菌株G3的菌落及细胞形态见图1。
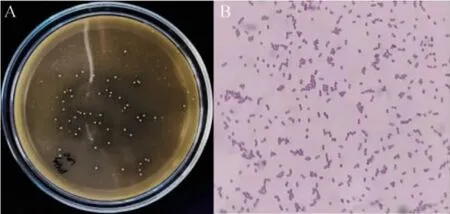
图1 代表菌株G3的菌落形态(A)及细胞形态(B)(×1 000)Fig. 1 Colony (A) and cell morphology (B) of representative strain G3(×1 000)
由图1可知,菌株形态为凸起、边缘整齐的乳白色的单菌落,经革兰氏染色镜检发现,菌体细胞呈圆形或椭圆形,单个、成对或短链状排列的革兰氏阳性球菌。
2.2 筛选菌株的分子生物学鉴定
6株菌株的PCR扩增产物经过凝胶电泳检测,结果见图2。由图2可知,PCR扩增产物目的条带清晰,碱基长度约为1 500 bp,与预期结果相符。
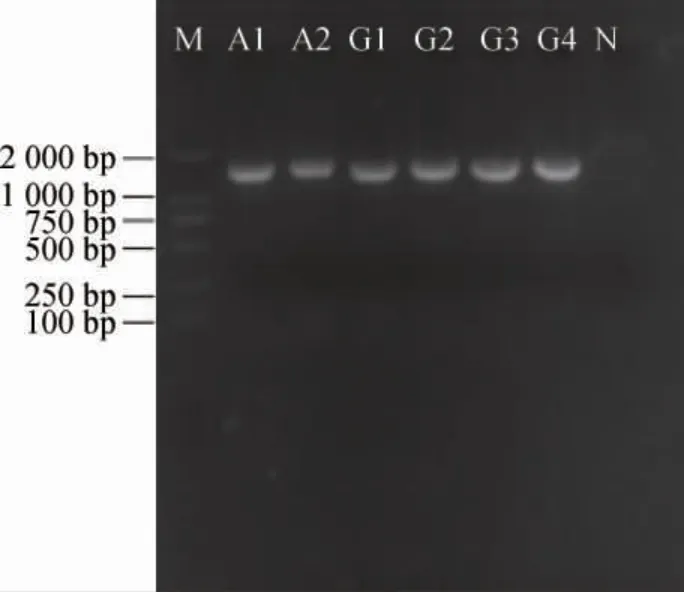
图2 筛选菌株的PCR扩增产物的琼脂糖凝胶电泳结果Fig. 2 Agarose electrophoresis results of PCR amplification products of screened strains
6株乳酸菌的16S rRNA基因测序后在NCBI数据库进行BLAST比对,比对结果见表2。
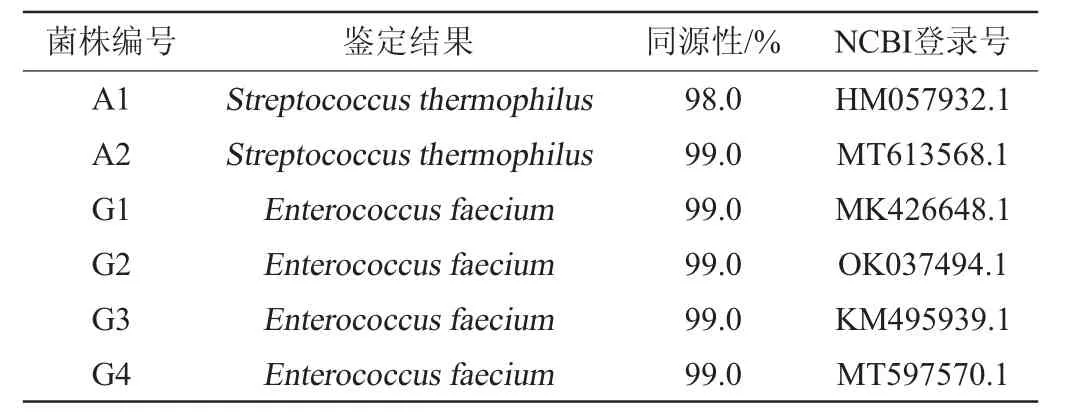
表2 不同菌株的16S rRNA基因序列比对结果Table 2 Comparison results of 16S rRNA gene sequences of different strains
由表2可知,菌株A1和嗜热链球菌(Streptococcus thermophilus)的同源性达98.0%,菌株A2和嗜热链球菌(Streptococcus thermophilus)的同源性达99.0%,菌株G1~G4和屎肠球菌(Enterococcus faecium)的同源性均达99.0%。应用MEGA 11软件构建系统发育树,结果见图3。


图3 基于16S rRNA基因序列菌株A1~A2(A)与G1~G4(B)的系统发育树Fig. 3 Phylogenetic tree of strain A1-A2 (A) and G1-G4 (B) based on 16S rRNA gene sequence
由图3可知,菌株A1~A2与嗜热链球菌(Streptococcus thermophilus)亲缘关系最近;菌株G1~G4屎肠球菌(Enterococcus faecium)亲缘关系较近。根据不同菌株的菌落特征、显微镜观察特征、16S rRNA基因序列分析结果,将菌株A1~A2鉴定为嗜热链球菌(Streptococcus thermophilus),菌株G1~G4鉴定为屎肠球菌(Enterococcus faecium)。
2.3 产细菌素乳酸菌抑菌活性的测定
产细菌素乳酸菌对大肠杆菌和金黄色葡萄球菌抑菌活性的测定结果见表3。由表3可知,菌株A1、A2、G1、G2、G3、G4对大肠杆菌和金黄色葡萄球菌均具有抑制作用,且抑菌圈直径均≥13 mm。

表3 产细菌素乳酸菌对大肠杆菌和金黄色葡萄球菌抑菌活性的测定结果Table 3 Determination results of antibacterial activity of bacteriocinproducing lactic acid bacteria against Escherichia coli and Staphylococcus aureus
2.4 有机酸和过氧化氢抑菌排除试验
对不同菌株进行排除酸和H2O2试验后观察菌株的抑菌活性,结果见表4。
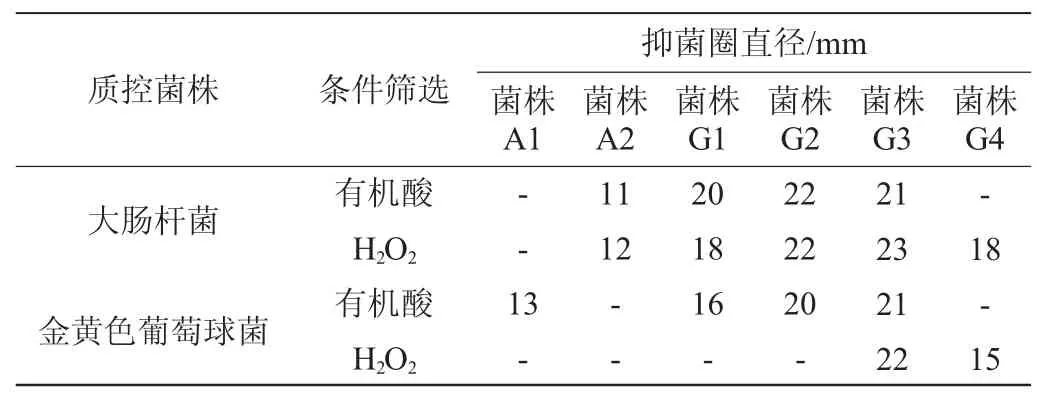
表4 有机酸和H2O2的抑菌排除试验结果Table 4 Results of bacteriostatic exclusion test of organic acid and H2O2
由表4可知,只有菌株G3对大肠杆菌和金黄色葡萄球菌均具有抑菌活性,且牛津杯抑菌圈直径>20 mm,其原因可能是,发酵液中除了这两种物质,还有其他物质可以抑制菌株的生长。根据农业部发布的饲料添加剂品种目录显示,屎肠球菌是被批准适用于养殖动物的一种添加剂,其可以抑制肠道病原微生物,还能促进畜禽的生长发育[31-32]。王永等[33]的研究表明,在饲料中添加屎肠球菌对仔猪生长性能有明显改善,并且能够维持肠道菌群平衡,显著增强仔猪免疫力。此外黄怡等[34]的研究表明,给予哺乳仔猪屎肠球菌可以明显改善肠道菌群构成,促进肠道的健康。
2.5 蛋白酶耐受性
菌株G3发酵上清液分别用蛋白酶K、胰蛋白酶、胃蛋白酶水解,通过观察抑菌圈直径,考察发酵上清液对蛋白酶的耐受性,结果见图4。由图4可知,发酵液经3种蛋白酶水解后抑菌圈完全丧失,表明菌株G3发酵液中起主要抑菌活性的物质为蛋白类,初步判断为细菌素。

图4 不同蛋白酶对抑菌物质的影响Fig. 4 Effect of different protease on antibacterial material
2.6 产细菌素乳酸菌的药物敏感性
对大肠杆菌、金黄色葡萄球菌和菌株G3的抗生素敏感性进行测定,结果见表5。由表5可知,菌株G3对抗生素氨苄西林、庆大霉素、四环素、米诺环素、环丙沙星、诺氟霉素、氯霉素均表现出敏感性。
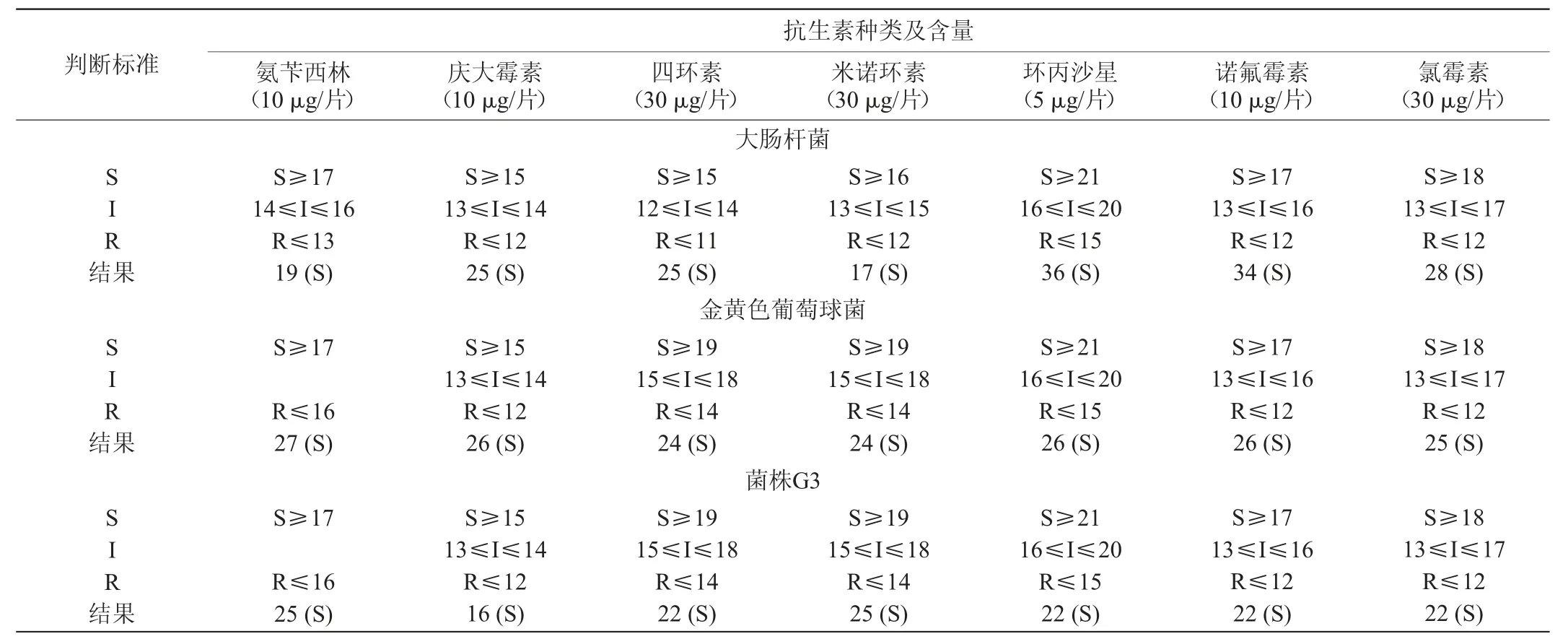
表5 抗生素敏感实验结果Table 5 Results of antibiotic sensitivity tests mm
2.7 菌株G3细菌素基因的鉴定
由图5可知,菌株G3细菌素以ENTP和ENTA为引物的PCR产物大小在100~150 bp之间,与该引物扩增目的片段大小基本相符,所以,初步确定菌株G3产细菌素基因为肠球菌素A和肠球菌素P。
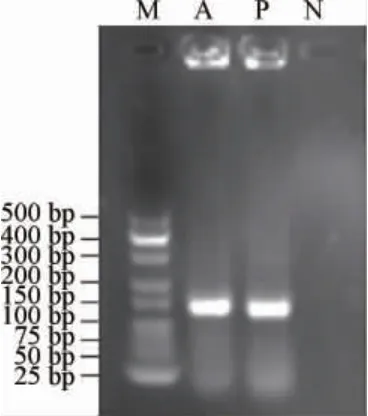
图5 产细菌素乳酸菌G3的PCR扩增产物电泳结果Fig. 5 Electrophoretic results of PCR amplification products of bacteriocin-producing lactic acid bacteria G3
3 结论
本研究从来自青海海南藏族自治区、四川阿坝、甘孜理塘的传统牦牛酸奶中筛选得到6株产细菌素乳酸菌,根据菌株的形态学观察、分子生物学鉴定,鉴定菌株A1~A2为嗜热链球菌(Streptococcus thermophilus)、菌株G1~G4屎肠球菌(Enterococcus faecium);6株菌对大肠杆菌和金黄色葡萄球菌的抑菌圈直径均>15 mm。经过排除酸、H2O2,仅菌株G3发酵上清液对金黄色葡萄球菌、大肠杆菌仍具有较强的抑菌活性(抑菌圈直径>20 mm);经蛋白酶K、胰蛋白酶、胃蛋白酶水解,表现为不耐受。因此,菌株G3中起到抑菌作用的物质为蛋白质或者多肽类;对常见抗生素敏感;初步确定为肠球菌素A和肠球菌素P,是一株可以产细菌素的益生菌候选菌株。
