黄斑蓝子鱼Δ6Δ5 Fads2蛋白重组表达和多克隆抗体的制备
2022-08-31陈翠英范春兰钟文杰陈创思李远友王树启
陈翠英,程 宇,王 懿,范春兰,钟文杰,陈创思,李远友,王树启*
(1.汕头大学海洋生物研究所 广东省海洋生物技术重点实验室,广东 汕头 515063;2.华南农业大学海洋学院,广东 广州 510642)
0 引言
高不饱和脂肪酸(HUFA)也称长链多不饱和脂肪酸(LC-PUFA)是脊椎动物维持正常生长发育的必需脂肪酸(EFA),主要包括22∶6n-3(DHA),20∶5n-3(EPA)及20∶4n-6(ARA)[1-2].由于缺乏Δ12与Δ15脂肪酸去饱和酶(Fad),脊椎动物自身不能从头合成C18PUFA,必须从食物中摄取,特别是18∶2n-6与18∶3n-3[2],但能在多种Fad与碳链延长酶(Elovl)的催化下,利用C18PUFA合成碳链更长及双键更多的LC-PUFA.Fads可将烯基引入脂肪酸的碳链中,增加其不饱和度[3].哺乳动物中的Fads家族有关的基因有fads1、fads2与fads3三种[4],而研究表明在鱼类中只有fads2基因决定了其Fad的活性[5],但能表达Δ4、Δ5、Δ6、Δ8 Fad等多种去饱和酶[6].
黄斑蓝子鱼(Siganus canaliculatu)是首个被发现的具有LC-PUFA合成能力的海水鱼类,其LC-PUFA合成途径的关键酶基因,包括去饱和酶(Δ6Δ5 Fads2、Δ4 Fads2)和碳链延长酶(Elovl4、Elovl5、Elovl8b)基因均已被克隆与鉴定[7-10].其中,Δ6Δ5 Fads2是参与蓝子鱼LC-PUFA内源性合成途径的第一个关键酶,分别能将18∶3n-3(ALA)和18∶2n-6(LA)转化为18∶4n-3和18∶3n-6[10-11],故被称为LC-PUFA生物合成途径的限速酶,其表达量和酶活性影响着鱼类体内LC-PUFA生物合成的水平.然而,目前尚无鱼类相关的Fads2抗体,无法深入研究鱼类LC-PUFA合成调控机制.因此,本文拟通过构建蓝子鱼Δ6Δ5 Fads2蛋白原核表达载体并进行诱导表达与纯化,制备Δ6Δ5 Fads2蛋白多克隆抗体并分析其特异性,为深入探讨蓝子鱼Δ6Δ5 Fads2的生物学功能及其表达调控机制提供基础条件,从而有助于研发提高鱼体内源性LC-PUFA合成能力的方法,降低养殖鱼类饲料中鱼油添加比例,促进水产养殖业的健康发展.
1 材料与方法
1.1 材料
黄斑蓝子鱼基因组DNA和感受态细胞BL21(DE3)均由本实验室保存;原核表达载体pGEX-6p-1与动物组织蛋白裂解液购于上海生工科技有限公司;实验过程中所用引物由上海生工科技有限公司合成;胶回收试剂盒及质粒小提试剂盒均购于Omega公司;限制性内切酶EcoR I、BamH I和T4 DNA Ligase均购于Takara公司;弗氏佐剂、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、GST标签蛋白纯化试剂盒、ELISA试剂盒、BCA蛋白浓度检测及化学发光试剂盒均购于碧云天生物技术公司;其余试剂均为分析纯试剂.小鼠购于汕头大学医学院实验动物中心.
1.2 方法
1.2.1 Δ6Δ5 fads2基因片段的克隆
从NCBI中获取黄斑蓝子鱼的Δ6Δ5 fads2基因ORF全长序列,使用Blast与DNAStar软件包中的Protean程序对其编码蛋白的氨基酸序列进行分析,选取了合适氨基酸序列(360~444 aa)作为克隆表达对象,该基因片段分布在Δ6Δ5 fads2基因的1 078~1 332 bp.针对该基因设计一对特异性引物,上游引物(下划线为BamH I酶切位点):5’-AGAGGATCCCAAGCCACCTGTAATGT-3’与下游引物(下划线为 EcoR I酶切位点):5’-CGCGAATTCTCATTTATGGAGATATGCA-3’.PCR反应条件:95℃预变性3 min,95℃变性10 s,60℃退火30 s,72℃延伸30 s,共35个循环;最后72℃终延伸5 min.PCR产物回收纯化后经BamH I与EcoR I双酶切反应后,用1.0%琼脂糖凝胶电泳检测并回收,然后插入同样经BamH I与EcoR I双酶切后的pGEX-6p-1载体中,构建pGEX-6p-1-Δ6Δ5 Fads2重组质粒,并进行菌液PCR与序列分析进一步鉴定.
1.2.2 Δ6Δ5 Fads2蛋白的诱导表达与纯化
将pGEX-6p-1-Δ6Δ5 Fads2重组质粒与pGEX-6p-1(对照组)转化至大肠杆菌BL21(DE3).挑取单菌落分别接种至10 mL LB培养基中(含100 μg/mL AMP),37℃摇床培养6 h后,按照1∶100接种至100 mL的LB培养基中(含100 μg/mL AMP).培养至细菌生长对数中期(OD600=0.6)时加入终浓度0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),37℃摇床诱导表达3 h.诱导前后分别取少量菌液进行SDS-PAGE鉴定分析.如鉴定有目的重组蛋白的表达,则在诱导后,回收菌体,超声破碎裂解细胞,再根据GST标签蛋白纯化试剂盒说明书纯化大量诱导表达的重组蛋白.将所纯化获得的重组蛋白经SDS-PAGE电泳鉴定后,利用BCA蛋白定量试剂盒检测蛋白浓度,并分装于-80℃冰箱保存备用.
1.2.3 重组蛋白的小鼠免疫注射及血清采集
将用弗氏佐剂乳化好的重组蛋白抗原对小鼠进行腹腔注射,按照每只小鼠注射100 μg抗原.在第1、2、4周后用减半的抗原剂量进行腹腔注射加强免疫.第5周进行眼球取血,然后将血样放置于4℃冰箱过夜以析出血清,在3 000 r/min下离心10 min分离血清,小份分装置-20℃冰箱内保存备用.
1.2.4 黄斑蓝子鱼肝脏组织蛋白的提取
将蓝子鱼肝组织与动物组织蛋白裂解液按照1∶5的体积比混合后,使用组织均浆机进行低温均浆,然后置于冰上30 min,期间每隔10 min高速低温旋涡30~60 s,最后在12 000 r/min下离心10 min,取上清,分装后置于-80℃冰箱内保存备用.
1.2.5 Western blot鉴定多克隆抗体的特异性
将黄斑蓝子鱼肝脏组织蛋白进行SDS-PAGE分离,并转印到PVDF膜上,5%脱脂奶粉常温封闭2 h,然后使用鼠抗Δ6Δ5 Fads2的多克隆抗体作为一抗,4℃孵育过夜.PBST摇床洗涤3遍后,加入1∶3 000稀释后的二抗羊抗鼠IgG-HRP,室温摇床孵育1 h,然后PBST摇床洗涤3遍.最后利用化学发光试剂盒显色,并用Amersham Imager 600(GE Healthcare,USA)系统分析得到显色图像.
1.2.6 ELISA检测多克隆抗体的效价
使用碳酸盐包被液(pH 9.6,0.05 mol/L)将纯化后的目的蛋白溶液稀释至10 μg/mL,加入酶标板4℃过夜包被;次日PBST洗涤3次;封闭液封闭(37℃,1 h)后加入等体积梯度稀释(1∶5×102、1∶1×103、1∶2×103、1∶4×103、1∶8×103、1∶1.6×104、1∶3.2×104、1∶6.4×104)血清、阴性对照(未免疫小鼠)血清及空白对照鼠血清稀释液,每个梯度3个重复.37℃孵育2 h,PBST洗涤3次;加入稀释后的HPR标记的羊抗鼠IgG(1∶1 000),37℃孵育45 min,PBST洗涤3次;TMB溶液37℃避光显色30 min后,加入50 μL终止液终止反应后利用全波长酶标仪测定A450值.以实验组/阴性对照的光吸收比值≥2作为抗体效价判定标准.血清效价检测达标后,分装放于-80℃保存备用.
2 结果
2.1 pGEX-6p-1-Δ6Δ5 Fads2重组质粒的构建
通过Blast分析Δ6Δ5 Fads2氨基酸序列(444aa),将与其他Δ6Δ5 Fads2蛋白同源性较低的85个氨基酸序列作为候补序列,该段序列具有较高的特异性.再通过Protean程序分析该段序列,该多肽片段免疫原性较高(图1),易于制备特异性抗体.以黄斑蓝子鱼肝组织cDNA为模板,通过PCR扩增得到255 bp大小的片段,扩增结果经1%琼脂糖电泳分离,与预测的255 bp大小一致(图2A).将此片段克隆到pGEX-6p-1载体中,提取重组质粒为模板,并经PCR验证结果为阳性(图2B).选取该克隆子送上海生工有限公司测序,结果表明该克隆子质粒中的目的片段与Δ6Δ5 fads2基因所编码的85个氨基酸对应的DNA序列一致,且开放阅读框正确,未出现碱基突变和移码等问题,pGEX-6p-1-Δ6Δ5 Fads2重组质粒构建成功.
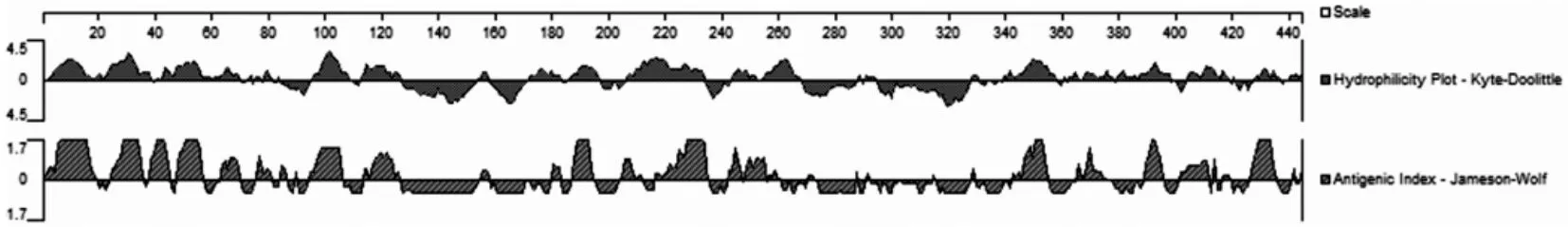
图1 Δ6Δ5 Fads2蛋白免疫原性与亲水性分析
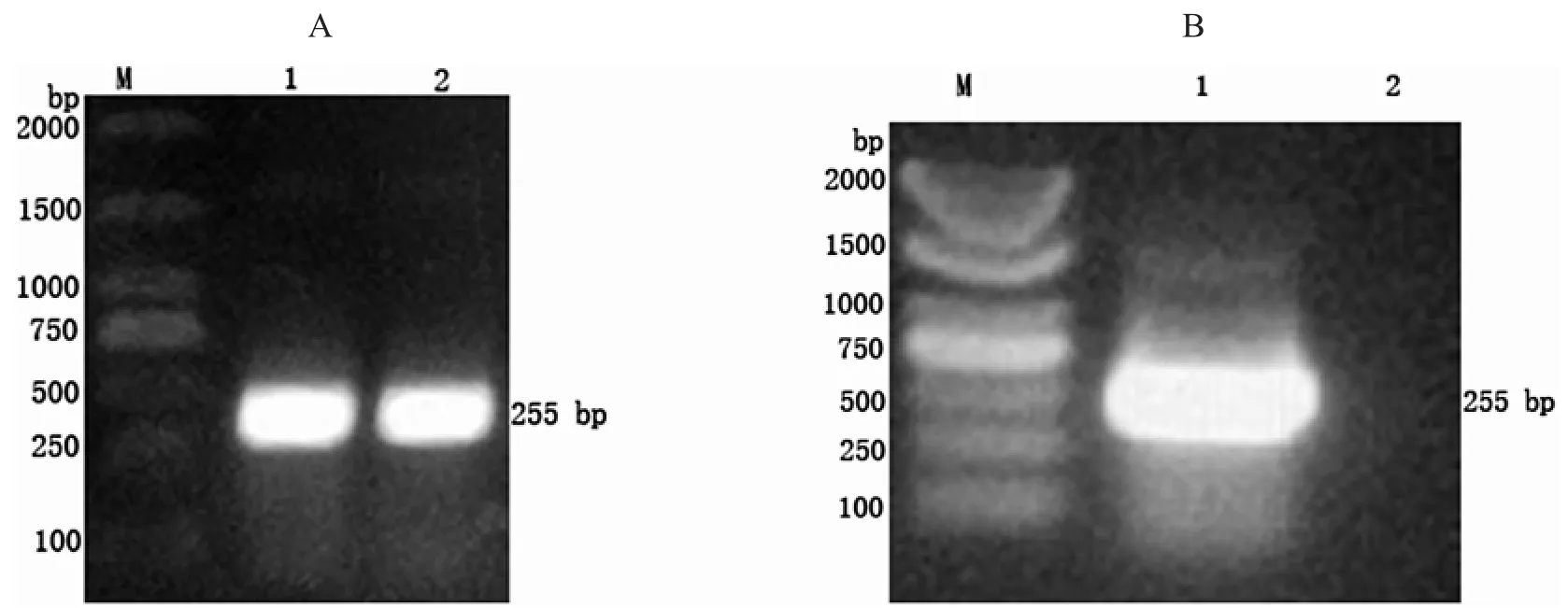
图2 Δ6Δ5 fads2 PCR产物电泳分析(A)和以重组质粒为模板PCR鉴定(B)
2.2 重组蛋白的表达与纯化
将pGEX-6p-1-Δ6Δ5 Fads2重组质粒转化至表达宿主大肠杆菌BL21(DE3)中,加入IPTG 37℃诱导表达重组蛋白.SDS-PAGE分析显示,加入IPTG诱导后的菌液在35 ku的位置有明显的重组蛋白表达带(图3,泳道2),而未经IPTG诱导的菌液对应位置的样品无明显条带(图3,泳道1).诱导后的菌体经超声破碎后离心,参照GST标签蛋白纯化试剂盒说明书纯化目的蛋白,并使用BCA蛋白浓度测定试剂盒测定重组蛋白浓度为1.45 mg/ml,获得了纯度较高的pGEX-6p-1-Δ6Δ5 Fads2融合蛋白(图4,泳道2、3).
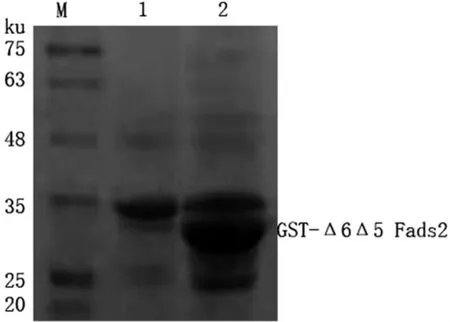
图3 重组蛋白诱导表达的结果
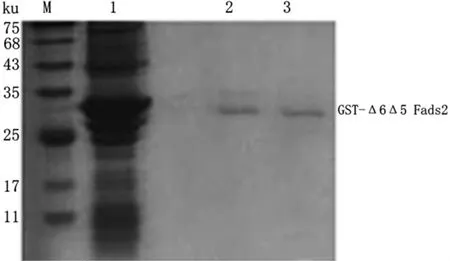
图4 重组蛋白的纯化
2.6 多克隆抗体的特异性分析
利用制备的多克隆抗体血清,采样Western blot方法检测黄斑蓝子鱼肝组织中的Δ6Δ5 Fads2蛋白,结果如图6所示,仅在相应位置出现明显条带,说明制备的Δ6Δ5 Fads2抗体特异性强,可以专一性的检测蓝子鱼组织细胞样品中的Δ6Δ5 Fads2蛋白水平.
2.7 抗体血清效价的测定
采用ELISA法检测收集的血清中多克隆抗体的效价.从表1结果可以得出,小鼠的抗血清稀释至1.6×104时,阳性血清效价与阴性血清效价检测值相比仍大于2,且小鼠的抗血清稀释至3.2×104时,该比值接近2.因此,判定Δ6Δ5 Fads2多克隆抗体效价约为3.2×104.
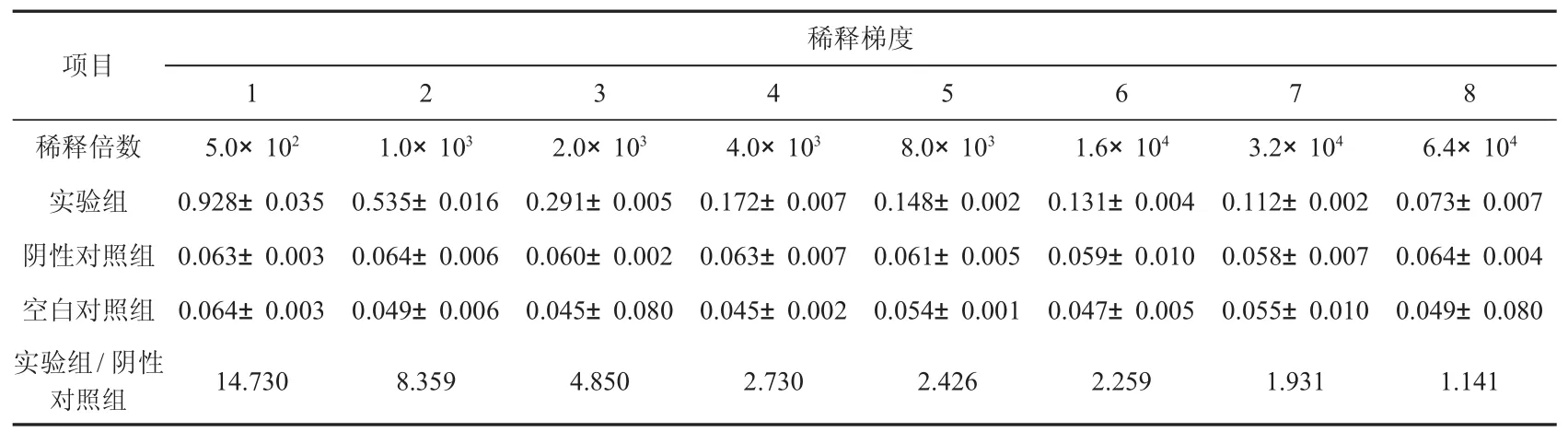
表1 ELISA方法测定多克隆抗体Δ6Δ5 Fads2效价
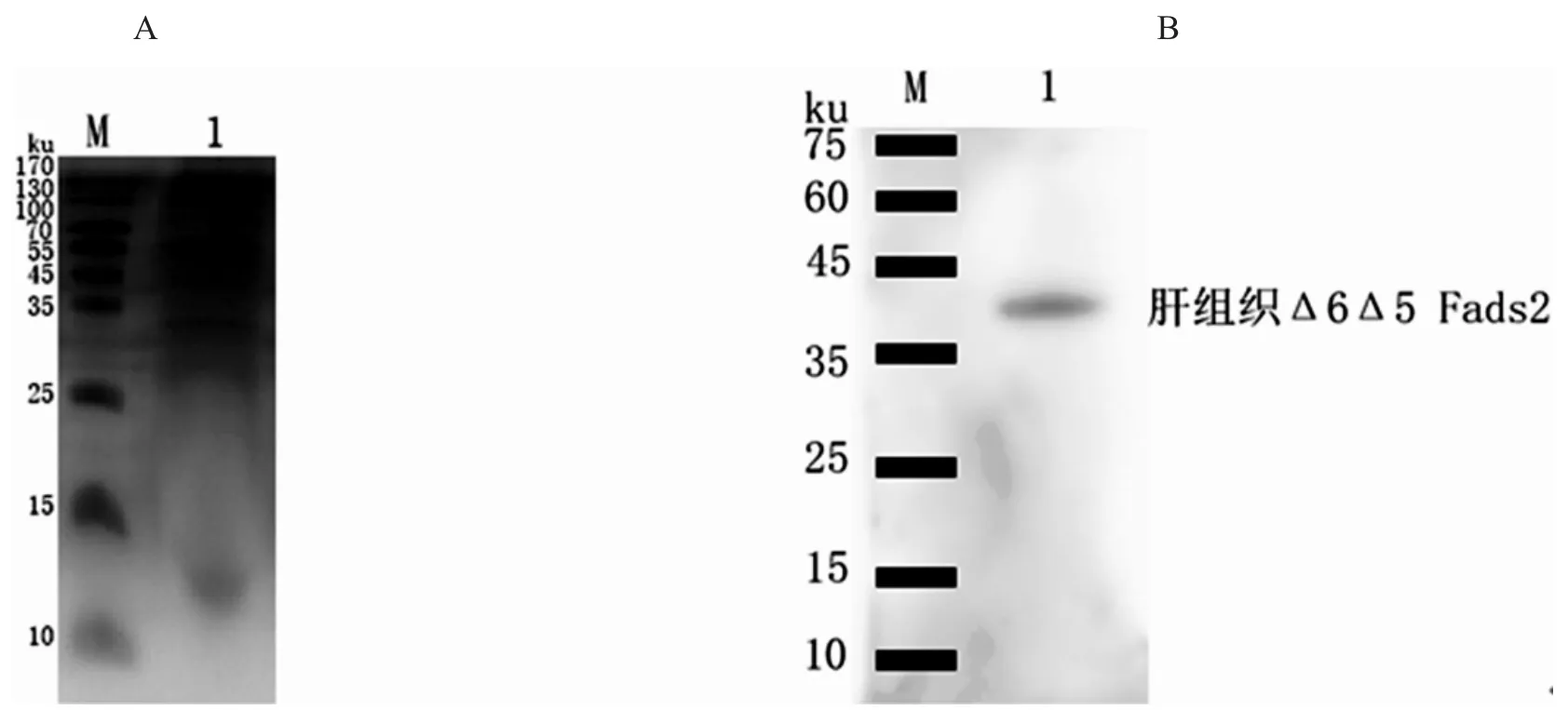
图5 黄斑蓝子鱼肝组织蛋白(A)和Δ6Δ5 Fads2抗体反应性检测(B)
3 讨论
本课题组首次在海水鱼类黄斑蓝子鱼中发现并克隆到Δ6Δ5 fads2基因,该基因具有Δ6 Fad和Δ5 Fad双功能性,是LC-PUFA生物合成所必须的关键基因.Δ6Δ5 Fads2蛋白是黄斑蓝子鱼LC-PUFA生物合成的关键酶,Δ6 Fad的功能是将ALA和LA转化为18∶4n-3和18∶3n-6,还可将24∶5n-3转化成24∶6n-3,进一步氧化生成DHA.而Δ5 Fad的功能是将20∶3n-6与20∶4n-3分别转化成ARA与EPA[15].对Δ6Δ5 Fads2的研究将有助于阐明黄斑蓝子鱼内源性合成LC-PUFA的途径与分子调控机制.因此,为了深入探究Δ6Δ5 Fads2蛋白的生物学功能,本实验尝试制备蓝子鱼Δ6Δ5 Fads2的多克隆抗体.
本研究使用Blast对Δ6Δ5 fads2的氨基酸序列进行分析,选择与其他Δ6Δ5Fads2肽段同源性最低的一段序列(360~444 aa).再利用Protean程序对该段多肽分析的结果显示其免疫原性较高,易于制备特异性抗体.而为解决其亲水性较低的问题,本实验选择了非跨膜区氨基酸序列,并利用GST标签融合表达增加目的蛋白的溶解度,同时便于后续的纯化[13].因此,选用的pGEX-6p-1质粒含有编码GST的序列,且包含的Tac启动子转录水平较高,能大量表达目的基因,提高抗原表达量[14].GST标签蛋白能与偶联在琼脂糖介质上的谷胱甘肽配体互补性结合,然后在非变性条件下加入还原型谷胱甘肽洗脱GST-Δ6Δ5 Fads2蛋白,最终得到了高纯度的重组蛋白.
将纯化的蛋白作为抗原免疫小鼠,提取多抗血清,进行Western blot检测.检测结果显示多克隆抗体对蓝子鱼肝组织Δ6Δ5 Fads2蛋白具有很强的专一性,在Western blot实验中清晰特异地识别Δ6Δ5 Fads2蛋白,但特异性条带比预期的Δ6Δ5 Fads2蛋白大小(52 ku)略小.推测可能是与本实验使用的预染蛋白分子量标准有关.预染的蛋白Marker与染料共价偶联,在不同的缓冲条件下电泳时迁移特性可能会发生某些变化,可能导致一些偏差,所以不太适合精确定位蛋白.此外,肝细胞中对Δ6Δ5 Fads2翻译后的磷酸化修饰也可能会使蛋白质的负电荷增加,导致Δ6Δ5 Fads2在电泳中迁移速率过快,产生与预期分子量大小上的偏差.因此,关于Δ6Δ5 Fads2多克隆抗体更详细的信息还需要在后续的研究中使用质谱等方法进一步确认.此外,本实验中的ELISA效价较高,接近3.2×104.本研究获得的多克隆抗体可以用于Western blot中Δ6Δ5 Fads2蛋白的检测,为深入探讨蓝子鱼Δ6Δ5 Fads2的生物学功能及其表达调控机制提供基础条件.
