应用时间分辨荧光免疫层析技术建立血管紧张素Ⅱ(Angiotensin Ⅱ)定量检测的方法
2022-08-30郭金双赵玉川郭宣成郑秀娥杨阳崔涛夏文龙
郭金双 赵玉川 郭宣成 郑秀娥 杨阳 崔涛 夏文龙
1 山东省食品药品审评查验中心 (山东 济南 250014)
2 中国科学院福建物质结构研究所结构化学国家重点实验室 (福建 福州 350002)
3 山东省环科院环境检测有限公司 (山东 济南 250013)
4 山东博科诊断科技有限公司 (山东 济南 250102)
内容提要:目的:建立一种血管紧张素Ⅱ(Angiotensin Ⅱ,ATⅡ)的定量检测方法,并检验该方法的性能。方法:通过以时间分辨荧光纳米微球作为荧光标记物,结合双抗体夹心法原理和免疫层析技术,实现ATⅡ的定量检测。结果:工艺条件优化结果显示,T线包被浓度为1.0mg/mL、结合物稀释比例为6倍、检测时间为5min时,曲线梯度和线性最好。检测方法在5~700ng/L范围内线性关系良好,方程为y=10.226x–9.1429,R2=0.9989,批内精密度CV≤2.90%,批间精密度CV≤4.90%,最低检测限为1.36ng/L,准确度检测相对偏差在±1.40%范围内,检测方法具有良好的分析特异性,交叉反应因子不会影响检测结果。测定血清样本中的ATⅡ浓度,与已上市化学发光法检测试剂盒检测结果相关性较好,二者的阳性符合率与阴性符合率分别为96.67%和98.18%,假阳性率和假阴性率分别为2.22%和2.73%,诊断符合率为97.50%。结论:研究建立的ATⅡ定量检测方法具有操作简单、检测快速、结果准确的优点。
高血压是最常见的慢性疾病之一,其中未能明确原因的原发性高血压可能由遗传、生理、生活习惯等多种原因导致。肾素-血管紧张素-醛固酮系统(Renin-Angiotensin-Aldosterone System,RAAS)是调节水盐代谢及血管收缩舒张的重要内分泌系统,在高血压发病过程中起着重要作用[1,2]。血管紧张素Ⅱ(Angiotensin Ⅱ,ATⅡ)是人体血压偏低时,RAAS被激活,由血管紧张素Ⅰ(AngiotensinⅠ,ATⅠ)在酶的催化下水解产生的,其受体广泛分布于心、脑、血管、肾上腺和肺中,是发挥升压作用的主要激素之一[3]。ATⅡ的作用是增强交感系统、全身微动脉、静脉收缩、促进醛固酮和加压素的分泌、增加回心血量、增强尿钠排泄[4]。ATⅡ广泛参与心血管系统的各个过程,可以通过干扰ATⅡ活性来降低高血压的发生率和致死率[5]。
检测血清中ATⅡ已成为原发性和继发性高血压分型诊断、治疗及研究的重要指标,对心血管、肾病、内分泌疾病的诊断和治疗有重要意义[6]。目前ATⅡ的检测方法主要有免疫层析法、化学发光法、放射免疫分析法和酶联免疫吸附法等。酶联免疫法与化学发光法操作复杂,反应时间较长,放射免疫分析法污染性较高,相比之下,基于免疫层析法的检测方法具有操作简单、成本低、快速便捷等优点[7,8]。时间分辨荧光(Time-Resolved Fluorescence,TRF)技术利用铕等镧系元素的独特性质,其特异性荧光比背景荧光衰变期长140s以上,通过时间的延缓可以过滤掉背景产生的短荧光[9,10]。在时间分辨荧光免疫分析仪中检测荧光强度与血清中抗原或抗体的浓度成正比,该方法能够明显提高检测信噪比,与其他传统的荧光检测技术相比,具有灵敏度高、准确度高、信号稳定、动态范围宽的优点[11,12]。本研究拟将时间分辨荧光纳米微球作为荧光标记物,在其表面修饰ATⅡ抗体,建立一种简便、快捷、准确、高灵敏度的ATⅡ的检测试剂卡,为ATⅡ精准定量检测和高血压疾病诊断提供了坚实的基础。
1.资料与方法
1.1 一般资料
研究材料:ATⅡ重组抗原、ATⅡ兔源抗体(ab286174)、ATⅡ兔源抗体EPR3873(购自英国Abcam公司);鼠抗兔IgG抗体(购自上海通蔚生物有限公司);时间分辨荧光纳米微球(苏州为度生物技术有限公司);硝酸纤维素膜(德国Sartorius公司);PVC板、玻璃纤维、吸水纸(上海金标生物科技有限公司);N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)(上海晶纯生化科技股份有限公司);1-乙基-(3-二甲基氨丙基)碳二亚胺(EDC)(德国sigma公司);其余化学试剂(分析纯,国药集团化学试剂有限公司)。临床样本来自山东省立医院的门诊及住院患者,临床诊断为高血压。
仪器设备:划膜喷金仪、可编程切条机、压壳机;CTS300型数控裁条机(上海金标生物科技有限公司);电热鼓风干燥箱;BKP1000干式荧光免疫分析仪(山东博科快速检测技术有限公司)。
1.2 方法
1.2.1 ATⅡ标准品制备
标准品缓冲液配制:纯水1000mL、Tris 4.80g、NaCl 10.20g、NaN30.90g、BSA 30.25g、Proclin300 600µL,室温搅拌至完全溶解,调节溶液pH至6.2。
ATⅡ标准品制备:使用标准品缓冲液将ATⅡ重组抗原稀释为0g/L、5ng/L、10ng/L、30ng/L、60ng/L、150ng/L、300ng/L、700ng/L系列浓度的标准品。
1.2.2 检测卡制备
荧光微球与ATⅡ抗体偶联结合垫的制备:取900µL标记缓冲液(50mmol MES,pH=6.0),加入100µL时间分辨荧光微球,10µL的NHS(20mg/mL),快速混匀。加入5µL EDC(20mg/mL)快速混匀,室温孵育20min。离心去掉上清,沉淀用100µL标记缓冲液重悬。加入0.1mg ATⅡ抗体,室温孵育2h。加入BSA室温封闭1h。离心去上清,沉淀用1mL结合物稀释液(50mmol/L Tris,10%蔗糖,2.5%海藻糖,0.5%酪蛋白,0.5%PVP10,pH 8.0)重悬,获得荧光微球ATⅡ抗体偶联物备用,将该偶联物用划膜喷金仪均匀的喷到玻璃纤维上,37˚C电热鼓风干燥箱干燥3h,制成荧光微球与抗体偶联物结合垫。
硝酸纤维素膜(NC膜)包被:将NC膜贴在PVC板上,用划膜喷金仪将兔源ATⅡ-EPR3873抗体(T线)和鼠抗兔IgG抗体(C线)包被到NC膜上,37˚C电热鼓风干燥箱干燥3h。
ATⅡ检测卡制备:用数控裁条机将吸水纸及玻璃纤维裁切成30.0cm×2.5cm规格。将吸水纸、荧光微球与抗体偶联物结合垫、玻璃纤维样品垫依次粘贴到包被NC膜的PVC底板上。使用可编程切条机切条,设定切条宽度4mm,将切好的试纸条装到塑料卡壳中,得到ATⅡ检测卡。
1.2.3 标准曲线的拟合
使用本检测卡检测0g/L、5ng/L、10ng/L、30ng/L、60ng/L、150ng/L、300ng/L、700ng/L 8个浓度标准品。使用Logistic P4参数方程将信号比值和浓度值拟合成标准曲线,并将曲线信息录入ID卡中。
1.2.4 检测卡条件优化
T线包被浓度优化:选取T线ATⅡ-EPR3873抗体包被浓度为0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL进行筛选验证,以此确定合适的T线包被浓度。
结合物稀释比例优化:对荧光微球ATⅡ抗体结合物分别进行3、6、9倍稀释,以此确定合适的稀释比例。
检测时间的选取:选取ATⅡ浓度为10ng/L、60ng/L、300ng/L的标准品,分别在加入样本后的2min、5min、8min、10min、12min、15min对检测卡进行检测,以此确定合适的检测时间。
1.2.5 检测卡性能评估
检测卡性能评估指标主要包括线性、精密度、准确度、最低检出限、分析特异性等分析性能指标,并通过临床比对研究验证检测卡的临床性能。各评估项目的评估方法如下。
线性:用浓度为0g/L、5ng/L、10ng/L、30ng/L、60ng/L、150ng/L、300ng/L、700ng/L的ATⅡ标准品检测线性关系,每浓度重复检测3次,计算相关系数。
精密度:①批内精密度:同一批次检测卡分别对10ng/L、60ng/L、300ng/L三个浓度的标准品各做10次重复实验,计算其变异系数CV(%)。②批间精密度:选用3个批次检测卡分别对10ng/L、60ng/L、300ng/L三个浓度的标准液各做10次重复实验,计算其变异系数CV(%)。
准确度:用检测卡分别对10ng/L、60ng/L、300ng/L三个浓度的标准液进行3次重复检测,计算测定均值和相对偏差。
最低检出限:用检测卡对0g/L标准品进行20个重复检测,计算检测结果均值x和标准差SD,x+2SD即为本检测卡最低检出限。
分析特异性:向不含ATⅡ的血清中添加血管紧张素Ⅰ,使其浓度为2000ng/L,用检测卡检测ATⅡ的浓度值。
临床比对实验:选取卧位和立位各100例临床血清样本,血清样本由新产业生物医学工程股份有限公司的血管紧张素Ⅱ(AngiotensinⅡ)测定试剂盒(化学发光法)和本检测卡平行测定。参考区间:卧位为25~60ng/L,立位为50~120ng/L。对两种方法检测结果进行统计分析,计算出本方案的阳性符合率、阴性符合率、假阳性率、假阴性率和诊断符合率。
2.结果
2.1 工艺条件的优化
2.1.1 最适T线包被浓度
T线包被浓度分别为0.5mg/mL、1.0mg/mL、1.5mg/mL和2.0mg/mL。由图1可知,包被浓度为0.5mg/mL时,当ATⅡ标准品浓度达300ng/L以上,T/C值会出现下降趋势;包被浓度为1.0mg/mL、1.5mg/mL和2.0mg/mL时,梯度和线性均良好,最终选择1.0mg/mL。
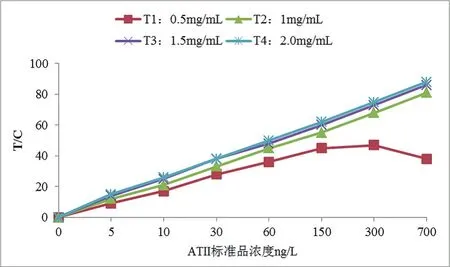
图1. ATⅡ包被抗体浓度与T/C值
2.1.2 最适结合物稀释比例
最适结合物稀释比例筛选结果见图2,当结合物稀释比例为9倍,ATⅡ标准品浓度达150ng/L以上时,T/C值逐渐趋于平衡;当结合物稀释比例为3倍和6倍时,曲线线性良好,最终选择6倍稀释比例。

图2. ATⅡ结合物稀释倍数与T/C值
2.1.3 最佳检测时间
检测结果如图3所示,在检测时间达到5min时,10ng/L、60ng/L、300ng/L的标准品T/C值均趋于稳定状态,故最佳检测时间选为5min。

图3. 检测时间与T/C值
2.2 性能评估
2.2.1 线性
结果如图4所示,该方法在5~700ng/L范围内线性关系良好,方程为y=10.226x–9.1429,R2=0.9989。

图4. ATⅡ检测卡线性
2.2.2 精密度
批内精密性分析结果如表1所示,三个浓度其变异系数CV(%)分别为2.43%、1.80%、2.90%;批间精密性分析结果如表2所示,三个浓度其变异系数CV(%)分别为4.37%、4.30%、4.90%。
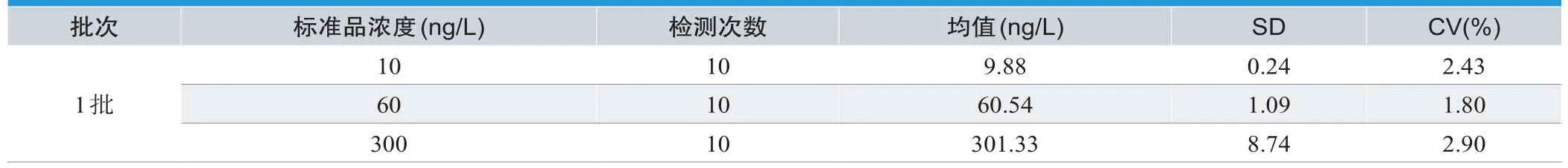
表1. ATⅡ检测卡批内精密度分析
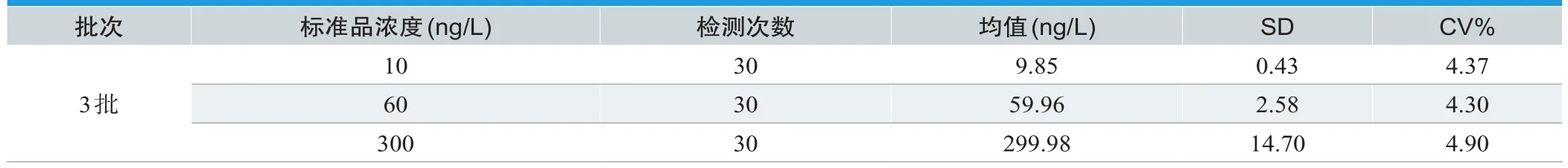
表2. ATⅡ检测卡批间精密度分析
2.2.3 准确度
准确度分析结果如表3所示,计算测定均值和相对偏差,三个浓度其相对偏差分别为-1.40%、1.30%、0.60%。

表3. ATⅡ试纸条准确度分析
2.2.4 最低检出限
用检测卡对0g/L标准品进行20个重复检测,其结果如表4所示,所得最低检出限为1.36ng/L。

表4. ATⅡ检测卡最低检出限分析
2.2.5 分析特异性
用检测卡检测浓度为2000ng/L的ATⅠ,结果分别为10.23ng/L、12.97ng/L、9.84ng/L,均<20ng/L。
2.2.6 比对实验
将自制检测卡与商品化检测方法分别检测临床血清样本进行对比,结果如表5所示,统计分析结果如下:阳性符合率96.67%,阴性符合率98.18%,假阳性率2.22%,假阴性率2.73%,诊断符合率97.50%。本方案自制检测卡和新产业生物医学工程股份有限公司的血管紧张素Ⅱ(AngiotensinⅡ)测定试剂盒(化学发光法)检测效果相近。
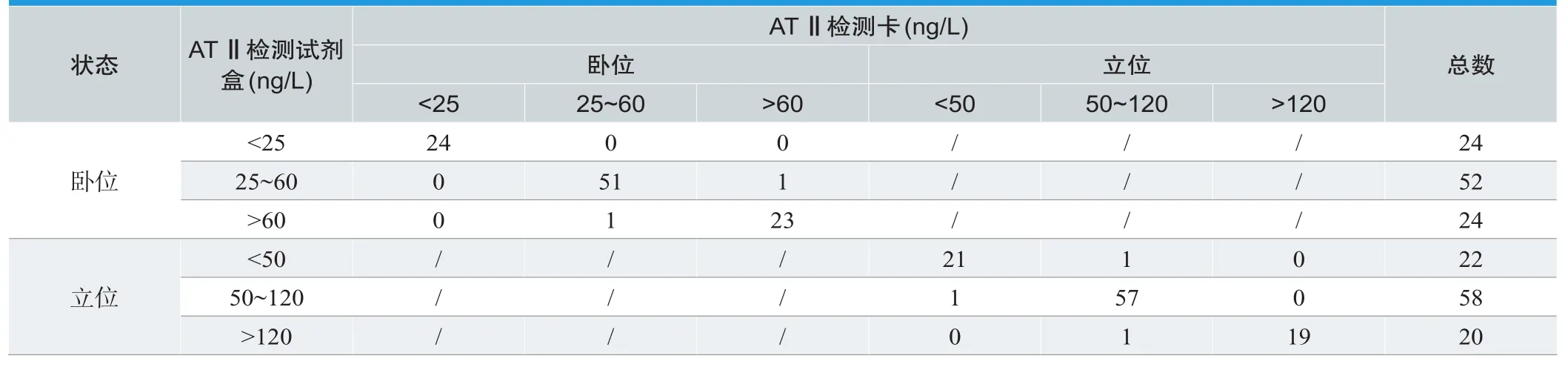
表5. 两种检测方法结果分析
3.讨论
研究建立了一种AT的定量检测方法,并检验该方法的性能。主要通过以时间分辨荧光纳米微球作为荧光标记物,结合双抗体夹心法原理和免疫层析技术,实现ATⅡ的定量检测。工艺条件优化结果显示,T线包被浓度为1.0mg/mL、结合物稀释比例为6倍、检测时间为5min时,获得最优曲线梯度和线性。检测方法在5~700ng/L范围内线性关系良好(R2=0.9989)。批内精密度CV≤2.90%,批间精密度CV≤4.90%,准确度检测相对偏差均在±1.40%以内,最低检测限达到1.36ng/L,显示检测方法具有优良的精密度、准确度和灵敏度。检测方法具有良好的分析特异性,交叉反应因子不会影响实验结果。检测方法检测血清样本与已上市化学发光法检测试剂盒比较,检测结果相关性较好,二者的阳性符合率与阴性符合率分别为96.67%和98.18%,假阳性率和假阴性率分别为2.22%和2.73%,诊断符合率为97.50%。
综上,研究建立的基于应用时间分辨荧光免疫层析技术定量检测ATⅡ的方法检测速度快、操作简便、分析性能和临床性能良好。
