细胞因子与氨基酸代谢关系的研究进展①
2022-08-30胡秀红任文波吉林大学第一医院检验科长春130021
胡秀红 任文波 黄 晶 (吉林大学第一医院检验科,长春 130021)
近年随着免疫细胞代谢研究的推进,人们对免疫与代谢关系的认知也越来越深入。免疫细胞的氨基酸代谢受多种因素(如细胞因子、抗原、能量供应等)调控,而部分氨基酸代谢也被发现是调节机体免疫功能的关键途径。细胞因子在感染、炎症等生理病理过程中的作用十分重要,但其与细胞氨基酸代谢的联系尚不明确,本文将围绕细胞因子与氨基酸代谢关系的研究进展进行综述。
1 炎症过程中细胞因子与氨基酸代谢联系紧密
蛋白质是构成细胞生命的三大基本营养物质之一,行使多种生物学功能。为满足生存需求,在细胞、组织及生物体存续期间,蛋白质感知并响应外界刺激,而其合成原料氨基酸的物质代谢也随之受到调控。细胞因子是由淋巴细胞、单核/巨噬细胞、白细胞和树突状细胞等免疫细胞及内皮细胞等组织细胞分泌的小分子多肽,在机体免疫系统中扮演重要角色[1]。依据参与炎症反应的细胞因子功能不同,大致可分为促炎细胞因子(如IL-1、IL-6、IFN-γ、TNF-α 等)和抗炎细胞因子(如IL-4、IL-10、TGF-β等)两类。炎症时机体新陈代谢加快,需消耗大量能量及游离氨基酸以合成相关蛋白质,如急性时相反应蛋白、细胞因子等。炎症细胞因子释放是肠道慢性非特异性炎症疾病发病机制中的关键事件,临床研究发现与健康对照人群相比,溃疡性结肠炎患者血清氨基酸谱存在明显差异,血清谷氨酸、谷氨酰胺、蛋氨酸、色氨酸和组氨酸含量降低,而天冬酰胺和异亮氨酸水平升高[2]。右旋糖酐硫酸钠(DSS)诱导的小鼠肠炎模型中发现,氨基酸水平亦发生改变,与对照小鼠相比,DSS 治疗组小鼠血清中精氨酸、赖氨酸、鸟氨酸、脯氨酸及瓜氨酸浓度升高[3];XIE 等[4]发现炎症细胞因子(IL-1β、IFN-γ 和TNF-α,尤其是TNF-α)治疗会引起胰岛β 细胞功能障碍,进一步代谢组学分析发现,TNF-α 治疗组胰岛β 细胞内异柠檬酸及胞嘧啶水平降低,而同型半胱氨酸、天冬氨酸、N-乙酰神经氨酸、硫酸胍丁胺及三羧酸循环(又称Krebs 循环,机体物质代谢与能量代谢的关键路径)中重要代谢产物苹果酸含量增加。此外,研究还发现TNF-α治疗的小鼠胰岛β 细胞亮氨酸水平降低,并能显著抑制葡萄糖诱导的胰岛素分泌。因此,推测氨基酸代谢和Krebs 循环代谢改变可能是TNF-α诱导的小鼠胰岛β细胞功能紊乱的重要机制。提示炎症中细胞因子与机体氨基酸代谢密切相关。
2 细胞因子调节细胞氨基酸代谢
细胞因子是固有免疫与适应性免疫的重要效应分子,不仅在炎症疾病发生发展中具有重要作用,且大量研究表明炎症细胞因子还能通过不同途径调节细胞内游离氨基酸水平,促使细胞表现特定表型和功能[5-7]。
2.1 细胞因子调节细胞对氨基酸的转运 根据机体能否自身合成,氨基酸可分为两类:能在细胞内通过物质间转化而来的非必需氨基酸和依赖于外源摄入补充的必需氨基酸。人体摄入的蛋白质经胃肠消化后可形成多肽和游离氨基酸,氨基酸吸收需经位于小肠上皮细胞顶膜或基底膜外侧的转运蛋白介导的跨膜转运完成,随后氨基酸经血液运输被组织中各细胞的转运蛋白摄取,参与细胞内物质及能量代谢[8]。多项研究报道细胞因子通过影响氨基酸转运调控细胞表型和功能。LOAYZA-PUCH等[9]研究癌症患者氨基酸需求变化时发现,TGF-β1通过下调乳腺上皮细胞亮氨酸转运蛋白亚单位SLC3A2 表达,减少细胞对亮氨酸的摄取并抑制细胞增殖,而这种限制亮氨酸的特性可能与癌症侵袭相关。CENDAN 等[10]发现 IL-1 和 TNF 可以时间和剂量依赖性方式增加肺动脉内皮细胞中精氨酸跨膜转运,以支持败血症期间精氨酸依赖性生物合成。此外,还有研究报道IL-7 刺激可增加CD8+T 细胞多种氨基酸转运蛋白Slc1a4、Slc1a5 和Slc7a5 转录,促进细胞增殖[11]。以上研究证实细胞因子可通过调节氨基酸转运蛋白调控细胞内氨基酸浓度,发挥生理病理作用。
2.2 细胞因子调节细胞对氨基酸的感知 细胞内氨基酸浓度是动态变化的,机体通过饮食摄入氨基酸,满足细胞高蛋白质需求,而细胞内无用或受损的蛋白质及细胞器则通过自噬等方式在溶酶体中被降解并释放游离氨基酸至细胞质,实现游离氨基酸在细胞内的循环利用[12]。哺乳动物细胞主要通过雷帕霉素复合物1(mechanistic target of rapamycin complex 1,mTORC1)和一般性调控阻遏蛋白激酶2(general control nonderepressible 2,GCN2)信号传导途径感知并调控氨基酸,维持细胞内游离氨基酸适当浓度[12]。mTORC1 激活时可促进机体合成代谢(如消耗游离氨基酸合成蛋白质等大分子物质)并抑制自噬等分解过程[13];GCN2 能感知并调节氨基酸缺乏,促进细胞自噬[12]。炎症细胞因子不仅能调节氨基酸转运,还能影响氨基酸的感知途径。SU等[7]报道,人巨噬细胞中,IFN-γ 通过诱导色氨酸耗竭抑制mTORC1 活性,增强巨噬细胞活化。也有研究发现IFN-γ 引起的人肾上皮细胞中色氨酸耗竭能激活GCN2 信号通路,导致细胞自噬通量增加,抑制细胞自噬能降低可溶性坏死因子受体(sTNFR Ⅰ和Ⅱ)分泌,并导致促炎递质趋化因子IP-10、MIP-1d、单核细胞趋化蛋白MCP-2、细胞间黏附因子ICAM-1及TNF 分泌增加,而补充色氨酸或干扰GCN2 表达则能抑制 IFN-γ 诱导的自噬[14]。ALMUTAIRI 等[15]研究发现,IL-18 可独立于mTORC1 途径上调NK 细胞氨基酸转运蛋白CD98/LAT1 表达,增加的亮氨酸转运驱动细胞内代谢传感器mTORC1 活化,进一步诱导利于NK 细胞增殖的代谢变化。以上研究证实细胞因子不仅可调节氨基酸转运,还能影响氨基酸感知途径。
2.3 细胞因子可调节细胞中氨基酸代谢相关酶表达和活性 氨基酸及其代谢产物具有多种生物学功能,细胞因子不仅能调节氨基酸转运和感知,还能通过调节氨基酸代谢相关酶影响氨基酸分解代谢。精氨酸在精氨酸酶(arginase,Arg)催化作用下分解生成尿素、鸟氨酸,而在一氧化氮合酶(nitric oxide synthase,NOS)作用下产生NO,还可由其他酶催化产生肌酸、多胺等生物活性物质[16]。多项研究证明,精氨酸代谢路径在巨噬细胞分化中具有重要作用。LPS、IFN-γ 和 CSF2 可活化巨噬细胞为 M1型,巨噬细胞内精氨酸经NOS-2 途径合成NO 并分泌 IL-1β、TNF-α 和IL-12 等促炎细胞因子[17]。IL-4、IL-10、IL-13 可活化巨噬细胞为 M2 型,经精氨酸酶途径代谢精氨酸,产生IL-10 等抗炎细胞因子[18]。多项研究表明IL-13、IL-8、IL-4、IL-6、TNF-α 等能上调精氨酸酶活性,促进精氨酸代谢。鉴于精氨酸酶在疾病致病机制中的重要性,可将其作为心血管、肾脏、神经系统疾病和癌症治疗的潜在靶标[19]。FULTANG 等[5]发现巨噬细胞来源的 IL-1β 和 TNF-α能通过激活肿瘤细胞p38 及ERK MAPK 信号通路,上调神经母细胞瘤中Arg2 表达,促进肿瘤细胞增殖,发现了肿瘤细胞和浸润性髓样细胞的免疫代谢调节回路,指出髓样细胞和肿瘤细胞间交互作用产生的代谢调节回路能促进神经母细胞瘤进展。
吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxy‑genase,IDO)是色氨酸分解途径的限速酶,IDO 驱动的色氨酸耗竭能调节巨噬细胞和树突状细胞(den‑dritic cells,DCs)炎症细胞因子产生、诱导幼稚 T 细胞增殖停滞以及促进FoxP3+Treg 成熟和激活[20]。IDO 受多种细胞因子调节,研究发现 IFN-γ、TNF-α、IL-1、IL-2、TGF-β、IL-10等均可诱导IDO1高表达,而IL-4 和 IL-13 则能抑制 IDO1 表达。CHAUDHARY等[20]发现,抗体驱动的肾小球炎症初期,肾脏足细胞中IFN-γ 信号诱导的IDO1 酶活性增强和下游GCN2 激活,促进细胞自噬。IDO1-GCN2 信号通路激活能抑制炎症细胞因子CCL-2、TNF-α、IL-6产生,减少损伤处巨噬细胞浸润与活化,并通过诱导自噬限制炎症性肾脏病理变化。IDO 除具有酶催化作用外,还能发挥信号传导功能。MONDANELLI 等[21]发现TGF-β 能上调DCs 中酪氨酸蛋白磷酸酶,同时引起IDO1中免疫受体酪氨酸抑制基序(ITIM)磷酸化,激活DCs 免疫调节信号通路,产生内源性TGF-β 并进一步诱导IDO1表达,从而维持持久的细胞免疫抑制作用。YANAGAWA 等[22]报道,单独 IL-10 治疗不影响DCs中IDO表达,但能增强IFN-γ诱导的IDO表达。IL-10 与IFN-γ 具有协同作用,能通过升高DCs中iNOS与IDO 水平、减少细胞表面主要组织相容性复合体Ⅱ类分子及降低TNF-α、IL-12 p40表达,抑制DCs免疫刺激功能。
以上研究从不同方面证实了细胞因子与细胞氨基酸代谢路径代谢酶存在关联,细胞因子能通过调节免疫细胞中氨基酸代谢相关酶表达和活性发挥免疫调节功能。
3 氨基酸代谢调控炎症细胞因子生成
免疫代谢相关研究发现,抗原刺激免疫细胞从静止状态转为激活状态时,细胞内代谢转变,且不同细胞亚群代谢程序与免疫功能明显相关。此外,代谢途径变化亦可影响免疫细胞命运、调节免疫功能[23]。细胞因子通过不同路径调控细胞氨基酸水平,同时,氨基酸及其代谢物也能调控炎症细胞因子水平,在细胞局部环境中发挥免疫调节效应。
3.1 氨基酸直接调节细胞因子分泌 实验发现精氨酸治疗小鼠结肠炎时,能降低促炎细胞因子IL-1α、IL-1β、IL-6 水平,改善结肠通透性和中性粒细胞浸润,微阵列基因组分析表明精氨酸可恢复DSS 诱导的多基因表达失调。进一步研究发现,与对照组相比,精氨酸治疗的 DSS 诱导的 iNOS−/−结肠炎小鼠并未改善小鼠临床症状,提示补充L-精氨酸可能通过增强iNOS 活性等机制发挥治疗作用[3]。最近研究报道,限制多发性硬化小鼠色氨酸摄入可缓解小鼠自身免疫性神经炎症,其机制为通过改变小鼠肠道微生物代谢引发T细胞功能受损[24]。大鼠肌肉机械损伤时,补充富含亮氨酸等必需氨基酸能降低IL-6 表达,减轻炎症并促进肌肉修复[25]。亮氨酸还能通过下调 NF-κB 和激活mTOR/p70S6K 信号通路,降低鸡胚肠组织中LPS 引发的IL-6 转录并减轻炎症反应[26]。此外,饮食补充组氨酸能抑制患有代谢综合征的肥胖妇女体内炎症和氧化应激,降低血清炎症细胞因子TNF-α 和IL-6 水平,并改善胰岛素抵抗[27]。谷氨酰胺是人体含量最丰富的氨基酸,作为淋巴细胞能量来源,其耗竭能抑制T 细胞增殖和细胞因子分泌,体外补充谷氨酰胺能减少淋巴细胞和上皮细胞中促炎细胞因子IL-6 和IL-8 产生,并提高抗炎因子IL-10 水平[28-29]。以上研究从不同角度证实了氨基酸与细胞因子产生与其在疾病中的作用关系密切。
3.2 氨基酸代谢产物调节细胞因子分泌 研究发现多种氨基酸代谢产物也具有免疫调节活性,在炎症、自身免疫性疾病中的作用不容忽视,也能调节细胞因子分泌。自身免疫性脑脊髓炎小鼠模型发现,色氨酸分解代谢产物N-乙酰5-羟色胺(NAS)能直接结合并正变构调节IDO1,增加DCs 中犬尿氨酸介导的芳烃受体(AhR)激活,诱导小鼠颈淋巴结中CD4+T 细胞产生抗炎细胞因子IL-10 并减少骨髓CD4+T 细胞分泌IL-17 和IFN-γ,进而抑制小鼠神经炎症[30]。精氨酸分解产物肌酸可作为细胞能量储备来源,JI等[31]研究发现,巨噬细胞中肌酸摄取和积累能重编程巨噬细胞极化,其机制为通过抑制IFN-γ-JAK-STAT1转录因子信号,抑制精氨酸代谢酶NOS2活性,同时通过染色质重塑促进IL-4-STAT6 途径激活Arg1 表达。提示氨基酸代谢产物通过调节细胞表型发挥免疫调节作用,影响炎症细胞因子分泌。
4 细胞因子网络与氨基酸代谢的相互作用
机体免疫应答时,免疫细胞受不同细胞因子组成的细胞因子网络共同调节。细胞因子发挥免疫效应的机制研究发现,细胞因子网络与细胞氨基酸代谢相互作用,细胞因子可通过调节细胞氨基酸代谢调控其他细胞因子分泌,并发挥生物学效应(图1)。研究报道IFN-γ 和CSF2可促进巨噬细胞内精氨酸NOS 代谢途径,活化巨噬细胞为M1 型并分泌IL-1β、TNF-α 和 IL-12 等促炎细胞因子[17]。IL-4、IL-10、IL-13 则能促进巨噬细胞内精氨酸经精氨酸酶途径代谢,活化巨噬细胞为M2型并产生IL-10等抗炎细胞因子[18]。多发性骨髓瘤中,IL-32γ 通过诱导巨噬细胞产生IDO,抑制CD4+T 细胞增殖及促炎细胞因子分泌[32]。MONDANELLI等[21]研究发现,TGF-β以Arg1活性依赖的方式磷酸化DCs中的IDO1,并通过促进内源性 TGF-β 产生和 IDO1 表达维持 DCs 免疫抑制作用。此外,炎症细胞因子IL-1 和TNF-α 能诱导骨骼肌表达组氨酸脱羧酶,催化组氨酸生成组胺,提高骨骼肌IL-1α和IL-1β 水平[33]。证实细胞因子网络与氨基酸代谢存在相互作用,细胞因子通过调控氨基酸代谢介导免疫效应。
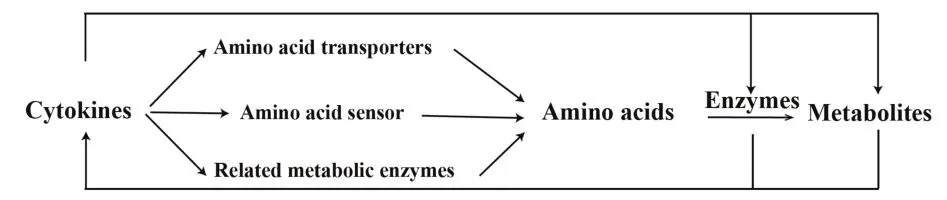
图1 细胞因子与氨基酸代谢调控关系示意图Fig.1 Schematic diagram of relationship between cyto⁃kines and amino acid metabolism
以上研究均表明细胞因子与氨基酸代谢关系密切,一方面细胞因子通过影响氨基酸转运、感知、代谢调控细胞氨基酸代谢,介导免疫学效应;另一方面局部氨基酸或其代谢产物又能通过调节免疫细胞活化及表型影响细胞因子表达。
5 细胞因子与氨基酸代谢在疾病中的联系
细胞因子与氨基酸均在慢性炎症性疾病、自身免疫病和肿瘤等多种疾病中扮演重要角色,将进一步探究两者在氨基酸代谢性疾病及肿瘤中的联系。
5.1 氨基酸代谢性疾病中细胞因子与氨基酸代谢的关系 苯丙酮尿症(Phenylketonuria,PKU)是主要因苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)缺乏引起的常染色体隐性遗传病,因苯丙氨酸及其代谢产物积累并产生神经毒性,患者呈智力低下及其他神经系统症状[34]。研究发现PKU 患者呈促炎和氧化应激状态,其炎症标志物IL-6、IL-1β、C 反应蛋白、血清淀粉样蛋白A 及血清氧化应激标志物丙二醛水平明显升高,提示氨基酸代谢与炎症及氧化应激状态存在关联[35-36]。
赖氨酸尿蛋白不耐受症(lysinuric protein intolerance,LPI)是由氨基酸转运蛋白SLC7A7基因突变引起的罕见常染色体隐性遗传病,因累及机体各系统而表现出广泛临床症状[37]。LPI 发病机制尚不清楚,目前认为单核/巨噬细胞是LPI 并发症的关键,研究发现SLC7A7 在生理条件下除转运精氨酸外,还可抑制NF-κB 信号传导抑制炎症,体外沉默SLC7A7 基因能诱导 IL-1β 和 TNF-α 表达,导致人巨噬细胞和气道上皮细胞获得炎症表型,该研究还提出氨基酸转运缺陷的单核细胞和上皮细胞通过自发分泌的促炎细胞因子过度刺激气道上皮细胞产生趋化因子,致使循环单核细胞持续进入气道,引起LPI肺部损伤及并发症[38]。
枫糖尿病(maple syrup urine disease,MSUD)是由编码支链α-酮酸脱氢酶复合物亚基基因突变引起支链氨基酸分解代谢障碍的常染色体隐性遗传病,多数患者伴有神经系统损伤[39]。研究发现仅限制蛋白饮食的MSUD患者血浆促炎细胞因子(IL-1β、IL-6、TNF-α 和 IFN-γ)和细胞黏附分子(sICAM-1 和sVCAM-1)水平升高,且患者代谢危象发生次数与IL-1β 及 sICAM-1 呈正相关,提示炎症在 MSUD 发病机制中可能起重要作用,MSUD 患者神经病理学可能与炎症和氧化应激有关[40]。
以上研究提示氨基酸代谢性疾病患者氨基酸代谢障碍与炎症和氧化应激同时存在,炎症细胞因子在疾病发生发展和对机体损伤中十分关键。
5.2 肿瘤中细胞因子与氨基酸代谢的关系 肿瘤细胞能重编程胞内物质代谢,目前已在多种肿瘤中发现氨基酸代谢异常[41]。慢性炎症与肿瘤的联系已阐明,既然炎症细胞因子与氨基酸在肿瘤发生发展中都很关键,那么两者是否存在关联?SIRNIO等[42]研究发现大肠癌患者血清氨基酸水平与全身性炎症和疾病分期有关:血清组氨酸和谷氨酰胺水平降低,且谷氨酰胺水平与C 反应蛋白、IL-6 及IL-8水平呈显著负相关,苯丙氨酸水平升高,且与IL-1、IL-6、IL-7、IL-8、IL-12 和 CXCL10 呈正相关,推测氨基酸谱变化可能由大肠癌患者全身性炎症引起的肌肉分解导致。也有研究报道乳腺癌患者血清及组织IFN-γ 水平升高且精氨酸水平降低,细胞研究发现长期IFN-γ 刺激能导致原代奶牛乳腺上皮细胞出现精氨酸耗竭及细胞恶性转化,而补充精氨酸能拮抗IFN-γ 诱导的细胞恶性转化[43]。表明在肿瘤发生发展中,炎症细胞因子与细胞氨基酸代谢亦存在相关性。
6 结语
细胞为了生存发展出一套复杂、精密而又经济、高效的物质能量平衡机制。随着免疫代谢研究进展,研究者目前倾向于认为细胞内不同物质系统及网络间的串扰可能是生命进化过程中的普遍现象。其中细胞因子与氨基酸代谢的串扰不仅能影响蛋白代谢,还能调节机体免疫功能:一方面细胞因子能通过调节氨基酸转运、感知和代谢,介导免疫效应;另一方面,氨基酸及其代谢产物变化也能调控细胞因子生成和分泌,进而调控细胞因子网络在细胞间的信号传递,产生生物学效应。近年研究发现,细胞因子与细胞氨基酸代谢在多种疾病中均存在关联,部分氨基酸代谢路径的酶、代谢物也被发现可作为疾病治疗的潜在靶点,但细胞因子与氨基酸代谢交互网络中仍有许多分子机制尚不清楚,进一步研究不仅能为免疫代谢理论发展奠定基础,且有助于寻找更有效的疾病治疗靶点。