基于模型分类突破平衡转化率问题
2022-08-30江苏季宗宝赵王侠
江苏 季宗宝 赵王侠
平衡转化率是需要学生在已有化学平衡知识的基础上来学习的,是《化学反应原理》教材中的一个重要知识点,是《普通高中化学课程标准(2017年版2020年修订)》中提出的一个化学学科核心素养“变化观念与平衡思想”的重要体现,也是高考中的一个重要考点,在每年的高考化学试题中都有所考查,分值在2~4分之间,试题主要以选择题或者工艺流程题呈现,考查的形式主要表现为平衡体系中条件的变化引起转化率大小的改变以及一定条件下建立平衡后平衡转化率的计算。其中,平衡转化率的变化是学生学习的一个难点,教师在教学中特别是一轮复习的时候,要站在一个更高的角度,对平衡转化率的变化进行归纳总结,本文采用模型分类的思想帮助学生理解和突破平衡转化率问题,并学会利用转化率解答相关试题。
一、概述
平衡转化率=
若要求某物质某一时刻的转化率只要把该物质平衡时的反应物浓度(或物质的量)改为某一时刻的反应物浓度(或物质的量)即可。
二、模型分类
下面笔者将不同条件下的不同反应体系中条件的改变进行模型分类,通过例题讲解、逆向运用、变式训练及跟踪训练的形式层层递进地来理解和突破平衡转化率。
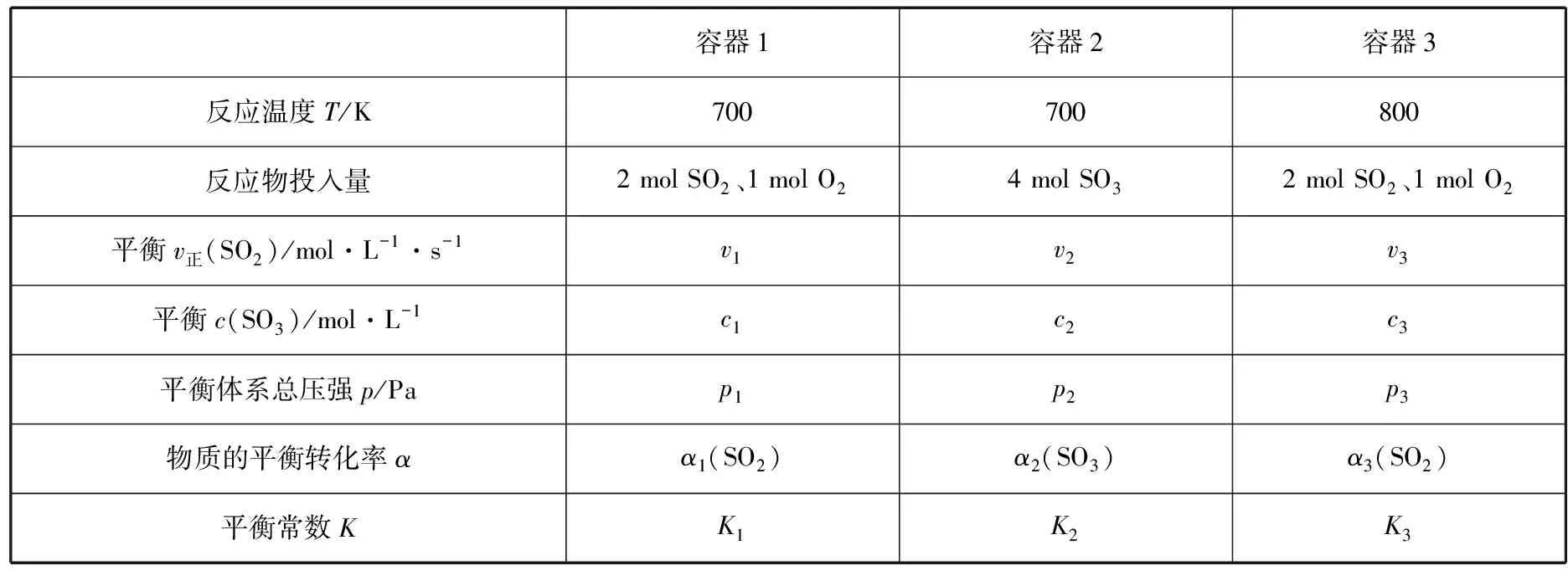
【模型1】

图1

【分析】增大反应物A的浓度,平衡向正反应方向移动,同为反应物的B的转化率增大,而A自身的转化率降低。

【分析】加入C促使D向A、B进一步转化,平衡逆向移动,即D向A、B转化的转化率增大,故A、B向C、D转化的转化率减小。
【点评】以上两种类型转化率的大小变化属于简单判断,学生很好理解,也容易得分,在此不再赘述。
【模型2】
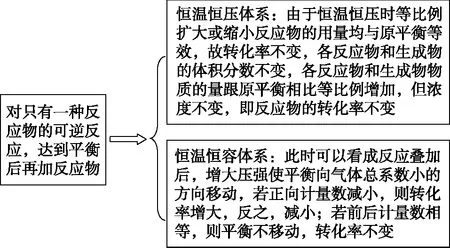
图2

【分析】该情况可认为后加入的NO2与原反应进行叠加,叠加后气体总体积增加,为了使体积维持不变,只能向体系加压从而引起叠加后的平衡向生成N2O4的方向移动,因此NO2的转化率增大。

【分析】该情况可认为后加入的N2O4与原反应进行叠加,叠加后气体总体积增加(此时N2O4的量会比原来的多)为了使体积维持不变,只能向体系加压从而引起叠加后的平衡向生成N2O4的方向移动,与例3的实质是一样的,因此N2O4的转化率减小。
【变式训练】
1.将例3、例4的题干条件改为在恒温恒压的容器中进行,则转化率分别如何变化?
【分析】若改为在恒温恒压的容器中进行,为了保持压强不变,该体系的体积增大,即转化率不变。
【参考答案及分析】该反应前后计量数相等,则即使加入HI,平衡也不移动,故HI的平衡转化率不变,但H2和I2的物质的量是增加的。
【点评】对于气相反应体系中,只有一种物质参加反应的平衡体系,再加入一定量的反应物,可以间接通过压强去判断平衡的移动方向,进而轻松判断之后的转化率的大小变化情况。对于此种类型转化率的变化部分学生理解有些困难,也是常见的考查角度,特别是例3和例4,要多加揣摩。
【跟踪训练】

【参考答案】增加 增加 减小 增加
【模型3】
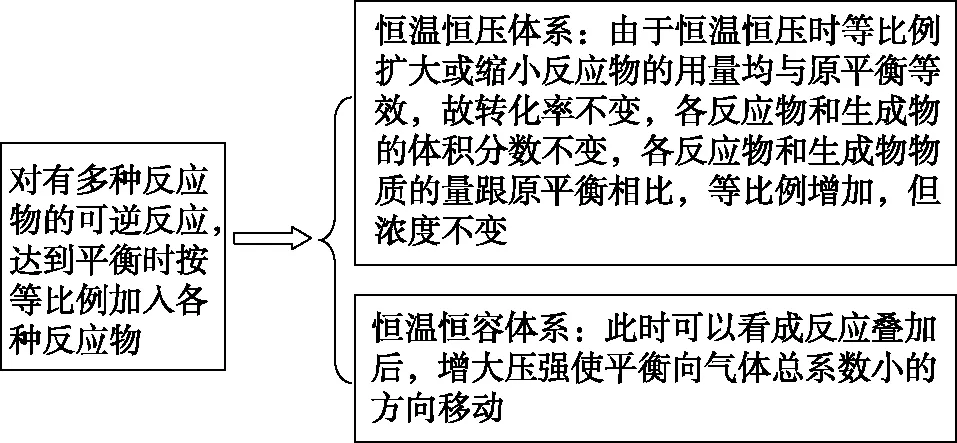
图3

【参考答案及分析】假设反应过程:
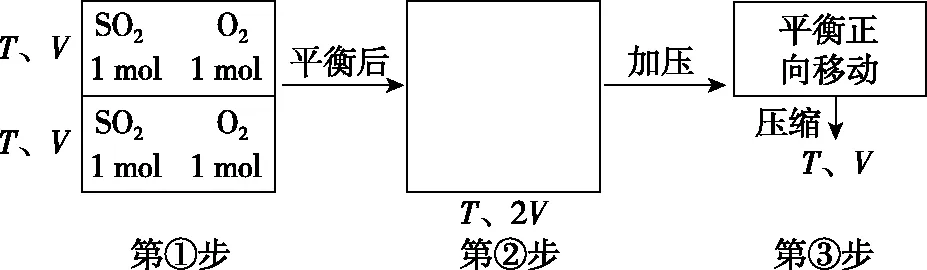
图4
第③步压缩时平衡正向移动,故SO2的转化率增大。若其他条件不变,再按原反应物的比例充入SO2和O2,即同等同程度的增大,即把两个反应物进行捆绑当成一种物质,就属于模型2中的反应物为一种物质的模型,此时可以从压强的角度来分析问题,故达到新的化学平衡时,各反应物的转化率均会增大。
【变式训练】
3.将例5的题干条件改为在恒温恒压的容器中进行,则SO2转化率将如何变化?
【分析】若改为在恒温恒压的容器中进行,为了保持压强不变,该体系的体积将增大,所以转化率是不变的。
【点评】对于多反应物体系,在二次添加反应物的时候,如果是在恒温恒容的密闭容器中等比例的添加反应物,此时的分析思路是可将多种反应物进行捆绑当成一种物质,就属于模型2中的反应物为一种物质的模型,这样就可以从压强的角度来分析问题,故达到新的化学平衡时,若正向进行,则转化率增大,逆向进行则转化率减小。此类问题也是考试中的常见考查角度之一,要熟练掌握,做到举一反三。
三、分类解析
对于平衡转化率的考查形式多样,有的试题是直接考查,主要为平衡转化率的计算和大小的变化比较,还有的试题是属于间接应用,在理解平衡转化率的基础上,结合等效平衡去判断浓度、压强、体积分数等物理量的变化,对于学生知识的内化与应用有着重要的体现。下面笔者就基于上面的三种模型来阐述在这两方面平衡转化率的应用。
1.直接考查

( )
A.b>a>cB.c>a>b
C.a>b>cD.a=b=c
【参考答案】B
【解析】此题属于反应物只是一种物质的,即属于模型2,现在再投入1 mol PCl5和1 mol NO2,相当于增大压强,对于第一个反应,平衡逆向移动,即转化率减小;第二个反应平衡正向移动,即转化率增大,故再次达到平衡时PCl5和NO2的转化率大小关系为c>a>b。

( )
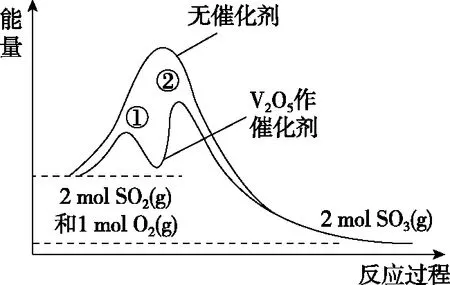
图5
A.V2O5催化时,该反应的转化率增大
B.使用V2O5作催化剂同时降低了正、逆反应的活化能
C.当反应达平衡后再充入1 mol SO2和0.5 mol O2,则O2的转化率下降
【参考答案】B
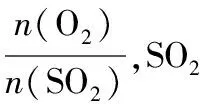
2.间接应用

( )
A.M>N B.M C.M=N D.无法比较 【参考答案】B 【解析】此题属于反应物只是一种物质的,即属于模型2,现在投入2 mol PCl5,相当于增大压强,即平衡逆向移动,故M 容器1容器2容器3反应温度T/K700700800反应物投入量2 mol SO2、1 mol O24 mol SO32 mol SO2、1 mol O2平衡v正(SO2)/mol·L-1·s-1v1v2v3平衡c(SO3)/mol·L-1c1c2c3平衡体系总压强p/Pap1p2p3物质的平衡转化率αα1(SO2)α2(SO3)α3(SO2)平衡常数KK1K2K3 下列说法正确的是 ( ) A.v1 B.K1>K3,p2>2p3 C.v1 D.c2>2c3,α2(SO3)+α3(SO2)<1 【参考答案及解析】将容器1中的反应极限化时产生2 mol SO3,容器2中SO3的起始量为4 mol,整体来讲容器2的物料浓度高于容器1,所以v1 【点评】以上两题都是直接或间接地考查平衡转化率的相关知识,特别是例9综合运用等效平衡原理和极限法分析问题是解题的关键,把浓度、压强的变化转化成从转化率的角度思考更为简单,此题作为江苏卷的压轴题,秉承着一贯的风格,具有较大的区分度,是一道综合性非常强的好题。 综合以上分析,可以得出分析平衡转化率变化的思维模型: 图6