听觉脑干植入豚鼠模型构建的标准化步骤及评价
2022-08-30潘金锡张钦杰谭皓月谭治平
周 祥, 潘金锡, 张钦杰, 李 蕴,3, 陈 颖,3, 谭皓月, 彭 飞, 黄 穗, 谭治平,吴 皓,贾 欢
1.上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海 200011;2.上海交通大学医学院耳科学研究所,上海市耳鼻疾病转化医学重点实验室,上海 200125;3. 上海交通大学医学院附属第九人民医院听觉植入中心,上海 200125;4.浙江诺尔康神经电子科技股份有限公司,杭州 311100
人工听觉脑干植入(auditory brainstem implantation,ABI)是植入式听觉重建中最尖端的技术[1-2],可以克服人工耳蜗植入(cochlear implantation,CI)的禁忌,使重度以上耳聋患者重获声音感知。目前,全球已有超过2 000例患者接受ABI手术,其适应证最初仅针对2型神经纤维瘤病(neurofibromatosis type 2,NF2)患者。NF2为常染色体显性遗传病,患者最终会由于肿瘤的生长压迫、手术切除或术后放射治疗的实施而出现双侧听神经损毁,无法因CI获益,只能依赖ABI重建听力[3]。随后,ABI适应证逐步扩大到其他无法进行CI的非NF2耳聋患者。同时,ABI手术的年龄限制也从18岁以上下降至12月龄以上,对于先天性耳聋患儿的建议手术年龄也与CI相同[4]。然而,对ABI长期随访结果表明,其临床获益个体差异大[5],且总体开放性言语感知不如CI理想。近年来,各研究团队也不断关注造成这种局限性的原因[6-7];而ABI作为脑机接口的一员,有研究表明其性能与电极神经界面之间病理生理变化及转归息息相关[8]。因此,ABI电极植入后,电极与脑组织的关系也值得深入研究。
动物模型的建立是研究ABI植入后电极组织界面关系及改进电极性能的重要内容和手段。但因电极植入的靶点——耳蜗背侧核(dorsal cochlear nucleus,DCN)为耳蜗神经向颅内延伸的听觉核团,位于重要的生命中枢脑干处,小动物植入模型的建立由于耳蜗核尺寸、电极工艺、植入技术等限制因素而面临极大的挑战, 目前该领域尚无基于ABI 技术的小型动物长期植入模型。因此,本研究为构建成功率高、重复性好的小动物模型,进行了手术步骤的标准化分析,优化了一套完整详细的建模标准化步骤,并在此基础上观察了电极神经界面,为今后探索长期植入效果欠佳的原因及优化电极方案提供参考。
1 材料与方法
1.1 实验动物
雄性白化豚鼠23 只,年龄4~6 周,体质量200~400 g;其中20 只用于手术植入电极,3 只用于定量PCR (q-PCR)实验中无干预对照。动物均购自上海实验动物中心,动物生产许可证号为SCXK(沪)2020-0006,使用许可证号为20200006000969。
1.2 电极植入标准化步骤
1.2.1 麻醉 将白化豚鼠利用盐酸替来他明唑拉西泮注射液(50 mg/kg)及噻拉嗪(25 mg/kg)腹腔注射麻醉,5~10 min起效,麻醉标准为豚鼠下肢夹捏反射消失,呼吸深慢,切开皮肤及分离颈部组织时无抵抗及肌肉颤动。若未达到满意麻醉效果,可按麻醉剂量的1/4~1/3予以追加。
1.2.2 经听泡暴露耳蜗圆窗 固定豚鼠头部后,予以颅顶正中至耳后乳突切开皮肤(图1A),逐层分离筋膜及肌肉,露出颅底孔状骨质,即听泡筛区(图1B)。将豚鼠头部稍向后侧偏,用尖刀挑开听泡薄弱骨质后,用直径1.5 mm 钻头磨除听泡骨质,暴露耳蜗底圈、耳蜗圆窗及中耳腔(图1C)。
1.2.3 经迷路暴露DCN 定位耳蜗圆窗,向颅底方向继续磨除听泡骨质,见上半规管后更换直径0.8 mm 钻头并调低钻速,继续磨除骨质直至脑膜(图1C)。小心挑开脑膜后可见小脑绒球,用吸引器轻柔吸除部分绒球组织,可见上方小脑、下方脑干及隆起于脑干表面的DCN一侧(图1D)。
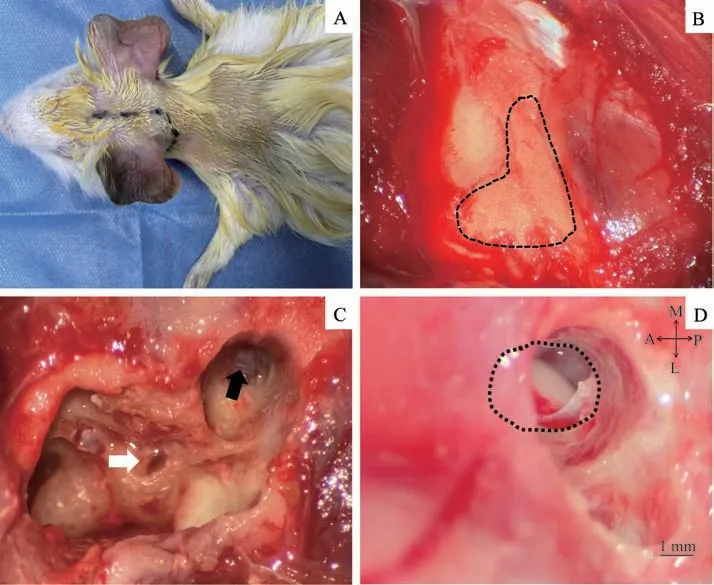
图1 豚鼠ABI手术流程Fig 1 ABI surgical procedure in guinea pigs
1.2.4 记录与测试电诱发听性脑干反应(evoke auditory brainstem response,eABR)利用实验动物连接听觉诱发电位仪(海神医疗器械有限公司,中国)测试评估eABR。术中暴露DCN后,即将刺激电极分别置于耳蜗及DCN 表面予以电刺激,同时将记录电极放置于颅顶,参考电极放置于左侧乳突,接地电极放置于左下肢,记录波形。
1.2.5 电极固定及术后护理 ABI 植入术采用的是依据豚鼠DCN 大小(约4.0 mm×2.0 mm)设计的专用ABI电极,由平板硅胶片和4 个刺激电极触点组成(铂铱合金,90∶10);每个电极触点上都引出一条铂铱合金导线电极线与相应的刺激器刺激电路相连,电极触点之间距离如图所示(图2)。术中及术后eABR 记录均采用双极刺激模式(Bipolar,BP),植入前电极进行环氧乙烷灭菌消毒。术中在DCN 处测试eABR 后,取适量止血棉固定电极头端,肌肉填塞脑膜缺损,将电极导线用光固化胶固定于听泡,并将电极头端固定缝合至豚鼠背部后,将手术切口逐层缝合。
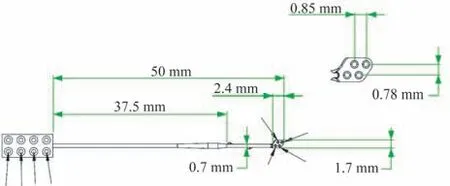
图2 豚鼠专用ABI外形及电极局部示意图Fig 2 Schematic diagram of ABI electrode for guinea pig
1.3 术后观察及评估
1.3.1 一般情况评估 术后每日观察生命体征,以及伤口有无出血、感染、肿胀等情况;记录术后动物摄食、活动、生存时间及并发症等情况。
1.3.2 电生理评估 术中暴露DCN 后分别记录耳蜗及DCN 处eABR,于动物安乐死前再次记录术后DCN 处eABR。实验中电极阵列植入的标准:耳蜗处eABR 在电刺激触发后出现4 波(Wave Ⅳ)即为有效,阈值定义为引出4 波振幅低于0.15 μV 时的刺激电流,潜伏期为刺激后至引出4 波正峰出现的时间;DCN 处eABR 在电刺激触发后出现3 波(Wave Ⅲ)即为有效,阈值定义为引出3 波振幅低于0.15 μV 时的刺激电流,潜伏期为刺激后至引出3 波正峰出现的时间。
1.3.3 组织学观察 于术后电生理测试后对动物行安乐死,心脏灌注后进行组织取材。包埋后48 h(n=1)进行苏木精-伊红(hematoxylin-eosin,H-E)染色评估。另在术后48 h(n=3)、7 d(n=3)、30 d(n=2)、180 d(n=1),经过上述心脏灌注后进行组织取样,固定后进行梯度脱水。包埋后制成厚度为50 μm的冰冻切片并贴片于载玻片上。依次烤片、清洗、封闭后,加入封闭液配置的一抗溶液(1∶1 000稀释),包括胶质纤维酸性蛋白(rabbit anti GFAP;Novus,美国)、小胶质细胞/巨噬细胞特异性蛋白抗体(goat anti Iba-1;Abcam,英国) 及神经元核抗原抗体(mouse anti NeuN;Sigma,美国);次日,清洗结束后加入封闭液配置的二抗溶液(分别为Alexa Fluor 488-conjugated donkey anti goat IgG、Alexa Fluor 594-conjugated donkey anti mouse IgG 和Alexa Fluor 647-conjugated donkey anti rabbit IgG),均以1∶500 浓度稀释。最后,用适量的含DAPI 的抗荧光淬灭剂封片。
1.3.4 q-PCR 分析 取术后48 h(n=3)、7 d(n=3)豚鼠,另取3 只未行手术的正常豚鼠为对照。过量麻醉后断头处死豚鼠,在无酶环境中快速进行双侧耳蜗核组织取材,置于消毒后离心管中;将快速制备的组织放入RNAnase (R0901;Sigma,美国) 中防止RNA 降解,放入匀浆机(JXFSTPRP-48,上海净信)研磨匀浆(总运行时长37 s,运行7 s 后中断3 s,频率为65 Hz)。随后按照TRIzol 法提取组织RNA,反转录成cDNA 后,使用SYBR Green Premix Pre Taq HS qPCR Kit 在荧光定量PCR 仪(Roche LightCycler 480;Roche,瑞士)中进行PCR 扩增。目的基因为白介素-1β(interleukin-1β,IL-1β)和基质金属蛋白酶9 (matrix metalloprotein-9,MMP-9),序列参照GeneBank 数据库,引物由NCBI Primer-blast 设计,苏州金唯智生物科技有限公司合成。
1.4 统计学分析
使用Image J 软件分别对耳蜗处和DCN 处eABR波形进行测量。通过GraphPad Prism v.8.0程序,采用方差分析(ANOVA)结合Bonferroni 检验(数据符合正态分布且方差齐性)或Kruskal-Wallis 检验进行数据统计。采用Turkey post-hoc 检验比较组间以及各时间点差异。P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况
手术过程中无豚鼠死亡,均顺利完成ABI 手术,平均手术耗时为(89.25±8.45)min(n=20)。术后急性期(0~7 d)死亡率为20%(n=4),集中在术后36~48 h。其中,3 只术后未恢复摄食反射;另1 只苏醒后恢复摄食,但在48 h 时死亡。其余16 只动物均在术后24 h 恢复摄食反射,恢复期未见伤口明显出血、感染等;在术后48 h 内有轻微平衡障碍,后逐渐恢复;未见脑脊液漏等其他明显并发症。
2.2 电生理结果
术中20 只豚鼠均成功引出耳蜗处及DCN 处eABR,除1只动物外,其余术中耳蜗处eABR在电刺激后引出4个正波,其形态与DCN 处引出eABR 类似(图3),且后者在电刺激后引出3 个正波。耳蜗处eABR 中Ⅳ波潜伏期为(2.57±0.21)ms(n=19),阈值为(0.59±0.10)mA(n=19)。术中DCN 处Ⅲ波潜伏期为(1.74±0.13) ms (n=20),阈值为(0.50±0.09)mA(n=20)。术中DCN 处eABR中Ⅲ波相较术中耳蜗处eABR 中Ⅳ波潜伏期缩短(0.84±0.22)ms(n=19),DCN 处相比耳蜗处阈值降低(0.11±0.14)mA(n=19)。术后对动物在不同时间点行安乐死前记录DCN 处eABR 波形,Ⅲ波潜伏期为(1.92±0.20)ms(n=16),阈值为(0.59±0.10)mA(n=16)。术后DCN 处eABRⅢ波与术中比较,潜伏期延长(0.19±0.22) ms (n=16), 阈 值 增 加(0.03±0.32) mA(n=16)。

图3 术中及术后eABR波形图Fig 3 eABR waveform elicited intraoperatively and postoperatively
2.3 DCN组织学变化
对电极植入后不同时间点DCN 组织进行免疫荧光染色分析,可见电极刺激并植入后DCN 表面仍保持完整结构。其中术后48 h进行H-E染色发现,植入侧与未植入侧比较,耳蜗核及相邻脑干组织出现类似组织空泡样改变,即变性细胞的胞质出现大小不一的空泡,组织整体呈蜂窝样或网状改变(图4)。在术后7 d 的免疫荧光染色中也发现植入侧耳蜗核易与脑干连接部分出现分离。自术后48 h起,植入侧的耳蜗核表面即出现胶质成分增多,术后180 d 仍较为明显(图5)。神经元密度在术后各时间点内未见明显改变。
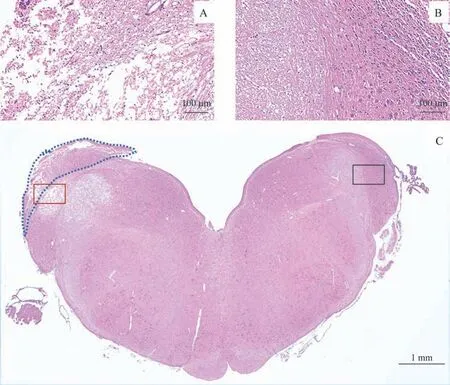
图4 术后双侧耳蜗核及脑干组织H-E染色Fig 4 H-E staining of bilateral cochlear nuclei and brainstem tissues after operation
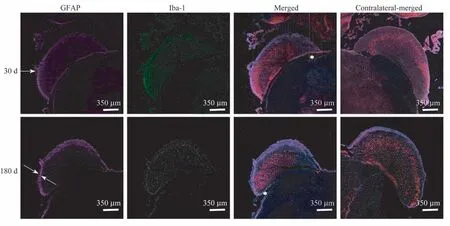
图5 术后DCN免疫荧光染色图Fig 5 Immunofluorescence staining of postoperative DCN
2.4 IL-1β和MMP-9基因表达变化
对电极植入术后48 h 及7 d 动物DCN 组织进行q-PCR 分析后发现,植入电极豚鼠(n=3)IL-1β和MMP-9基因表达量在术后48 h、7 d 时比未植入电极的对照豚鼠(n=3) 升高,但差异无统计学意义(图6)。
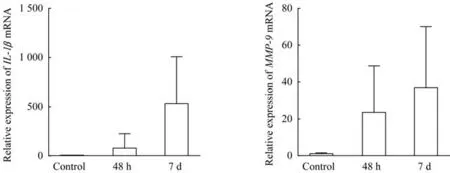
图6 q-PCR检测豚鼠电极植入后DCN部位IL-1β和MMP-9 mRNA表达量Fig 6 mRNA expression of IL-1β and MMP-9 in DCN after implantation in guinea pigs by q-PCR
3 讨论
ABI 作为目前人工听觉植入最尖端的技术之一,为那些无法通过CI 获得听力的患者带来了希望。但ABI 的临床获益始终不尽如人意,如何提升ABI性能始终是研究重点[7,9-11]。新式电极的研发、电极性能的测试或电极植入后微环境的观察及改善,都离不开动物模型。
在穿透性ABI 电极相关论著中,OTTO 等[12]利用猫这一听觉系统与人最为相似的物种进行研究,手术方式上同样利用经听泡-迷路径路,将穿透式电极植入靠近听神经根部的耳蜗腹侧核处(ventral cochlear nucleus,VCN)。而 后,GUEX 和KOZIN等[6,13]围绕柔性ABI 电极的开发,先后利用小鼠、大鼠,通过颅底径路吸除小脑暴露DCN 表面的方式植入电极。另外,非人灵长类动物也是ABI临床前测试中不可或缺的动物模型物种[14]。豚鼠模型的优势在于成本低,动物较易获得,耳蜗核大小适中;且在耳蜗核结构相关研究中也证实,不论是神经元分布或DCN 组织结构,豚鼠都比大鼠更接近于猫[15]。在手术径路上,尽管早期已有文献[16-17]利用豚鼠经听泡-迷路径路,依据听神经走行判断DCN 位置,但对豚鼠的相关解剖学研究[18-19]显示,豚鼠听神经与脑干耳蜗核之间存在一定程度的夹角,且具有个体差异。另外,DCN 表面隆起脑干1.5 mm 高度,因此,直接通过听神经寻找DCN 的困难与创伤程度不言而喻。在本研究中,我们在术中尽量避免损伤听神经,通过辨认豚鼠上半规管、侧颅底与第四脑室关系,在可视状态下暴露DCN 表面后植入电极。这不仅提高了动物建模的有效率,也大大保障了植入过程不因视野受限而导致电极或器械损伤柔软的脑组织。
脑干为重要的生命中枢,且电极植入靶点邻近后组颅神经,因此术中应注意监测呼吸、心跳以预防相关并发症。若电刺激引出其他非听觉反应,则会在eABR 波形上表现为5 ms左右高耸宽大的波形;而本研究中的eABR 波形中未观察到此现象,因此排除其他反应的产生。术后发生的死亡事件集中在36~48 h,猜测可能是由于电极植入脑干后移位,对呼吸、心率、体温,甚至摄食反射产生影响所致,或因豚鼠DCN 表面毗邻前庭核[18-19],影响其进食所致。后续改进可增加术后制动、电极固定及监护,以期进一步提高豚鼠植入后生存质量。
在ABI相关研究中,术中DCN处引出典型eABR波形能够说明电极位置的准确性[20];且在豚鼠实验中,刺激DCN 后引出的第三个正波(Ⅲ波)较为稳定[21],波形与前人研究基本一致[16,22]。在本研究结果中,暴露DCN后仍能顺利引出耳蜗eABR,可验证该术式及操作未损伤听神经,且两处eABR 波形相似也同时验证电极均成功放置于DCN表面。术后eABR相较术中,在阈值和潜伏期上稍有延后,猜测可能与术后电极组织界面因纤维化、胶质增厚或电极稍有移位有关[23]。
目前在脑机接口相关研究中发现,植入脑组织的皮质电极存在性能不稳定问题,可能由于电极表面涂层退化、电极植入后引出急性炎症、局部胶质成分激活有关。尤其是围绕电极周围形成包裹鞘的星形胶质细胞与小胶质细胞[24-27],研究其在ABI 植入后的激活、清除、极化的动态变化,对于提升ABI电极的性能极有帮助。本研究观察到植入后48 h起,局部星形胶质细胞与小胶质细胞开始增多,与先前针对皮质内插入式相关研究的发现一致[23]。此外,在术后48 h样本中,植入侧可观察到耳蜗核及相邻脑干区域的空泡样改变,这与早前在沙鼠的噪音暴露后的耳蜗核海绵样改变相似[28]。我们猜测该现象可能为电刺激后的兴奋毒性改变,即激活过多兴奋性氨基酸神经递质,引发了细胞水肿或线粒体损伤。q-PCR 结果显示48 h 时出现IL-1β的激活。由于该细胞因子由活化的巨噬细胞作为前蛋白产生,而胶质增生的激活来源于巨噬细胞作用,说明ABI植入后局部有胶质活动。另外,MMP-9基因在48 h 也出现升高。由于这一基因功能是降解和重塑细胞外基质的动态平衡,参与维持血脑屏障的完整性[29],因此说明即使ABI 板状电极未侵入组织深部,但同样引发了血脑屏障的破坏。
综合考虑到实验周期及成本(条件反射训练等),本研究中未采用行为学测试进行验证。虽然行为学测试能更好地评估听觉功能,但通常听觉电生理也能反映听觉植入装置的有效性[30]。此外,本次实验样本量较少,虽然观察到组织学疑似变化,但需后期加大样本量进一步验证。因为本研究中,动物并发症少,eABR 反应好,电极组织界面理想,仍足以验证该动物模型的可靠性和有效性。
由于ABI手术难度大,且适合人群范围窄(适用于NF2、耳蜗/蜗神经严重畸形等罕见病患者),并涉及多学科领域,国内外基础及临床研究团队较少。但由于我国人口基数较大,罹患这类疾病的患者数量仍然较多,且该方向与脑科学、脑机接口等前沿领域关系密切,因此值得深入研究。未来ABI的研究方向应当向柔性电极、表面修饰、电刺激策略等方面发展。构建成功的动物模型,无疑是相关研究得以开展的重要基石。
综上,本研究改良构建的经听泡-迷路径路ABI植入豚鼠模型安全可靠。术后急性期、短期可观察到ABI 电极组织界面的变化,尤其是胶质成分的增多,及其对听觉电生理阈值与潜伏期的影响。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有动物实验均已通过上海交通大学医学院附属第九人民医院伦理委员会的审核批准(审批号SH9H-2021-A538-SB)。所有实验过程均遵照上海交通大学医学院实验动物伦理委员会相关条例进行。
All experimental animal protocols in this study were reviewed and approved by Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine (Approval Letter, SH9H-2021-A538-SB, dated 22/02/2021), and all experimental animal protocols were carried out by following the guidelines of Experimental Animal Ethics Committee of Shanghai Jiao Tong University School of Medicine.
作者贡献/Authors'Contributions
周祥参与了数据采集和分析、论文撰写;潘金锡、张钦杰参与了数据处理、论文修改;李蕴参与了听觉电生理测试指导;陈颖参与了听觉电生理测试;谭皓月参与了论文修改;彭飞、黄穗、谭治平参与了实验及电极设计;吴皓参与了实验指导;贾欢参与实验设计、监督及论文修改。所有作者均阅读并同意了最终稿件的提交。ZHOU Xiang acquired and analyzed the data, and drafted the manuscript. PAN Jinxi and ZHANG Qinjie analyzed and interpreted the data, and revised the manuscript. LI Yun guided the auditory electrophysiological test. CHEN Ying participated in the auditory electrophysiological test. TAN Haoyue revised the manuscript. PENG Fei, HUANG Sui, and TAN Zhiping participated in the experiment and electrode design. WU Hao participated in the experimental study guidance. JIA Huan conceived and designed the study supervision and manuscript correction. All the authors have read the last version of paper and consented for submission.
·Received:2022-03-27
·Accepted:2022-04-15
·Published online:2022-05-28
