SIRT3/FoxO3a通路参与三叶苷预处理保护下肢缺血再灌注继发的肺损伤
2022-08-30白艳辉刘伟明蒋雨光王秀丽
王 磊,白艳辉,赵 冬,刘伟明,李 佳,蒋雨光,王秀丽
(1.河北医科大学第三医院 麻醉科,河北 石家庄 050051;2.保定市第一中心医院 麻醉科,河北 保定 071000;3.保定市第二医院 检验科,河北 保定 071000;4.保定华医中医医院 检验科,河北 保定 071000)
下肢缺血再灌注是继发肺损伤的主要原因之一[1-2],其机制可能是缺血缺氧致细胞内的线粒体功能受损,导致细胞肿胀坏死,再灌注过程中氧化应激及炎性反应进一步致组织损伤加重[3-4]。研究发现,线粒体形态功能障碍是肺损伤发生发展的重要标志[5-6],SIRT3位于线粒体内,参与线粒体的多种生物调节:如抗氧化应激、能量合成代谢、细胞裂变融合等。SIRT3过表达可抑制氧化应激,改善器官缺血再灌注损伤[7-8]。FoxO3a作为SIRT3的下游转录因子,生理状态下广泛存在心、肺、肝、肾、神经系统中,参与细胞内多种生化代谢调控[9]。其转录活性受到乙酰化修饰的调节,在氧化应激刺激下SIRT3使FoxO3a去乙酰化作用增强,降低其转录活性,从而增强抗氧化能力[10]。通过调节SIRT3/ FoxO3a信号通路可降低氧化应激反应,减轻肝缺血再灌注所致的器官损伤[11]。三叶苷是多穗柯叶的主要提取物,且有抗炎、抗氧化等功效[12-13],作为SIRT3激动剂[14],可通过上调SIRT3缓解脑缺血再灌注所致的神经损伤。但三叶苷是否能通过调节SIRT3/FoxO3a通路改善下肢缺血再灌注继发的肺损伤尚不清楚,因此本研究以SIRT3/FoxO3a通路为切入点,探讨三叶苷预处理对下肢缺血再灌注继发肺损伤的保护作用及可能机制。
1 材料与方法
1.1 主要试剂和实验动物 MDA、SOD、GSH-Px试剂盒购自上海碧云天公司;I抗SIRT3、I抗FoxO3a购自美国Abcam公司;8~10周龄雄性C57BL6小鼠由中国医学科学院放射医学研究所提供。
1.2 方法 将50只小鼠[体重(30±2) g]采用数字表法随机分为5组,每组10只,即假模型组(Control组)、缺血再灌注组(IR组)、三叶苷组(TLB+IR组)、三叶苷+SIRT3抑制剂组(3-TYP+TLB+IR组)、SIRT3抑制剂组(3-TYP+IR组)。模型制备:参照文献[15]制备下肢IR模型,巴比妥钠进行麻醉后,用止血带结扎双后肢根部造成后肢缺血,缺血3 h后松解止血带,对双后肢进行按摩以加速血流复灌,再灌注3 h后,分离肺组织并留取外周血备用,遂即处死小鼠。Control组仅进行麻醉后开胸,分离肺组织等操作,不对后肢血管进行夹闭。TLB+IR组于造模前给予三叶苷30 mg/(kg·d)灌胃,连续3 d。3-TYP+TLB+IR组于造模前连续3 d经腹腔注射SIRT3选择性抑制剂50 mg/(kg·d),30 min后经灌胃给予三叶苷30 mg/(kg·d)。
1.3 指标检测
1.3.1 血气分析及氧化应激指标测定 抽取动脉血,利用血气分析仪记录动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)。取部分左肺组织,加入细胞裂解液,4 ℃、12 000 r/min离心15 min,留取上清,采用硫代巴比妥酸法测定MDA含量,采用黄嘌呤氧化酶法测定SOD、GSH-Px活力。
1.3.2 肺组织病理学观察及凋亡检测 右肺组织进行湿、干称重,计算肺湿/干比值,取部分左肺组织制备组织切片,HE染色后光镜下观察肺组织形态,参照文献[16]随机抽取10个高倍视野进行评分。切片经脱蜡至水、组织透化、TUNEL标记、DAPI复染、镜检肺组织凋亡情况。
1.3.3 肺组织SIRT3、FoxO3a蛋白表达测定 取部分左肺组织匀浆,加入细胞裂解液和蛋白酶抑制剂PMSF冰上裂解2 h后,4 ℃、12 000 r/min离心15 min后取上清,采用Western blot法,95 ℃变性10 min,PAGE电泳分离后转至PVDF膜,加入I抗SIRT3、I抗FoxO3a分别置摇床孵育2 h,弃I抗,TBST漂洗后加入辣根过氧化酶标记的II抗,摇床孵育1 h,弃II抗,TBST漂洗,用化学发光法曝光显影,采用Quantity one 软件进行分析,以各目的蛋白条带灰度值与GAPDH 条带灰度值的比值反映各目的蛋白表达。
1.4 统计学分析 采用SPSS 26.0统计学软件进行分析,假模型组与模型组间比较用t检验,不同模型组间采用两因素两水平析因设计方差分析,评分资料应用秩和检验分析。P<0.05为差异有统计学意义。
2 结果
2.1 Control组与模型组各项指标比较 T检验比较Control组与模型组小鼠各项指标,与Control组比较,模型组各指标均有统计学意义(P<0.05,见表1)。提示缺血再灌注模型制备成功。

表1 Control组与模型组各项指标比较
2.2 各组小鼠动脉血气分析比较 TLB可以增加缺血再灌注小鼠的PaO2,降低PaCO2;3-TYP可以降低缺血再灌注小鼠的PaO2,升高PaCO2。TLB和3-TYP对缺血再灌注小鼠PaO2的影响无交互作用(见表2、3)。
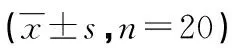
表2 TLB、3-TYP对缺血再灌注小鼠PaO2影响
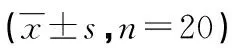
表3 TLB、3-TYP对缺血再灌注小鼠PaCO2影响
2.3 小鼠肺组织病理学形态及损伤评分、凋亡率、W/D比值测定 光镜下可见Control组肺泡形态结构完整,未见明显异常;IR组、3-TYP+TLB+IR组、3-TYP+IR组均可见肺泡形态结构破坏,肺泡壁毛细血管扩张充血明显,伴大量炎性细胞浸润,肺泡内渗出较多;TLB+IR组肺泡形态相对完好,肺泡壁毛细血管扩张充血较轻,伴少许炎性细胞浸润(见图1、表4)。TLB可以降低缺血再灌注小鼠肺W/D比值、细胞凋亡率;3-TYP可以升高缺血再灌注小鼠肺W/D比值、细胞凋亡率。TLB和3-TYP对缺血再灌注小鼠肺W/D比值和细胞凋亡率的影响无交互作用(见表5、6)。
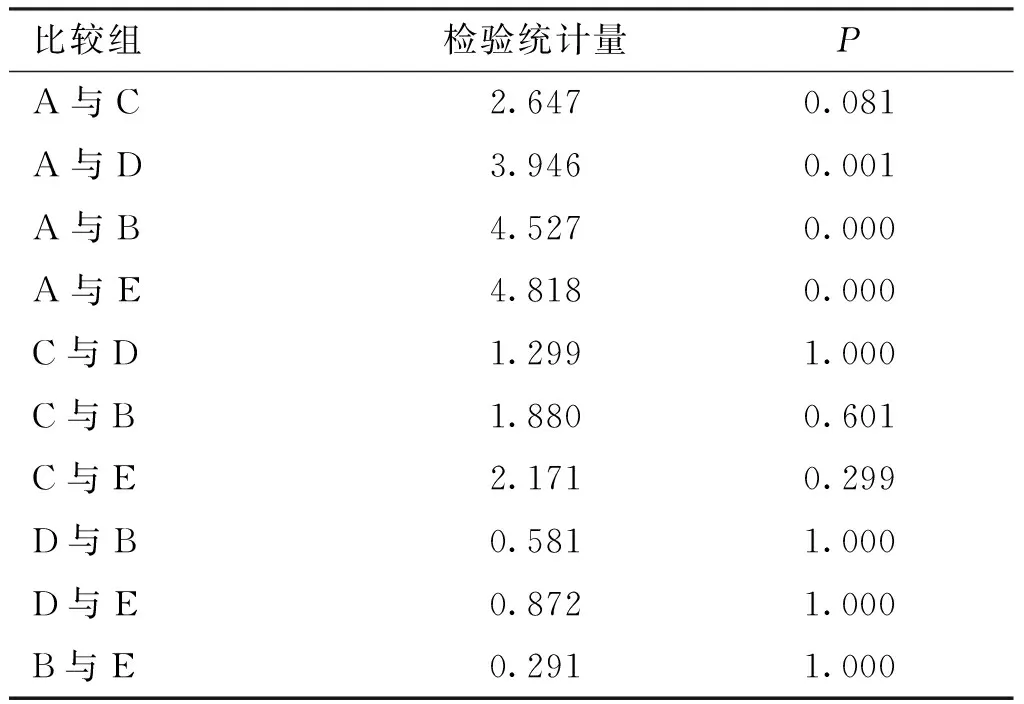
表4 各组间小鼠肺组织病理评分比较
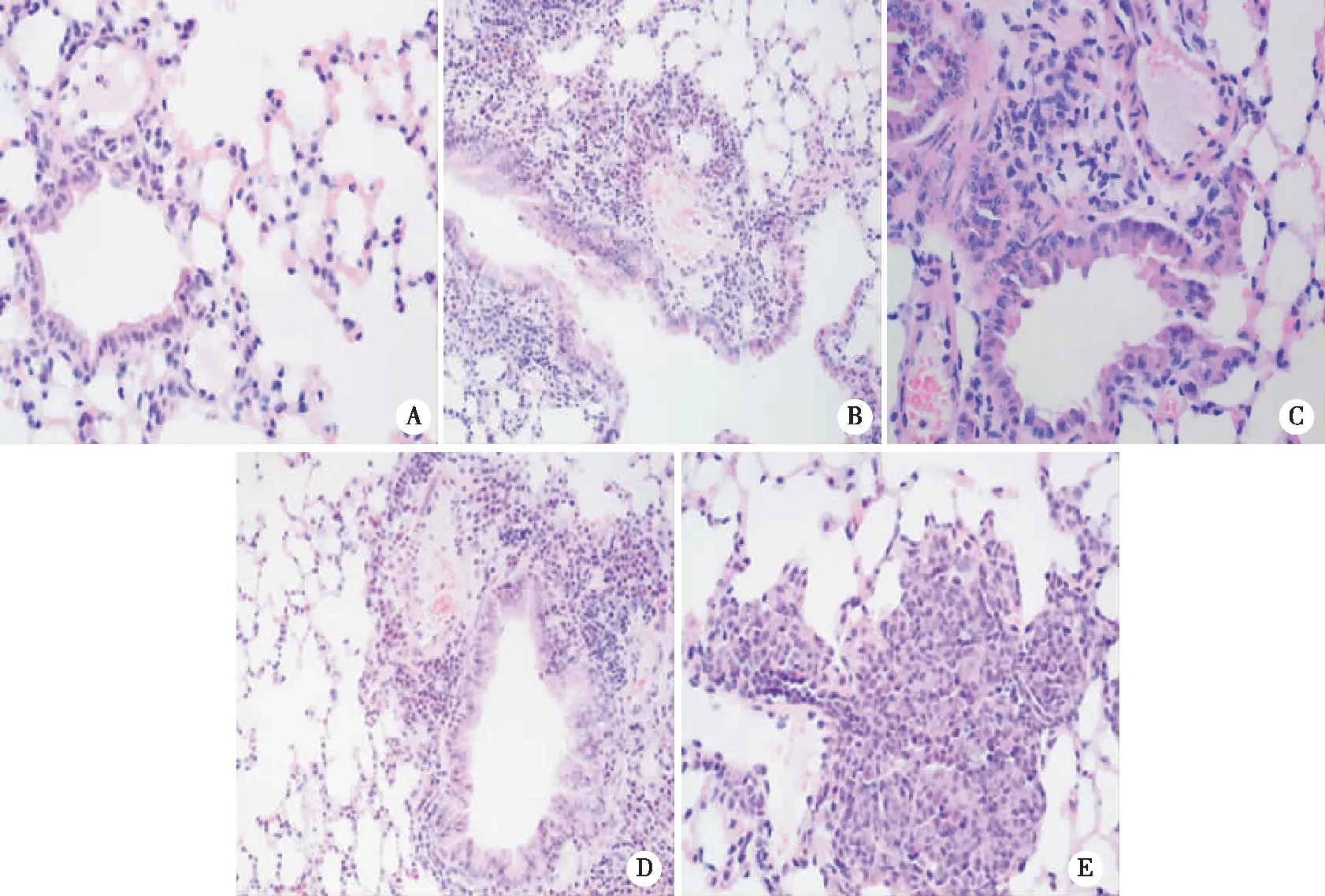
A:Control组;B:IR组;C:TLB+IR组;D:3-TYP+TLB+IR组;E:3-TYP+IR组;×200。
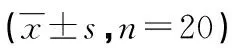
表5 TLB、3-TYP对缺血再灌注小鼠肺W/D比值影响
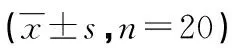
表6 TLB、3-TYP对缺血再灌注小鼠细胞凋亡率影响
2.4 小鼠肺组织氧化应激指标测定 TLB可以降低缺血再灌注小鼠MDA,提高SOD、GSH-Px活性;3-TYP可以升高缺血再灌注小鼠MDA、降低SOD、GSH-Px活性。TLB和3-TYP对缺血再灌注小鼠MDA、SOD、GSH-Px的影响无交互作用,见表7~9。
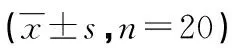
表7 TLB、3-TYP对缺血再灌注小鼠MDA影响

表8 TLB、3-TYP对缺血再灌注小鼠SOD影响

表9 TLB、3-TYP对缺血再灌注小鼠GSH-Px影响
2.5 小鼠肺组织SIRT3、FoxO3a蛋白表达测定 三叶苷可以上调缺血再灌注小鼠SIRT3表达,下调FoxO3表达;3-TYP可以下调缺血再灌注小鼠SIRT3表达,上调FoxO3表达。TLB和3-TYP对缺血再灌注小鼠SIRT3、FoxO3表达的影响无交互作用,见表10~11。
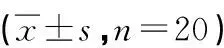
表10 TLB、3-TYP对缺血再灌注小鼠SIRT3表达影响
表11 TLB、3-TYP对缺血再灌注小鼠FoxO3表达影响
3 讨论
下肢缺血再灌注不仅影响局部缺血组织的功能,还会导致远隔器官的功能障碍,其中肺是最易受损的器官之一[1-4]。本实验经后肢根部结扎之后再灌注,发现IR组血气指标恶化,病理切片示肺泡结构破坏,肺损伤评分及凋亡指数显著升高,提示下肢缺血再灌注肺损伤的模型制备成功。
SIRT3是一种依赖烟酰胺腺苷二核苷酸的去乙酰化酶,通过抗细胞氧化应激、能量合成代谢等方式对细胞起着重要的保护作用。激活SIRT3可改善缺血再灌注所致的氧化应激损伤、抑制炎症和保护线粒体功能[17]。三叶苷作为SIRT3激活剂,可激活线粒体内的SIRT3,抑制线粒体膜电位降低,减少活性氧过度生成,减轻细胞免受氧化损伤[18]。本研究发现,三叶苷预处理可使Trilobatin+IR组SIRT3蛋白表达增强,抗氧化酶SOD、GSH-Px活性增高、过氧化物MDA含量降低,血气指标改善,肺损伤评分及凋亡指数显著降低,提示三叶苷可通过减轻氧化应激反应,保护下肢缺血再灌注所致的肺损伤。
FoxO3a蛋白通过被SIRT3去乙酰化方式调节其转录活性,并在细胞分化、凋亡及氧化应激等方面发挥调节作用。Guo等[19]发现FoxO3a启动区域H4乙酰化水平增高,可促进SOD上调,抑制氧化应激反应。本实验发现通过抑制SIRT3,3-TYP+Trilobatin+IR组SIRT3蛋白表达下调,FoxO3a蛋白表达增高,肺损伤评分及凋亡指数增高,提示下调SIRT3蛋白表达,可显著减弱三叶苷在抗氧化应激方面的保护作用,加重缺血再灌注所致的肺损伤。其机制可能是三叶苷通过上调线粒体内SIRT3蛋白表达,去乙酰泛素化降解FoxO3a蛋白,使其蛋白表达降低,降低细胞活性氧水平,减轻氧化应激反应[20],改善缺血再灌注引起的肺损伤。本研究不足之处:①由于本研究样本量相对较少,对于肺病理学评分采用秩和检验分析,只能得出Control组与模型组有统计学差异,而模型组之间由于样本量较少,评分分值差异不明显,故今后的研究适当增加样本量。②下肢缺血再灌注继发肺损伤的作用机制十分复杂,并非由单一细胞因子起决定性作用,还有其他细胞因子和炎性介质的相互作用,相互制约,共同调节肺脏的发生发展,这也是本课题组进一步的研究方向。
综上所述,三叶苷预处理可能通过调节SIRT3/ FoxO3a通路,减轻氧化应激反应,改善下肢缺血再灌注继发的肺损伤。
