慢性阻塞性肺疾病小鼠外周血和BALF中CD83、Th17/Treg细胞的表达及意义
2022-08-30张兰英欧阳瑶
张 婧,张兰英,欧阳瑶
(遵义医科大学附属医院 呼吸与危重症医学科,贵州 遵义 563099)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种由多种因素引起的以气流受限为特征的慢性炎症性肺疾病[1]。目前,全球COPD患者已达2.994亿人[1]。据报道,2017年有320万人死于COPD,已成为全球第三大致死疾病[1]。虽然研究报道吸烟是COPD最主要的和最常见的危险因素,但COPD发生的具体机制仍不十分清楚。因此,进一步探讨COPD发生的具体机制,对COPD的防治有重要的临床价值。
研究发现CD4+T淋巴细胞参与的免疫炎症反应在COPD的发生和发展中起到重要的调控作用[2]。CD4+T淋巴细胞包括辅助性T细胞1(T helper 1,Th1)、Th2、Th17、调节性T细胞(T regulatory,Treg)和滤泡辅助性T细胞。Th17细胞主要分泌白介素-17(Interleukin-17,IL-17)等细胞因子促进炎症反应[3]。Treg细胞通过分泌IL-10等细胞因子以达到抑制炎症反应的目的[3]。叉头状转录因子3(Forkhead box protein 3,FOXP3)可调控Treg细胞生长和分化,是鉴定Treg细胞最可靠的生物标记物[4]。在生理状态下,Treg细胞和Th17细胞处于动态平衡以维持免疫稳态。然而,在病理状态下,Th17/Treg细胞平衡失调则可导致免疫炎症疾病的发生。研究报道Th17/Treg细胞失衡可能参与COPD的形成[5]。
树突状细胞(Dendritic cell,DC)是一种由骨髓样干细胞和淋巴样干细胞分化而来的抗原提呈细胞[6]。DC通过刺激初始T细胞,使T细胞向Th17细胞分化或抑制Treg细胞产生,进一步参与不同类型的免疫反应[6]。DC包括未成熟DC(Immature DC,iDC)和成熟DC(Mature DC,mDC)。CD83是mDC的特征性标记物,在mDC执行抗原提呈和活化T细胞的过程中发挥着重要的作用[7]。CD1a是iDC的特征性标记物[8]。iDC通过诱导Treg细胞生成,从而在维持外周和中枢免疫耐受过程中发挥重要的作用[9]。研究发现DC参与了COPD的发生发展[10],但其具体机制尚未完全明确。
本研究采用烟熏的方法建立COPD小鼠模型,通过流式细胞仪检测小鼠外周血和支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)中CD83、Th17细胞和Treg细胞的表达情况,从而进一步探讨COPD发生发展中的免疫机制。
1 材料与方法
1.1 实验对象 26只6~8周龄C57BL/6小鼠(SPF级、雌雄不限、体重约20~25 g),购买于第三军医大学动物实验中心。
1.2 实验试剂 黄果树牌香烟(焦油量:11 mg;烟气烟碱量:0.9 mg;烟气一氧化碳量:13 mg)购买于贵州中国工业有限责任公司;抗小鼠CD83抗体、抗小鼠CD4抗体、抗小鼠CD25抗体、抗小鼠IL-17抗体和抗小鼠FOXP3抗体均购买于eBioscience公司。
1.3 实验方法
1.3.1 COPD小鼠模型的建立 随机将26只C57BL/6小鼠分为对照组(Control组)(n=10)和COPD模型组(n=16)。将模型组小鼠放置于玻璃箱内,将燃烧的香烟置于玻璃箱内,使小鼠每天被动吸烟4次,6支烟/次,1 h/次,上午2次,中间间隔30 min;下午2次,中间间隔30 min,每周6 d,持续4周。Control组小鼠在正常环境下饲养。于实验第28天,处死两组小鼠,收集1mL小鼠内眦静脉丛血液以及BALF。该研究经遵义医科大学附属医院伦理委员会批准后实施。
1.3.2 流式细胞术 检测Th17和Treg细胞准备两个流失专用的试管,测定管中加入需检测分子的抗体,对照管中加入阴性对照抗体。加入样本(外周血或BALF),混匀后,室温避光孵育25 min。用PBS洗涤细胞2次,于4 ℃、1 000 r/min离心5 min,弃上清。加入200 μL的 1%多聚甲醛,混匀后,可进行上机检测。

2 结果
2.1 两组小鼠体重变化 从实验开始到实验结束,随着时间的延长,Control组小鼠的体重呈逐渐增加的趋势;而COPD模型组小鼠的体重呈逐渐下降的趋势。在实验第7、14、21、28天,与Control组相比,COPD模型组小鼠的体重均降低(P<0.05,见表1)。
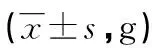
表1 两种小鼠体重变化
2.2 小鼠肺组织病理特征 两组小鼠肺组织HE染色结果显示:Control组小鼠肺泡结构完整,肺泡壁正常,肺泡间隔未见明显炎性细胞浸润(见图1A);COPD模型组小鼠肺泡结构破坏,大部分肺泡相互融合形成较大的肺泡腔,肺泡间隔有较多的炎性细胞浸润(见图1B),提示吸入香烟烟雾可以成功构建小鼠COPD模型。
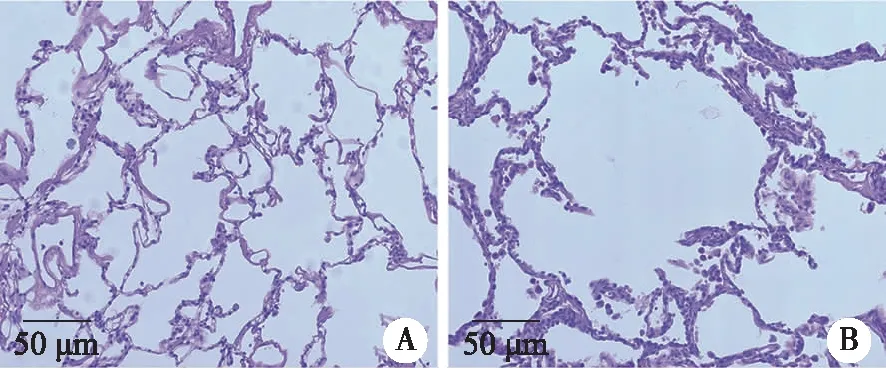
A:Control组小鼠肺泡结构完整,肺泡壁正常、连续,肺泡间隔未见明显炎性细胞浸润;B:COPD模型组小鼠肺泡结构破坏,大部分肺泡相互融合形成较大的肺泡腔,肺泡间隔有较多的炎症细胞浸润。
2.3 小鼠外周血和BALF中CD83的表达 由于CD83是mDC的特征性标记物,故采用CD83来反应mDC的含量[7]。流式细胞术结果显示,与Control组(20.74±2.95)相比,COPD模型组小鼠外周血中CD83(8.69 ±2.28)表达显著降低(P<0.05,见图2A~C)。同样,COPD模型组BALF中CD83的表达(15.06±6.19)较Control组(72.04±10.44)明显降低(P<0.05,图2D~F)。上述结果提示香烟烟雾可能抑制DC成熟。
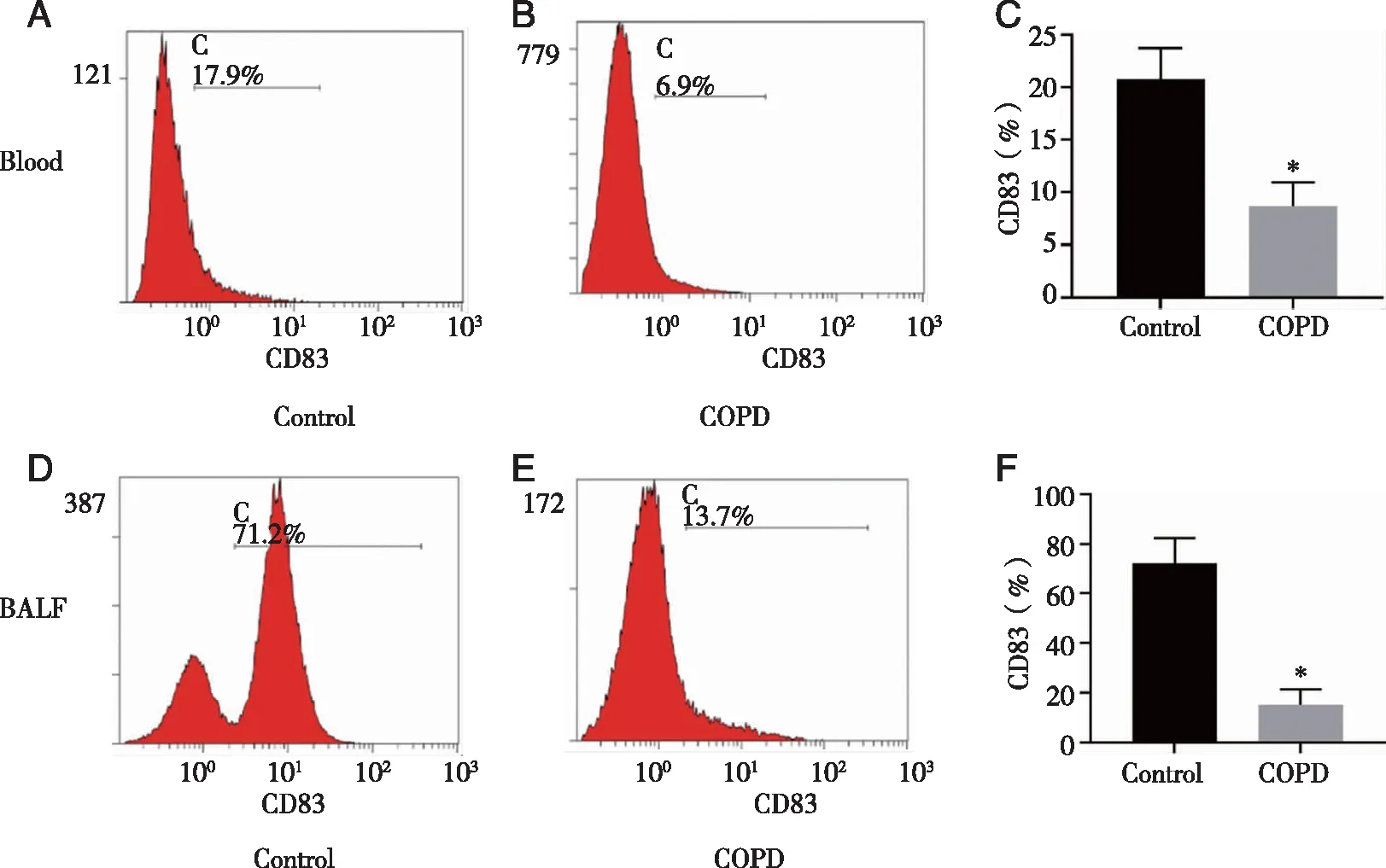
A:Control组小鼠外周血CD83的表达;B:COPD模型组小鼠外周血CD83的表达;C:Control组和COPD模型组小鼠外周血CD83的表达;D:Control组小鼠BALF中CD83的表达;E:COPD模型组小鼠BALF中CD83的表达;F:Control组和COPD模型组小鼠BALF中CD83的表达;*:与Control组比较,P<0.05。
2.4 小鼠外周血和BALF中Th17细胞的表达 通过流式细胞仪检测小鼠外周血及BALF中Th17细胞的表达,以CD4+IL-17A+细胞占总CD4+T细胞百分比表示。结果显示,COPD模型组外周血中Th17细胞的百分比含量(4.09±0.47)较Control组(1.02±0.28)明显增高(P<0.05,见图3A~C)。与Control组(3.39±0.35)相比,COPD模型组BALF中Th17细胞的百分比含量(5.59±0.32)也显著增高(P<0.05,图3D~F)。上述结果提示Th17细胞增多可能促进COPD的发病。
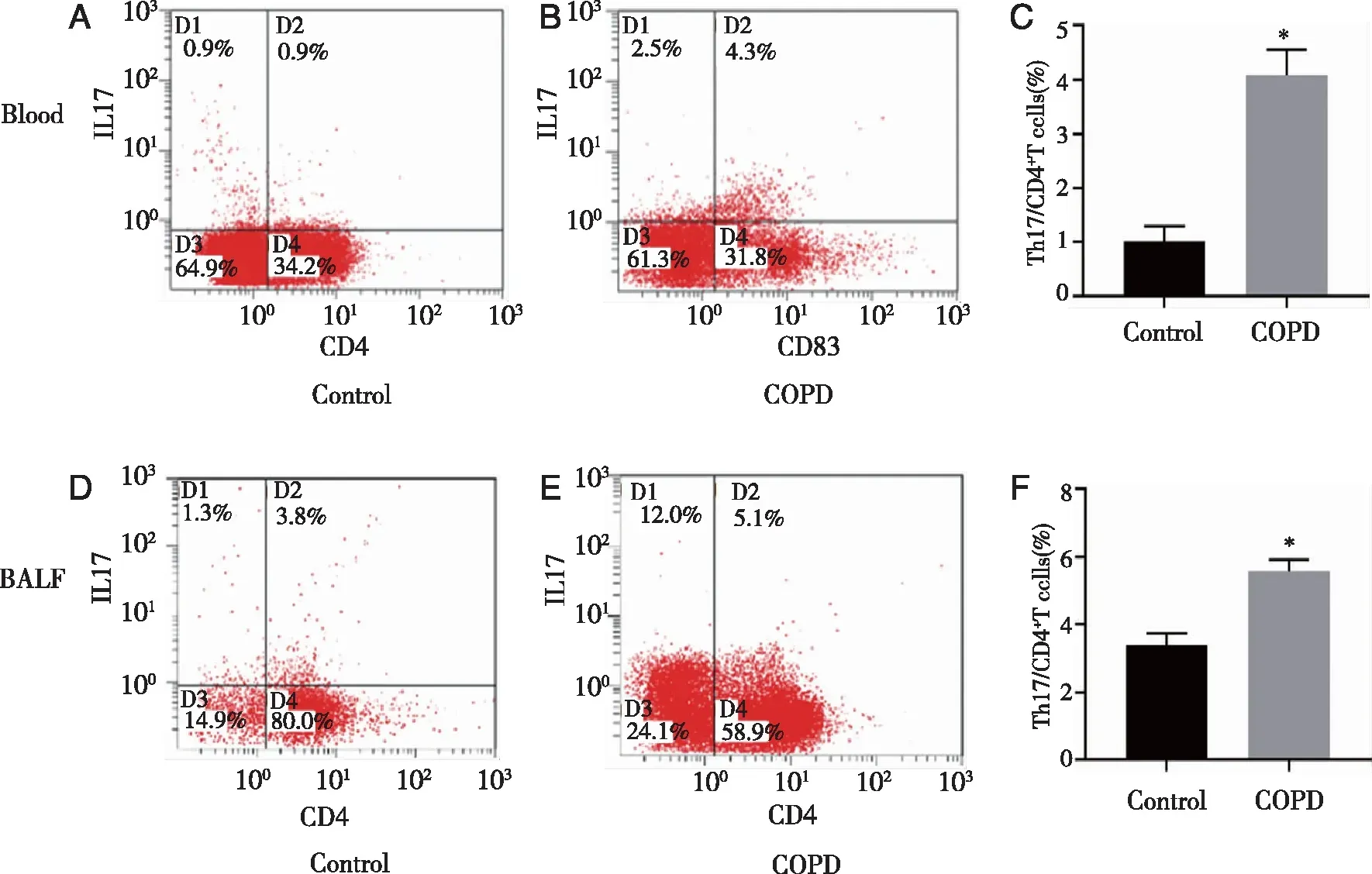
通过流式细胞术检测小鼠外周血及BALF中Th17细胞的百分比含量,用CD4+IL-17A+细胞占总CD4+T细胞百分比表示。A:Control组小鼠外周血中Th17细胞的百分比含量;B:COPD模型组小鼠外周血中Th17细胞的百分比含量;C:Control组和COPD模型组小鼠外周血中Th17细胞的百分比含量;D:Control组小鼠BALF中Th17细胞的百分比含量;E:COPD模型组小鼠BALF中Th17细胞的百分比含量;F:Control组和COPD模型组小鼠BALF中Th17细胞的百分比含量;*:与Control组比较,P<0.05。
2.5 小鼠外周血和BALF中Treg细胞的表达 设置CD4+T细胞为门控,流式细胞术检测外周血和BALF中Treg细胞的表达,用CD4+CD25+FOXP3+细胞占总CD4+T细胞的百分比表示。结果显示,COPD模型组小鼠外周血中Treg细胞含量(0.39±0.09)较Control组(1.09±0.44)降低(P<0.05,图4A~C)。同样,COPD模型组小鼠BALF中Treg细胞的含量(0.51±0.16)显著低于Control组(2.57±0.35,P<0.05,图4D~F)。上述结果表明Treg细胞减少可能导致COPD的发病。
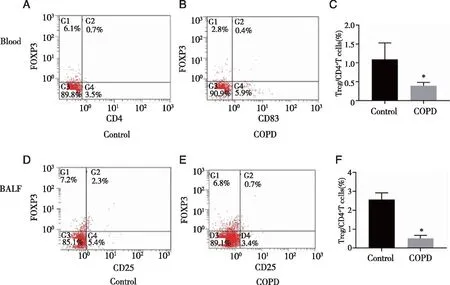
设置CD4+T细胞为门控,流式细胞术检测外周血和BALF中Treg细胞的百分比含量,用CD4+CD25+FOXP3+细胞占总CD4+T细胞百分比表示。A:Control组小鼠外周血中Treg细胞的百分比含量;B:COPD模型组小鼠外周血中Treg细胞的百分比含量;C:Control组和COPD模型组小鼠外周血中Treg细胞的百分比含量;D:Control组小鼠BALF中Treg细胞的百分比含量;E:COPD模型组小鼠BALF中Treg细胞的百分比含量;F:Control组和COPD模型组小鼠BALF中Treg细胞的百分比含量;*:与Control组比较, P<0.05。
2.6 小鼠外周血和BALF中Th17/Treg细胞的比值计算 两组小鼠外周血和BALF中Th17细胞和Treg细胞的比值,并对其进行对比分析。结果显示,COPD模型组小鼠外周血中Th17/Treg细胞的比值(10.86±2.62)较Control组(1.06±0.50)升高(P<0.05,见图5)。同样,COPD模型组小鼠BALF中Th17/Treg细胞的比值(12.05±3.61)也显著高于Control组(1.33±0.17,P<0.05,见图5)。上述结果提示Th17/Treg细胞失衡可能导致COPD的发病。
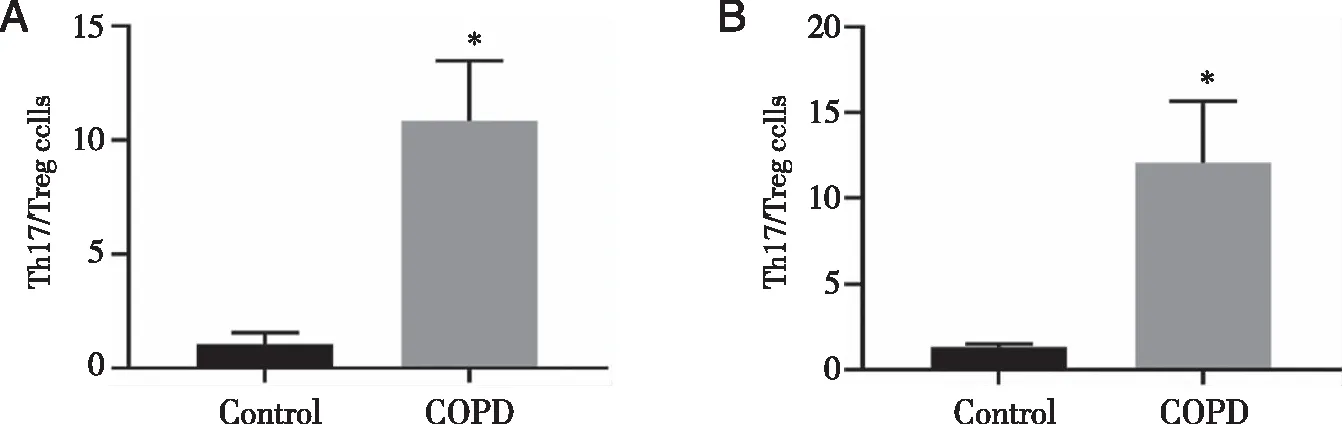
A:Blood;B:BALF;*:与Control组比较, P<0.05。
3 讨论
COPD是一种发病率和病死率逐年升高的呼吸系统慢性疾病,其发病机制尚不清楚,尤其是其免疫机制有待进一步研究。吸烟是COPD形成的危险因素,可能引起T细胞介导的免疫反应失衡,导致COPD发生[10]。本研究发现香烟烟雾可能导致小鼠体内CD83+DC减少,Th17/Treg细胞比值增加,从而导致COPD的发生。
本课题组前期通过烟熏4周的方法成功构建了COPD动物模型[10],因此本研究也采用此方法构建小鼠COPD模型。HE染色结果表明,烟熏4周已成功构建小鼠COPD模型。DC在启动和维持自身免疫反应中起着重要的作用,是连接先天性和适应性免疫反应的桥梁[11]。DC是否成熟以及表面共刺激分子的表达水平可直接影响免疫反应的类型[12]。此外,DC可刺激初始T细胞,使Th细胞向Th17细胞分化并可抑制Treg细胞的产生,从而参与免疫反应[6]。本研究通过流式细胞术检测发现COPD模型组小鼠外周血及BALF中CD83+的DC减少,提示成熟DC的减少可能参与COPD的形成。
Th17细胞通过分泌IL-17等细胞因子在自身免疫性疾病中起着促进免疫炎症反应的作用,如银屑病、炎症性肠病、多发性硬化症和类风湿性关节炎等,而Treg细胞则具有抑制免疫炎症反应的作用[13]。据报道,Th17/Treg细胞比例失衡可导致自身免疫性甲状腺疾病[14]、哮喘[15]以及慢性牙周炎[16]等疾病的发生。本研究发现COPD模型组小鼠外周血和BALF中Th17细胞增加,Treg细胞减少,Th17/Treg细胞比例增加,提示Th17/Treg细胞比例增加,可能促进COPD的发生发展。
香烟烟雾会影响DC成熟,并且抑制DC刺激初始T细胞及分泌细胞因子的能力,进而导致DC介导的免疫反应失调[17]。DC使初始T细胞分化成不同类型的T细胞亚群[18],其分泌的IL-6是初始T细胞向Th细胞或Treg细胞分化的关键性因素[19]。此外,Th17细胞通过分泌细胞因子诱导DC产生IL-6,参与COPD的慢性炎症过程[20]。本研究发现COPD模型组小鼠外周血和BALF中CD83+DC减少,即成熟DC降低,Th17/Treg细胞比例增加,提示DC可能参与Th17/Treg细胞失衡,导致COPD的形成,但其具体机制有待进一步研究。
综上所述,本研究发现香烟烟雾可能抑制DC的成熟,导致Th17/Treg细胞失衡,从而参与COPD的发生发展。
