亚抑菌浓度亚胺培南西司他丁钠诱导铜绿假单胞菌生物被膜形成的体外研究
2022-08-30徐运娥卢忠义敖弟书
徐运娥,卢忠义,敖弟书,宋 鸿
(遵义医科大学 基础医学院微生物学教研室,贵州 遵义 563099)
细菌为了适应生存环境而黏附在惰性或活性组织表面生长繁殖,并分泌多糖、多肽等细胞外基质,构成具有特殊微环境的细菌群落,从而形成生物被膜(Biofilm,Bf)[1-2]。细菌形成生物被膜后,其耐药性增强,易导致慢性感染反复发作。临床上80%的感染都和细菌生物被膜有关[3]。铜绿假单胞菌(Pseudomonasaeruginosa,PA)是临床感染中常见的革兰氏阴性条件致病菌,易引发呼吸系统及泌尿系统感染、败血症等疾病。亚胺培南西司他丁钠(Imipenem cilastatin sodium,IM/CI)属于β-内酰胺类抗生素,具有较强的抗菌活性及抗菌谱广,对铜绿假单胞菌浮游菌的抗菌效果较好,临床常用于铜绿假单胞菌感染的治疗。但该菌易形成生物被膜,且很难根除,往往对人类健康造成巨大的危害[4]。临床常规治疗铜绿假单胞菌感染的抗菌药物浓度常处于相对的亚抑菌浓度(Subminimal inhibitory concentration,Sub-MIC)水平,主要原因是药物进入生物被膜内并作用于其细菌的速度比浮游菌慢,因而到达生物被膜深层的浓度明显较低。有研究表明,Sub-MIC不足以杀死细菌,但可改变细菌代谢、细胞壁结构,从而影响细菌对细胞的吸附力以及增加细菌的耐药性。针对Sub-MIC抗菌药物对细菌生物被膜形成的影响,研究结果显示有抑制作用、诱导作用和无作用,呈多样性[5-7]。目前IM/CI对铜绿假单胞菌生物被膜形成的影响尚未完全阐明,因此,研究Sub-MIC IM/CI对铜绿假单胞菌生物被膜的影响具有重要临床意义。本研究拟以铜绿假单胞菌临床分离菌株(PA.12)为主要研究对象,探讨Sub-MIC下IM/CI对PA.12生物被膜形成的影响。
1 材料与方法
1.1 主要材料 铜绿假单胞菌临床分离菌株(PA.12)由遵义医科大学微生物学教研室保存;抗生素IM/CI购自美国Merck&Co公司;FITC标记刀豆球蛋白(FITC-ConA)购自美国Sigma公司;M-H培养基购自杭州微生物试剂有限公司;引物由上海生物工程有限公司合成;培养箱购自上海跃进医疗器械有限公司(型号:DHP-600);超速冷冻离心机购自美国BECKMAN COULTER公司(型号:Allegra X-30R);酶标仪购自美国BioTek公司(型号:Epoch);PCR仪、凝胶电泳成像仪均购自美国Bio-Rad公司(型号:S1000TMThermal Cycler、Gel Doc XR);激光共聚焦显微镜购自德国Leica公司(型号:TCS SP 2)。
1.2 方法
1.2.1 最低抑菌浓度的测定 按照美国临床和实验室标准化协会(CLSI)推荐的微量肉汤稀释法进行,IM/CI的MIC结果判断参照2015年CLSI标准[8]。
1.2.2 黏附力试验测定PA.12黏附能力 由1.2.1测出PA.12对IM/CI的MIC值。用LB肉汤将IM/CI倍比稀释至1/2、1/4、1/8、1/16 MIC浓度梯度,分别取200 μL加至96孔板中,每孔再加入用LB肉汤稀释成1×109CFU/mL的菌液4 μL,混匀。于37 ℃下以180 r/min培养过夜,弃菌液,PBS清洗2次,倒置风干固定。加入150 μL 0.25 g/L结晶紫染液,室温静置20 min,PBS清洗2次,倒置风干,加150 μL 95% 乙醇脱色10 min;酶标仪检测570 nm处吸光度值。
1.2.3 运动试验测定PA.12运动能力
1.2.3.1 游动性试验 无菌牙签接种PA.12至1/4 MIC IM/CI的0.3%琼脂LB平板中心表面,37 ℃培养16 h,观察细菌在平板上形成的生长圈并测量其直径。
1.2.3.2 群集运动试验 无菌牙签取PA.12穿刺接种于1/4 MIC IM/CI的0.6%琼脂LB平板中央,25 ℃ 培养16 h,观察细菌在平板上形成的生长圈并测量其直径。
1.2.4 结晶紫染色法及激光共聚焦显微镜(Confocal laser scanning microscope,CLSM)分析PA.12生物被膜形成情况 将PA.12接种在LB肉汤中过夜,比浊法将菌液稀释至1×109CFU/mL,取4 μL加入96孔板中,再加入200 μL 1/4 MIC IM/CI。37 ℃ 孵育72 h(每24 h更换培养液)后弃菌液,PBS清洗2次去除浮游菌,用0.25 g/L结晶紫进行染色,方法同1.2.2所述。同时取无菌盖破片置于6孔板板底,每孔加入2 mL稀释好的菌液,对照组不加药物,IM/CI 组加 1/4 MIC IM/CI,置37 ℃培养6 d,弃上清,用适量生理盐水轻轻冲洗去除浮游菌,再滴加FITC-ConA 20 μL避光孵育15 min,PBS清洗后用 90% 甘油封闭于洁净载玻片上。CLSM观察 1/4 MIC IM/CI 对生物被膜形成的影响。
1.2.5 RT-PCR检测PA.12生物被膜形成相关基因的转录水平 采用比浊法将菌液用LB肉汤稀释至1×109CFU/mL,取4 μL加入96孔板中,再加入200 μL 1/4 MIC IM/CI。37 ℃ 培养72 h(每24 h更换培养液)。收集菌液提取总RNA,逆转录后进行PCR扩增(扩增引物见表1),检测铜绿假单胞菌生物被膜形成相关基因algC、algD的表达,以管家基因ropD作为内参照。PCR扩增产物电泳后,凝胶成像仪观察,采用Image Lab软件系统进行分析。

表1 PCR引物序列

2 结果
2.1 Sub-MIC IM/CI 对PA.12黏附能力的影响 IM/CI对PA.12的MIC为1 μg/mL。微孔法检测结果显示:1/4 MIC和1/8 MIC IM/CI可显著增加PA.12的黏附能力,与无药对照组相比,具有统计学差异(P<0.05,见图1)。
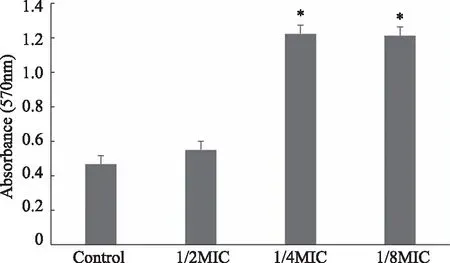
*:与Control组比较,P<0.05。
2.2 1/4 MIC IM/CI对PA.12运动能力的影响 与无药对照组相比,PA.12在1/4 MIC IM/CI的0.3%琼脂LB平板上形成的生长圈明显较大(P<0.05),说明1/4 MIC IM/CI能增强PA.12的游动性;在群集运动试验中,1/4 MIC IM/CI 组形成的细菌生长圈同样显著大于对照组(P<0.05),提示此亚抑菌浓度能增强PA.12的运动能力(见图2)。
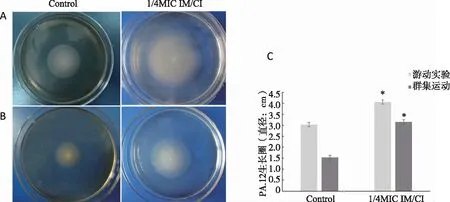
A:PA.12游动试验;B:PA.12群集运动试验;C:PA.12在LB平板上形成的生长圈;*:与Control组比较,P<0.05。
2.3 1/4 MIC IM/CI对PA.12生物被膜形成的影响 经FITC-ConA染色后,通过 CLSM 观察1/4 MIC IM/CI作用下 PA.12 生物被膜的形成能力。结果显示 1/4 MIC IM/CI 作用下细菌之间相互聚集,呈棉絮状。因FITC-ConA与PA分泌的胞外多糖结合呈绿色,故提示PA.12分泌的胞外基质增多,厚度增加,生物被膜形成增多;同时,结晶紫染色法也显示1/4 MIC IM/CI组吸光值显著高于无药对照组 (P<0.05);此结果表明1/4 MIC IM/CI能诱导PA.12生物被膜的形成(见图3)。

A:FITC-ConA染色CLSM观察PA.12生物被膜形成情况;B:结晶紫染色法测定PA.12生物被膜形成情况;*:与Control组比较,P<0.05;标尺=10 μm。
2.4 PA.12生物被膜形成相关基因algC和algD的转录 PA.12经1/4 MIC IM/CI作用72 h后,用单因素方差分析algC和algD的相对表达量。结果显示:1/4 MIC IM/CI组与无药对照组相比,1/4 MIC IM/CI组的藻酸盐合成基因algC和algD转录水平明显高于对照组 (P<0.05,见图4、5),提示1/4 MIC IM/CI能增强PA.12 生物被膜形成相关基因algC、algD的转录。

图4 PA.12生物被膜形成相关基因algC和algD PCR电泳检测结果
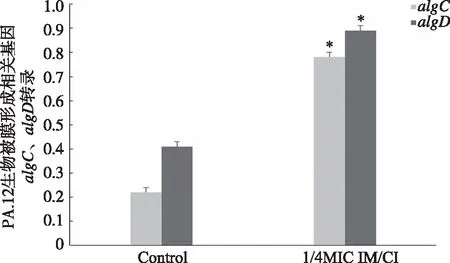
*:与Control组比较,P<0.05。
3 讨论
细菌生物被膜在自然界中广泛存在,几乎可以附着在任何有生命或无生命的物体表面,导致难以根除的慢性感染,是形成医院内难治性感染的重要原因之一。生物被膜的形成受多因素影响,鞭毛介导的细菌运动是其最基本的生物学行为。鞭毛会产生一种推动力,这种推动力是细菌在形成生物被膜过程中的一个重要因素[9-10]。在生物被膜形成的开始,细菌通过鞭毛的物理吸附,介导细菌之间、细菌与介质之间黏附,发生定植,进而发生感染。因此,细菌的黏附能力和运动能力是判断细菌生物被膜形成的重要指标。有研究证实鞭毛及细菌表面活性物质的合成、细菌的运动和生物被膜形成等是在群体感应(Quorum sensing,QS)系统的调控下完成的[11-12]。本研究结果显示1/4 MIC IM/CI、1/8 MIC IM/CI能提高PA.12的黏附能力,1/4 MIC IM/CI能增强PA.12运动能力,推测在此Sub-MIC条件下PA.12可能通过QS系统进行信号传递,调节其生物被膜的形成。通过CLSM观察到1/4 MIC IM/CI下生物被膜形成增多,提示可能在特定条件下Sub-MIC IM/CI能促进生物被膜形成。
有研究发现铜绿假单胞菌在生物被膜形成的过程中,菌体会合成并分泌大量的藻酸盐,形成细菌胞外聚合物,使得细菌免受外界有害物质损伤,并增强菌体与介质表面的粘附性,进而构成生物被膜结构[13]。algC和algD基因是铜绿假单胞菌藻酸盐合成的关键基因,这两个基因均在生物被膜形成的成熟阶段转录水平升高[14]。本研究结果显示1/4 MIC IM/CI可上调PA.12生物被膜形成相关基因algC和algD,促进其生物被膜的形成。
临床上80%的感染和细菌生物被膜有关,Sub-MIC抗菌药物在感染性治疗中可影响细菌生物被膜的形成,诱导细菌耐药性的产生。这给临床治疗带来了极大挑战。本研究结果提示:1/4 MIC IM/CI可诱导PA.12生物被膜形成,而生物被膜的形成可导致慢性感染的发生或者细菌耐药性的产生[15]。临床不规范的抗菌治疗,抗生素常处于Sub-MIC,这很可能增加细菌对宿主细胞的黏附而诱导生物被膜的形成,增强细菌的耐药性,造成难治性感染。因此,在临床治疗由铜绿假单胞菌引起的感染性疾病时,应充分考虑Sub-MIC MI/CI对细菌生物被膜的影响,足量用药。目前有研究发现大环内酯类、氟喹诺酮类抗菌药物对铜绿假单胞菌生物被膜的形成抑制效果较明显,且已在临床取得较好的治疗效果[16-17],故亦可针对性地选择抑制细菌生物被膜形成的抗菌类药物或联合用药,以降低细菌生物被膜形成,从而降低难治性感染的风险。本研究主要从细菌的黏附能力、运动能力、藻酸盐合成基因的转录等方面,体外研究了Sub-MIC MI/CI对铜绿假单胞菌生物被膜形成的影响,但对其产生机制尚不清楚,还有待进一步研究。
