SRSF6 在大鼠胰岛细胞中结合的靶标及测序分析
2022-08-30马艳荣罗蕴之马福慧周忠凯
马艳荣,罗蕴之,马福慧,周忠凯
糖尿病(diabetes mellitus,DM)作为一组代谢紊乱的疾病,其特征为长期的高血糖水平,以及逐渐导致血管并发症的发生和发展, 进而发生的死亡、失明、肾衰竭和生活质量全面下降[1]。胰岛细胞凋亡引发产生胰岛素的β 细胞进行性衰竭继而成为导致糖尿病发生的主要事件。 研究表明RNA 选择性剪接可能是胰岛β 细胞凋亡的机制之一,但具体作用机制不明。 SRSF6(SRp55)作为RNA 选择性剪接关键调控因子是否参与胰岛β 细胞凋亡,通过何种途径参与成为研究者关注的焦点。 Juan-Mateu 等[2]通过SRSF6 敲除实验的载体构建、 细胞因子的检测,凋亡相关因子的检测,转录组测序,证实SRSF6在大鼠胰腺β 细胞中的显著高表达,同时SRSF6 缺失会导致大鼠胰腺β 细胞凋亡的增加和胰岛素分泌减少。 但其具体的作用机制目前仍不清楚。 推测SRSF6 可能结合一些以前未知的在糖尿病发生发展中起重要作用基因的mRNA 前体,调控他们的蛋白质输出情况。 为此,本研究通过iRIP-seq 高通量测序技术在大鼠胰岛细胞中鉴定SRSF6 调控的基因及功能通路,对SRSF6 直接作用的靶标和调控通路及可变剪接事件进行鉴定。
1 材料与方法
1.1细胞培养 INS-1 细胞(Procell 生命科技有限公司,中国)在37℃、5% CO2、10%胎牛血清(FBS)、100 μg/ml 链霉素、100 U/ml 青霉素和50 μmol/L、β-巯基乙醇的RPMI 1640 培养液中培养。
1.2蛋白交联、 细胞裂解及RNA 片段化 INS-1细胞经400 mJ/cm2辐照1 次,使用预冷的细胞裂解进行裂解,加入200 U/mLRNA 酶抑制剂和1%蛋白抑制剂于冰上孵育30 min。 4°C 离心取上清, 加入RQ I(Promega,1 U/μl)至终浓度为1 U/μl,37℃水浴30 min。随后,加入stop solution 终止消解。在4℃下离心半径8.4 cm、 离心速度13 200 r/min 离心20 min, 以 去 除 细 胞 碎 片。 然 后 用MNase(Thermo Scientific)酶切RNA。
1.3免疫共沉淀 取出裂解液总体积的1%作为Input 对照组样本,细胞裂解液加入10 μg SRSF6 抗体进行免疫沉淀,使用IgG 抗体作为阴性对照,4 °C过夜孵育。加入protein A/G 磁珠孵育4°C 2 h,移除上清液后, 依次使用裂解液、 高盐buffer 和PNK buffer 漂洗磁珠各2 次, 使用Elution buffer 重悬磁珠,70℃,1 000 r/min,洗脱20 min 以释放磁珠结合的RBP 及其结合的RNA。 在Input 对照组样本和SRSF6 IP 样本中加入蛋白酶K,55℃消解2 h 以消解蛋白质,使用Trizol 提取RNA。
1.4iRIP-seq 文库的制备及序列分析 使用KAPA RNA Hyper Prep Kit(KAPA,KK8541)按照生产程序制备cDNA 文库。 按照制造商的说明制备文库, 并在Illunima HiSeq X Ten 系统进行150 bp 双端高通量测序。
1.5数据分析 通过TopHat 2 将序列比对到参考基因组上,并将唯一映射读段用于后续分析[3]。 采用“ABLIRC”策略,识别基因组中SRSF6 的结合区域[4]。 至少有1 bp 重叠的序列被聚为峰。 对于每个基因,用计算模拟生成与峰值读取相同数量和长度的读取。 输出的序列被进一步映射到相同的基因,以从重叠的序列产生随机最大峰值高度。 整个过程重复500 次。 选择所有观察到的峰高高于随机最大值(P<0.05)的峰。 对SRSF6 IP 组和Input 对照组分别进行模拟分析, 剔除了与Input 对照组有重叠的峰。 最终通过峰关联分析SRSF6 结合的靶基因,后者用HOMER 软件计算获得[5]。
1.6结合峰相关基因KEGG 通路富集分析 为了梳理峰相关基因(靶基因)的功能类别,利用KOBAS 2.0 对其GO(Gene Ontology)和KEGG 通路分析[6]。采用超几何检验和benjamini-hochberg FDR 控制程序确定各项的富集程度[7]。
1.7统计学处理 利用GraphPad Prism6.0 进行分析,其中定量数据以(±s)记录,采用t检验;定性数据则采用Mann-Whitney U 非参数检验, 以P<0.05 为差异有统计学差异意义。
2 结果
2.1SRSF6 的iRIP 实验 使用SRSF6 内源性的抗体,对大鼠胰岛细胞进行iRIP 实验,RIP 成功后,进行Western blot(WB)实验。 见图1。
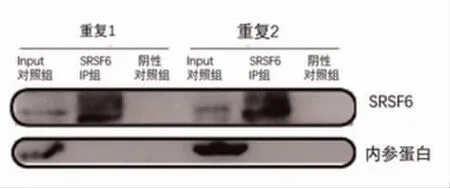
图1 WB 检测SRSF6 在大鼠胰岛细胞中的免疫共沉淀效率
2.2高通量测序 在illumina-Xten 平台进行高通量测序及数据基础分析, 通过对文库进行双端150bp 的测序, 获得的原始序列数据见表1。 使用TopHat2 软件, 比对到参考基因组的效测序数据见表2。在参考基因组上具有唯一定位的非冗余序列,并统计其在基因组各个分区情况,见表3。
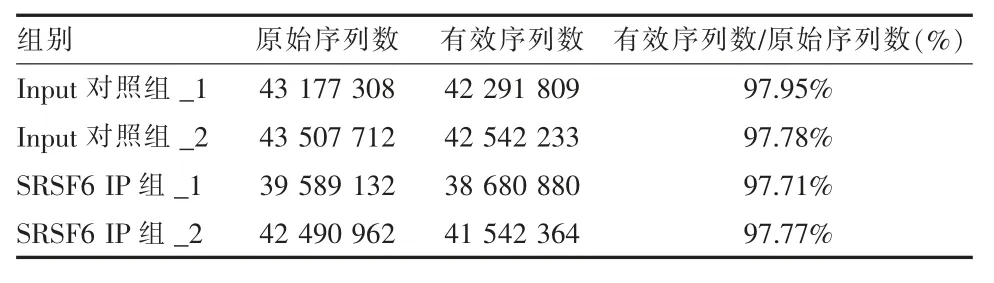
表1 SRSF6 iRIP-seq 原始序列数据统计

表2 SRSF6 iRIP-seq 有效序列数据比对统计(%)
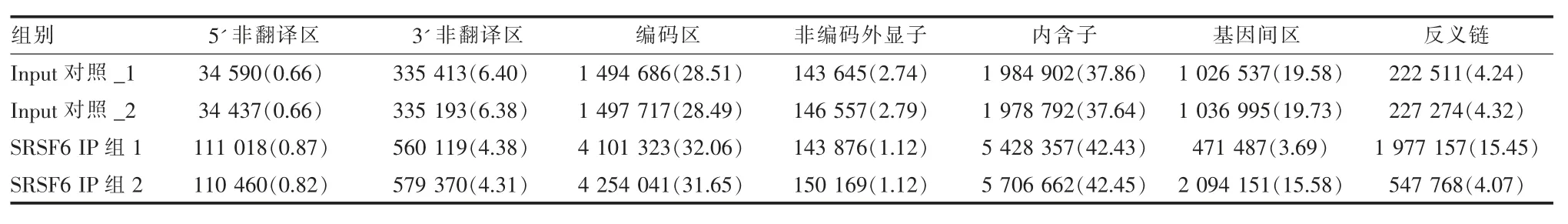
表3 SRSF6 iRIP-seq 序列在基因组不同区域上的分布及占比(%)
2.3数据高级分析 使用Piranha 软件,以Input 对照组样本为背景, 对SRSF6-Flag 实验样本的去除冗余序列进行结合峰寻找,2 次实验样本得到的峰值数分别为58 051 和525 458。 对实验样本峰值宽度分析发现,80%的峰值宽度在500 bp 左右。 而对基因功能区峰值分布统计发现,SRSF6 主要结合位点位于编码区和内含子区。为了确定与SRSF6 蛋白结合的RNA 参与的分子功能、 信号传导途径及生化代谢途径,进一步对峰值关联的基因用KEGG 分析显示:SRSF6 结合的mRNA 分子主要参与了细胞周期、RNA 转运、泛素介导的蛋白水解作用、内吞作用、内质网蛋白加工、磷脂酰肌醇信号系统、mRNA监测通路、胰岛素信号通路等功能。
3 讨论
近年来研究显示,RNA 选择性剪接可能是参与胰岛β 细胞障碍的机制之一。 选择性剪接通过单个基因可产生不同的mRNA 和蛋白质同种型,扩大了转录组的复杂性并增强了蛋白质多样性。 富含丝氨酸/精氨酸的RNA 结合蛋白(SR 蛋白)广泛存在β细胞中,已被证明在选择性剪接和构成性剪接中发挥作用,导致基因表达差异,并在mRNA 输出、基因组稳定、无义介导的衰退和翻译中发挥作用。 研究表明,无论是在1 型糖尿病还是2 型糖尿病,剪接改变可能会导致胰腺β 细胞凋亡[8]。并且,选择性剪接在β 细胞同一性、发育、功能和存活中是一重要的调控点[9]。
本研究在对胰岛细胞中的SRSF6 进行iRIPseq,发现SRSF6 可与RNA 结合,二者结合显著富集在编码区和内含子区域,提示SRSF6 可能具有调控mRNA 可变剪接的功能。 iRIP-seq 数据以及KEGG 分析发现,SRSF6 结合的RNA 分子参与了包括细胞周期、RNA 转运、泛素介导的蛋白水解作用、内吞作用、内质网蛋白加工、磷脂酰肌醇信号系统、mRNA 监测通路、胰岛素信号通路等功能活动。
SRSF6 既往被归类为原癌基因,因其过表达导致增生,增加细胞增殖和运动[10]。 其异常表达导致皮肤癌、肺癌、乳腺癌和结肠直肠癌。 大量研究表明,SRSF6 是一种受糖尿病易感基因GLIS3 调控的剪接因子,在维持人类β 细胞的功能和存活方面发挥着重要作用。 RNA 测序分析显示,SRSF6 调控细胞存活和死亡、胰岛素分泌和c-Jun n 端激酶(JNK)信号通路相关基因的剪接。特别是SRSF6 介导的剪接变化调节了促凋亡蛋白BIM 和BAX 的功能、JNK信号通路以及内质网应激, 这也解释了为什么SRSF6 耗尽会引发β 细胞凋亡[11]。 此外,SRSF6 耗尽抑制β 细胞线粒体功能, 导致胰岛素分泌减少。这些数据揭示了人类β 细胞功能和生存调控的新层面,即由关键剪接调控因子(如SRSF6)调控的替代剪接,它可能与糖尿病的候选基因交叉。 但需要更多的研究揭示SRSF6 在糖尿病发病中具体的作用机制。
本研究通过高通量测序手段寻找SRSF6 结合靶标,结果显示SRSF6 结合的基因和胰岛素信号通路相关, 表明SRSF6 具有新的调控功能,SRSF6 可能结合与糖尿病相关的关键通路相关的基因,及其相关蛋白质的翻译。本研究将为SRSF6 蛋白质的功能及机制研究提供新的研究方向。 然而,这些功能还未得到进一步验证,为了明确SRSF6 在糖尿病发生、发展中的具体作用,下一步将开展相关功能验证实验进一步验证以上结果。
