以金黄色葡萄球菌重组IsdB137-361 为抗原的牛血清抗体间接ELISA 检测方法建立
2022-08-29王欣刘硕马骏王然陈晶周玉龙朱战波崔玉东
王欣,刘硕,马骏,王然,陈晶,周玉龙,朱战波,崔玉东,
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江八一农垦大学生命科技学院)
奶牛乳腺炎是危害奶牛健康和妨碍奶业发展最为严重的奶牛疾病,金黄色葡萄球菌(Staphylococcus aureus,S.aureus)是引起该病最为常见的病原菌。以往防治金黄色葡萄球菌性奶牛乳腺炎主要依赖抗生素,但随着抗生素应用,S.aureus 菌耐药性不断增强,已产生了耐受青霉素类、大环内酯类以及万古霉素等多种类药物的耐药菌株[1-2]。目前,使用疫苗注射防治S.aureus 感染以及奶牛乳腺炎已成为公认的最为有效手段之一[3]。
S.aureus 在感染宿主过程中需要不断获取营养物质,微量元素铁便是所要获取的重要营养物质之一,铁也是在新陈代谢活动中的电子转移载体[4]。在S.aureus 表面存在着由多蛋白构成的铁摄入系统,铁调节的表面决定簇B(iron-regulated surface determinant B,IsdB)便是该系统成员之一。IsdB 是带有细胞壁锚定基序LPXTG 的蛋白[5],在S.aureus 感染部位,随着氧化还原电位改变和pH 变化,铁离子就会变成氧化态,从而有利于铁的转化利用,为入侵的葡萄球菌提供营养物质[6]。Kuklin 等[7]最先用小鼠模型和恒河猴研究证明了重组IsdB 能够诱导产生良好的免疫应答和明显的抗感染免疫保护作用。王宁等[8]将IsdB 蛋白分成3 段,通过小鼠免疫接种研究证明,其中的IsdB137-361片段所诱导的免疫应答能力和免疫保护作用等同于IsdB 全蛋白,并将其与S.aureus 的RNAⅢ活化蛋白的靶蛋白(TRAP)串联,增强了串联蛋白的免疫原性。此后又进一步与链球菌GapC 的免疫优势片段构建成融合蛋白并命名为GIT,通过小鼠试验研究证实,GIT 可有效预防S.aureus 和链球菌感染[9],已成为预防奶牛乳腺炎有效的候选疫苗抗原。目前,正在开展GIT 牛体免疫接种试验,但缺少免疫接种后实验牛血清抗体检测和评价方法。
酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)是临床血清抗体检测常用手段,具有特异、灵敏、简便、快速、适于定量和大规模检测等优点。研究拟以IsdB137-361作为抗原,建立IsdB137-361相关抗原免疫牛血清抗体间接ELISA 检测方法,为GIT候选疫苗的奶牛临床试验抗体检测提供技术支持。
1 材料方法
1.1 材料
1.1.1 菌株、血清及质粒
S.aureus Wood46 菌株、大肠杆菌工程菌株BL21(DE3)、携带重组IsdB 质粒的BL21(DE3)菌株、pET32a 质粒、pGEX-6p-1 质粒、无乳链球菌HLJ57免疫血清、S.aureus 重组IsdB 及Trap 免疫血清、含IsdB137-361的GIT 融合蛋白免疫血清由实验室制备保存;牛布氏杆菌病阳性血清、大肠杆菌腹泻牛血清以及选取来自鸡西、北安、林甸、内蒙古、虎林的成年奶牛的待检牛血清样本均由我校兽医传染病实验室提供。
1.1.2 试剂
蛋白分子量标记物购自于Thermo 公司;His 蛋白纯化树脂柱、GST 蛋白纯化树脂柱从PointBio 公司购入;硝酸纤维膜、TMB 显色液、牛血清白蛋白(BSA)从索莱宝科技公司购入;鼠源抗GST 抗体从Proteintech 公司购入、鼠源抗His 抗体、HRP 羊抗鼠IgG、HRP 兔抗牛IgG 从Bioss 生物公司购入。
1.2 方法
1.2.1 重组IsdB137-361表达与纯化
从携带重组IsdB 质粒的BL21(DE3)菌株中提取质粒作为PCR 模板,按照王宁[8]设计的上、下游引物PCR 扩增S.aureus IsdB137-361的基因片段,并将扩增产物分别连接到pET32a 和pGEX-6P-1 上(分别记作pET32a-IsdB137-361和pGEX-6P-1-IsdB137-361),转入BL21(DE3)中,经鉴定正确后,于37 ℃条件下以0.1 mM 的IPTG 诱导表达3~4 h 后收集菌体,用SDS聚丙烯凝胶电泳分析表达情况。同时,对电泳后凝胶进行转膜,分别以抗His 抗体和抗GST 抗体作一抗进行蛋白质印记实验鉴定。将pET32a 表达IsdB137-361(简称eIsdB137-361)及其pET32a 标签蛋白的菌体裂解物用His 树脂柱纯化,将pGEX-6p-1 表达IsdB137-361(简称gIsdB137-361)的菌体裂解物用GST 树脂柱纯化。eIsdB137-361和pET32a 标签蛋白用于制备牛免血清;gIsdB137-361和GST 标签蛋白用作试验检测抗原。
1.2.2 免疫血清制取
将纯化的eIsdB137-361、pET32a 标签蛋白和培养3~4 h、经福尔马林灭活的S.aureus Wood46 菌体分别以1∶1 体积比与弗氏佐剂乳化,选取健康的12 月龄左右的Holstein 牛进行颈部肌肉接种,第一次免疫蛋白抗原与全菌体分别于弗氏完全佐剂进行混合,蛋白抗原接种剂量为1.5 mg·头-1、全菌体抗原接种剂量为3×1010cfu·头-1。3 周后以同样剂量与弗氏不完全佐剂进行第二次免疫接种。同时以PBS 与佐剂乳化作为对照。第二次免疫接种后10~14 d 采血制取血清。
1.2.3 间接ELISA 工作条件优化
按照参考文献[10]介绍的方法进行间接ELISA操作和工作条件优化,即对包被抗原浓度、血清稀释度、包被液选择、包被时间和温度、封闭液种类、封闭时间和温度以及血清(一抗)孵育时间等条件进行优化。最初试验操作程序为,用pH 9.6 的碳酸盐缓冲液作包被液稀释抗原后,在4 ℃条件下包被12 h;用PBST(含体积比0.05% Tween-20 的pH7.2 的PBS)溶液洗涤5 次后,用5%脱脂奶于37 ℃封闭2 h,再用PBST 洗涤后加入血清,于37 ℃孵育1 h,用PBST 洗涤后加入1∶8 000 稀释的二抗,于37 ℃孵育1 h 后,用PBST 溶液洗涤,加入TMB 显色液,置黑暗条件下10 min 后,加入2M H2SO4将反应终止,立即检测OD450 数值。将OD450 阳性值与阴性值比(P/N)大于2.1 以上且比值最大者判定为ELISA 最佳反应条件。
(1)包被液及包被条件优化
选取pH 8.6 的Tris 盐缓冲液、pH 9.6 的碳酸盐缓冲液、pH 6.0 的柠檬酸盐缓冲液、pH 7.4 的磷酸盐缓冲液(PBS)、pH 7.2 的PBS 和pH 7.0 的水作为抗原包被液进行优化,然后用优化后的被液包被抗原,分 别 于37 ℃2 h、37 ℃1 h、37 ℃45 min、37 ℃30 min、4 ℃过夜、4 ℃过夜加37 ℃1 h 的反应条件进行优化。
(2)封闭液及封闭条件优化
使用优化后的包被液和包被条件完成抗原包被后,再选取5%脱脂奶、1%牛血清白蛋白(BSA)、5%胎牛血清(FCS)、1%BSA+5%蔗糖和1%明胶作为封闭液进行优化,再使用优化后的封闭液封闭,分别于37 ℃3 h、37 ℃2 h、37 ℃1 h、37 ℃30 min、37 ℃15 min 的封闭条件进行优化。
(3)血清孵育条件优化
按照优化后的包被液和包被条件包被抗原,再以优化后的封闭液和封闭条件进行封闭,然后加入血清,分别以37 ℃温度下2、1 h、30、15、5 min 为血清孵育时间进行孵育条件优化。
1.2.4 Cut-off 值确定
用26 头阴性对照牛血清和20 头GIT 免疫牛血清,采用优化的间接ELISA 条件进行检测,以测得的OD450 值求出平均值、标准差(SD)。用SPSS 软件对血清OD450 值正态分布和做ROC 曲线分析,根据分析结果和约登指数合理确定cut-off 值[11]。
1.2.5 特异性与敏感性确定
用优化后的反应条件分别对eIsdB137-361、GIT、pET32a 标签蛋白、Trap 和链球菌GapC 蛋白免疫牛血清,灭活的金葡菌Wood46 株、无乳链球菌HLJ57株免疫牛血清以及临床采集的大肠杆菌腹泻牛血清、牛布氏杆菌阳性血清等进行间接ELISA 检测,根据确定的cut-off 值判和评价其特异性。
分别将阴、阳性血清进行倍比稀释,并以PBS 为空白对照组。以P/N>2.1 的最大稀释倍数来判定方法的敏感性[12];以OD450 值小于cut-off 值的稀释倍数为最低检测水平[13]。
1.2.6 稳定性检测
用同一批gIsdB137-361抗原在不同的3 个时间测定6 份不同血清OD450 值。每个血清样本重复不少于8 次,根据变异系数来确定该方法的批内稳定性;用不同批次的gIsdB137-361抗原包被不同批次酶标板,检测6 份不同血清的OD450 值,每个血清样本重复不少于8 次,根据变异系数确定方法的批间稳定性。
1.2.7 临床样品检测
用该间接ELISA 方法对来自于5 个不同牛场的84 份待检牛血清样本进行检测。
2 结果与分析
2.1 重组IsdB137-361 表达及纯化结果
含pET32a-IsdB137-361和pGEX-6P-1-IsdB137-361质粒的BL21(DE3)分别诱导表达后,经SDS-PAGE电泳后可见,重组蛋白eIsdB137-361和gIsdB137-361分别在47 KD、52 KD 处出现蛋白质条带,用抗His 或GST 标签蛋白抗体进行western-blot 验证,两个重组蛋白均与相应抗体发生特异性反应,说明均正确表达,并能获得理想纯化(详见图1)。

图1 重组蛋白IsdB137-361 表达及纯化Fig.1 Expression and purification of the recombinant IsdB137-361
2.2 包被抗原浓度及血清稀释度优化结果
为确定最适抗原包被浓度和血清稀释倍数,将抗原gIsdB137-361稀释成5、2.5、1.25、0.625 μg·mL-1,阴性、阳性血清分别稀释成1∶500、1∶1 000、1∶2 000、1∶4 000后,采用方阵法进行间接ELISA 检测。结果显示,抗原浓度为2.5 μg·mL-1、血清做1∶1 000 稀释时,P/N值最大(见表1)。

表1 包被抗原浓度与血清稀释度优化(P/N 值)Table 1 Optimization of coated antigen concentration and serum dilution(P/N)
2.3 反应条件优化结果
2.3.1 包被液及包被条件优化
经间接ELISA 对6 种包被液进行优化后,结果以pH 9.6 的碳酸盐缓冲液的P/N 值最大(见图2);对包被条件优化后,以4 ℃条件下12 h 的P/N 值最大(见图3)。

图2 包被液优化结果Fig.2 Optimization results of coating solution

图3 包被条件优化结果Fig.3 Optimization results of coating condition
2.3.2 封闭液及封闭条件优化
在确定好包被液和包被条件后,继续通过间接ELISA 对5 种封闭液和封闭条件进行优化。结果显示,封闭液以5% 脱脂乳(PBST)的P/N 值最大(见图4);封闭条件以37 ℃条件下30 min 的P/N 值最大(见图5)。

图4 封闭液优化结果Fig.4 Optimization results of blocking solution

图5 封闭条件优化结果Fig.5 Optimization results of blocking condition
2.3.3 血清孵育条件的优化
在确定好包被液和包被条件、封闭液和封闭条件后,继续对血清孵育条件进行优化。结果显示,血清孵育条件以37 ℃孵育15 min 时P/N 值最大,结果如图6。

图6 血清孵育条件优化结果Fig.6 Optimization result of serum incubation condition
2.4 Cut-off 值
通过对20 份免疫牛血清和26 份阴性对照牛血清做间接ELISA 检测,并根据测得的OD450 值求出平均数和标准差。用SPSS 软件对血清OD450 值进行
正态分布分析和ROC 曲线分析,阳性血清与阴性血清检测OD450 值分布无重叠(见图7),进一步计算

图7 GIT 免疫牛血清的间接ELISA 反应性Fig.7 Reactivity of sera from GIT-immunized bovine in the indirect ELISA
“约登指数”显示,cut-off 值的取值范围在0.329~0.629 之间时,特异性96.2%~100%,敏感性均为100%。而阴性血清OD450 值的平均值为0.15,取3
倍阴性血清的平均值作为cut-off 值,此时cut-off 值
为0.45。
2.5 间接ELISA 的特异性与敏感性
用该间接ELISA 检测方法对不同抗原蛋白或灭活全菌体免疫血清以及临床采集的病牛阳性血清进行检测。结果显示,使用的抗原除了与eIsdB137-361蛋白免疫牛血清和GIT 免疫牛血清呈阳性反应外,其他血清均呈阴性反应,抗原未见交叉反应性(详见图8)。

图8 抗原与其它牛血清的交叉反应性Fig.8 Cross reactivity of the antigen with other bovine serum by ELISA
分别对阳性和阴性血清做倍比稀释后进行间接ELISA 检测,阳性血清稀释至1∶8 000 时,其OD450值的P/N>2.1,敏感度为1∶8 000;最低可检测血清稀释度1∶16 000。而当阴性血清稀释至1∶500 时,OD450 值已经低于cut-off 值,也说明了cut-off 值比较合理(见图9)。
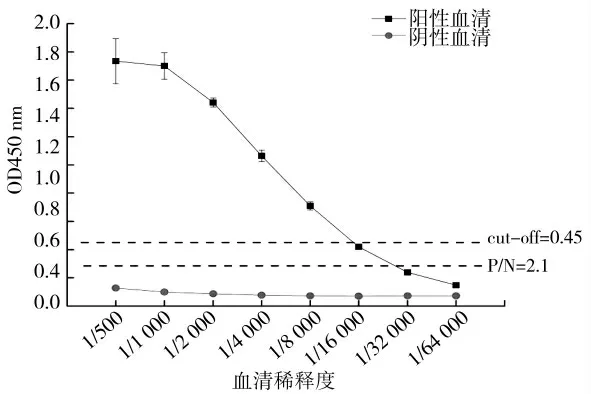
图9 间接ELISA 的最低检测限度确定Fig.9 The minimum detection limit determination of the indirect ELISA
2.6 间接ELISA 的稳定性结果
同一批制备的抗原和试剂在不同时间重复检测,所得到的OD450 值变化范围在4.3%~9.7%之间。用不同批次制备的抗原和试剂进行重复性检测,所得到的OD450 值变化范围在3.3%~9.2%之间。即批内和批间变异系数均小于10%,说明该ELISA 法稳定。
2.7 牛临床血清样本检测结果
对临床收集的84 份待检牛血清用该间接ELISA方法检测,阳性检出率为28.74%。5 个不同牛场的具体结果详见表2。

表2 临床样本检测结果Table 2 The results of detection for clinical bovine serum samples by the indirect ELISA
3 讨论
ELISA 被广泛地用于医学诊断工具和生物医学研究的分析工具,检测和定量特异性抗原或样本中的抗体,也被用作各种工业质量控制[14]。间接ELISA是将特异性抗原粘附到微量酶标板孔壁上,然后用非反应性蛋白封闭没有被抗原包被上部分,然后有特异性的一抗与抗原发生特异性反应,再由酶标记的二抗反应,以酶底物显色,显色程度与抗体浓度相关,方法可用于大批量定量检测。在前期的奶牛乳房炎主要病原菌疫苗研究中,已经将含有S.aureus IsdB137-361的融合蛋白GIT 制备成候选疫苗,目前正在开展奶牛临床免疫接种试验,为了满足对疫苗免疫后的IsdB137-361抗体检测,开展了研究工作。研究结果初步显示,所建立的间接ELISA 方法检测IsdB137-361相关抗原免疫牛血清抗体表现出了较好的特异性和敏感性。但由于目前缺少可照的商业化或成型的该抗原检测方法[15-16],研究所建立的间接ELISA 方法还需在后续的研究和应用过程中进一步完善。
前期候选疫苗构建时使用了pET32a 表达GIT,在建立该间接ELISA 检测方法时又用pET32a 表达的IsdB137-361作为抗原免疫接种牛制备了阳性血清。为了避免检测抗原与pET32a 的标签蛋白发生交叉反应,选用了pGEX-6p-1 载体表达的IsdB137-361,即gIsdB137-361作为检测抗原。试验研究显示,gIsdB137-361作为抗原检测pET32a 标签蛋白免疫血清为阴性,而检测eIsdB137-361免疫血清和GIT 免疫血清均呈阳性,说明较好地避免了与表达载体的标签蛋白发生交叉反应;但检测灭活金黄色葡萄球菌Wood46 免疫血清的结果也是阴性,这可能与IsdB 在细菌中的表达量占菌体全蛋白量过低而没有诱导明显抗体产生的原故。由于试验中缺少确切的金黄色葡萄球菌感染牛血清,未能证实该方法是否可用于金黄色葡萄球菌感染牛血清检测,但可在后续GIT 免疫攻毒试验中获得金黄色葡萄球菌感染牛血清后加以验证。
用建立的间接ELISA 方法对临床收集的84 份待检牛血清样本进行了检测,有25 份血清呈阳性。但对于这些血清样本来源的奶牛情况如年龄、是否怀孕、是否有过感染等无法了解,进而也无法查清这些阳性结果的原因[16-17]。在今后开展研究过程中,应该对待检血清来源的牛进行严格健康调查、在实验各个环节都做到确实可靠,或者建立探讨其他检测方法进行比较检测,确保所建立的间接ELISA 检测方法在实践应用中达到理想效果。
