应用培养组学分离鉴定牛源芽孢杆菌及其系统发育性分析
2022-08-29王浩先陈宇马宁黄培鑫张晓轩倪宏波
王浩先,陈宇,马宁,黄培鑫,张晓轩,倪宏波
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.吉林农业大学动物科学技术学院;3.青岛农业大学)
消化道作为奶牛等动物重要的组织系统,由口腔、咽、食道、胃、小肠、大肠等部组成。其中肠道作为动物最终的营养物质吸收代谢转化的场所,其内部生存着数量庞大、种类组成多样的各类微生物,其主要由细菌、原虫、真菌等三大类微生物构成,并形成一个相对稳定的微态系统[1-2]。胃肠道微生物的多种多样性是其主要消化功能实现的现实基础,其发挥重要作用主要针对宿主的免疫、生理和营养功能等方面。胃肠道微生物的总量是数10 倍于其本源动物本身细胞数,正常的情形下有多种多样的菌群数量1010~1011存在于每毫升的瘤胃(液)内容物中。瘤胃中还包含着105~106个的原虫、少数噬菌体和厌氧真菌或其产生的游离孢子数为103~105[3]。草食类反刍动物以奶牛为代表同时与我们生活密不可分,其自身将植物纤维通过瘤胃等胃肠道的营养吸收转化等作用将其转化为易于人类吸收的牛奶[4]。研究表明,奶牛胃肠微生物的研究已成为生物学研究的一个重要课题。近年来,依靠16S rRNA/18S rRNA /ITS 测序技术发现了一些传统培养法研究未发现的新种类,促进了对复杂微生态系统的认识。目前牛瘤胃中已鉴定出410 余种细菌,真菌方面,目前已从牛瘤胃中鉴定出来6 个属16 个种类;但对奶牛肠道细菌研究较少,尤其是具有潜在功能作用的芽孢杆菌[5]。
就目前社会经济的高速发展以及实验技术不断的进步,结合高通量测序技术与传统培养技术手段对养殖经济动物(如:猪、肉牛、奶牛、山羊、禽等)的消化道内微生物群落构成的多样性研究、优势菌群的了解、功能菌群的分离和其内功能基因的挖掘等一系列研究已成为一种新的趋势,并在该方向取得了一定进展[6]。消化道微生物群落生存在宿主的消化道生态内环境中,同时帮助宿主实现多种消化道内的生理生化功能,它们与宿主机体相互作用,互利共生,形成了一个紧密联系的整体,共同抵御外界不良环境[7]。肠道菌群不只承担着对食物消化吸收的作用,还在很多方面影响动物机体的健康。大量的研究数据积累表明,肠道菌群对动物机体的免疫有着重要的调控作用。在近期的一项研究中,Steed 等[8-9]又有了一项惊人发现,即肠道微生物能够将食物中的黄酮类化合物代谢成脱氨基酪氨酸(DAT),借此来加强I 型干扰素(IFN)信号并减轻肺部病变,除此之外DAT 能够引发I 型IFN 的信号通路,刺激一系列下游基因表达,以此来加强和调节免疫细胞的功能,防治流感。另外,肠道微生物在中枢神经和脑功能以及营养和代谢中都起着重要的调控作用。
随着对消化道微生物群落研究角度的加深,对犊牛和后备牛消化道微生物区系的研究至关重要,这不但会对犊牛的监管与营养配比提供数据支持,也会为后备牛的快速成长提供合理的帮助。为此,分子生物学技术的快速发展和合理应用可为其提供技术上的支持与保障[10]。传统的消化道生态系统中微生物群落多样性及结构分析主要通过分离培养、计数和分类鉴定,然后通过一般的生物化学性状或者特定的表现型来分析。微生物的分离培养可以充实胃肠道微生物菌种资源,用于研究微生物生理功能与代谢,尤其参与日粮营养物质降解代谢。相关菌种(如:乳酸杆菌、芽孢杆菌等)可能应用于奶牛等传统饲养动物的微生态制剂领域研究开发;奶牛机体疾病的防控调节和胃肠道疾病的生物防控领域以及奶牛的免疫机制调节方向。并为畜牧业的发展带来一片新的蓝海,具有广阔的应用前景[11]。
实验基于培养组学手段,使用选择培养筛菌、纯化、特异性引物PCR 检测、生物信息同源性比对等实验手段对奶牛肠道芽孢杆菌属菌种进行分离与鉴定,最终成功分离鉴定出:蜡样芽孢杆菌、沙福芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌、海洋沉积物芽孢杆菌和高山芽孢杆菌在内的共计6 种14 株芽孢杆菌属菌株,为日后对奶牛胃肠道功能菌的鉴别分析及日后的研究提供实验基础。
1 材料与方法
1.1 材料
1.1.1 样品采集
样品采集于2020 年7 月中旬,采集地点黑龙江省绥化市青冈县某规模化奶牛养殖场。实验选取了6 只健康荷斯坦奶牛(平均产奶量在56.5 kg·d-1左右),该场均采用相同的规模化饲养管理,采用全混合日粮饲喂,定点饲喂(每日的6 时和17 时进行等量饲喂),饲料剩余比例5%左右,栓式饲喂,自由饮水。
1.1.2 部分仪器
表1 部分仪器设备Table 1 Part of the equipment
1.1.3 主要试剂及引物序列
选择性培养基(青岛海博生物公司),血液细菌培养瓶(山东鑫科生物科技有限公司),无菌脱纤维绵羊血,刃天青钠,牛黄胆盐,无机盐,碳源、氮源,VK1,氯化血红,50×TAE,EB 显色液,革兰氏染色液等均购自于(北京索莱宝生物有限公司);RR902AEx Taq Master Mix,Marker 等均购自于(Takara 宝日生物公司)。
引物合成由上海生工生物公司完成,引物序列如下:
上游引物1510 R:5'-ACTGGATCCCACTTGGATTGCAAACCTGAATTCTCG-3';下游引物7 F:5'-ATCGAAGCTTCCCTAAGGCCTTCTGTTCTGATAGAC-3'。
1.2 方法
1.2.1 样品的采集
采集过程中首先将双手带好无菌直肠检测手套,伸入6 只健康荷斯坦奶牛直肠采集新鲜粪便,将采集粪便灌注于无菌采样袋,并立即封闭采样袋,装入无菌厌氧袋中,编号整理,整个样品采集过程均为无菌操作。样品于低温采样箱运输回实验室进行样品稀释等预处理操作并进行细菌的分离培养。
1.2.2 样品的处理及培养基的配置
准备工作:实验开始前,将所有需要的器材进行高压灭菌操作,实验室进行紫外照射杀菌,试验仪器(生物安全柜、厌氧工作站等)在用擦拭干净后,开启紫外灯照射。因芽孢杆菌产生芽孢,为避免交传染,故需要单独场地。同时提前配置好所需培养基,添加0.1%牛黄胆盐,灭菌后,50 ℃,青岛培养基平板,待室温凝固后,倒放至37 ℃电热恒温箱,质控,防止环境中杂菌污染,影响后续实验操作。(注:营养液为经过无菌0.22 μm 的针头滤器过滤的无菌瘤胃液,待到倾倒平板时缓慢滴入,滴入量为5%)。
(1)提前72 h 将所需的无菌瘤胃液过滤完成,与采集的脱纤维绵羊血一并进行前期质控,防止污染,影响后期实验。如出现污染情况,应立即更换原试剂,并及时消毒杀菌。重新采集脱纤维绵羊血,重新过滤得到无菌瘤胃液,并再次进行平板划线检验,并对所处环境,所使用设备及时消毒灭菌清理,防止污染。
(2)实验所需培养基共六种(分别为:AB+E、CB+E、CBB+E、LBB+E、YC+E、BS+E 培养基),+E 为0.1%的牛黄胆盐,琼脂粉添加量为1.5%。
(3)样品洗脱用品:酒精棉,镊子,玻璃棒,70%酒精,一次性培养皿,2.0 mL 离心管,三种量程的移液枪及枪头,高压灭菌后的500 mL 生理盐水,玻璃涂板器,剪刀,50 mL 离心管及管架。(以上物品务必消毒后使用)。
(4)用镊子夹取部分样品分到两个灭菌后的培养皿中,(同时需要将原始的粪便样品标号后分装入冻存管进行-80 ℃保存。)一个加入70%酒精进行洗脱,标上E(加入酒精是为了杀死细菌菌体,留下芽孢),另一个加入厌氧液体培养基标(AB)。都进行搅拌混匀。E 放置4 h 后进行处理。
1.2.3 菌种/基因型的鉴定
对应试管在3 个1.5 mL EP 管标号,(两个写在侧面。1 个写在盖上,以防后期煮沸时字体脱落)。摇晃试管,使菌体与培养液混匀。(以下环节务必注意灭菌操作)PCR 检测及测序:吸取菌液500 μL(尽量吸取菌丝)注入到一个EP 管中(标号在盖上的),12 000 r,10 min,弃上清,加入1 mL 无菌水,用封口膜封上(以防煮沸时盖子打开)。电磁炉100 ℃水域煮6 min。取0.3~0.5 μL 进行PCR。
(1)PCR 温度设置:98 ℃,5 min。98 ℃,30 s;53 ℃,30 s;72 ℃,1 min 40 s;35 个扩增循环。72 ℃,10 min。4 ℃保存。PCR 反应前,先将PCR 管内溶液混匀,在瞬离机上瞬离,然后置于PCR 仪上,按16S rRNA 基因扩增PCR 反应程序(表2)进行反应。

表2 16S rRNA 基因扩增PCR 反应程序Table 2 16S rRNA gene amplification PCR reaction procedure
(2)PCR 扩增体系为50 μL,体系样品组成如下:Ex Taq Max25 μL,模板0.5 μL,上游引物1 μL,下游引物1 μL,水22.5 μL,阴性对照中,将模板替换为无菌水。(每次务必有阴性对照)
(3)对PCR 产物进行1%琼脂糖凝胶电泳检测。1/4/板,11 孔,0.2 g 琼脂糖+20 mL 1×TAE,加热溶解后室温放置至60 ℃左右,加入1 μL EB,混匀后对光检查液体内EB 是否全部溶解,倒入模具。待琼脂糖凝胶凝固成型后胶孔加注样品;1/2 板,25 孔,0.4 g琼脂糖+40 mL 1×TAE,加入2 μL EB,待琼脂糖凝胶凝固成型后胶孔加注样品。
(4)将第一次为显示为阴性的样本重复第一遍操作进行PCR 扩增体系混样处理,此时样品的模板量增加到3 μL。
(5)对电泳检测条带正确的PCR 产物送测序。
1.2.4 菌种的形态学鉴定
应用革兰氏染色技术,挑取纯化后的细菌菌液于在载玻片上,涂匀,火焰固定,参照说明书滴加革兰氏染色试剂,待染色完毕后风干,滴加香柏油,调节光学显微镜相应合适视野,观察菌体及芽孢形态,通过对细菌的形态学观察,初步判断其是否为芽孢杆菌,是否有杂菌污染。
1.2.5 菌种的保存
(1)对比16S rRNA 序列完全测通序列与NCBI上利用BLAST 软件与Gen Bank 中公布已知序列对比结果挑选需要保存的纯化菌株,进冻干保存。
(2)冻干保护剂制备:脱脂奶粉20%+蔗糖10%+甘油1.5%+超纯水68%搅拌混匀无结块状,置于高压蒸汽灭菌锅中115 ℃,15 min,灭菌备用。
(3)菌液与冻干保护剂1∶1 混合,搅拌均匀,无结块。
(4)-20 ℃~-80 ℃预冻12 h,置于冻干机中进行复冻,完成菌种保存。
2 结果与分析
2.1 培养结果及染色镜检
将6 个样品进行70%酒精预处理4 h,将处理后的样品稀释涂板,接种培养基平板均加入0.1% 胆盐,37 ℃培养24~36 h。经筛选后采用划线法纯化培养,共得到胆盐耐受菌株14 株,以供后续实验操作。如图1 所示,菌落上面出现菌膜,逐渐凹陷形成圆形小环,边缘不整齐。如图2 所示,在细菌不同生长时期染色结果,产生的芽孢形态为短小,两端圆润,在菌体中间或游离于菌体外,普通染色剂无法染色(2-A,部分分离纯化芽孢杆菌产芽孢状态;2-B,部分分离纯化芽孢杆菌菌体状态)。

图1 部分芽孢杆菌培养照片Fig.1 Part of the photos of Bacillus culture

图2 部分芽孢杆菌革兰氏染色镜检影像Fig.2 Partial Gram stained microscopic images of Bacillus
2.2 PCR 鉴定结果
通过提取细菌DNA 为PCR 模板,阴性对照模板为无菌水,应用16S 通用引物1510R 和7F 进行PCR扩增得到目的片段约为1 700 bp,阴性对照无扩增目的条带,其部分结果如图3。

图3 部分细菌扩增16S rRNA 结果Fig.3 Amplification of 16S rRNA by Bacteria
2.3 菌株同源性分析
将分离菌株经过1%的琼脂糖凝胶电泳检测后得到检测样品的目的片段为1 700 bp 的条带,符合16S rRNA 条带长度,送往通用生物系统(安徽)有限公司进行菌株测序鉴定。使用BLAST 软件将测序结果序列与NCBI 上Gen Bank 中公布的株芽孢杆菌参考株基因序列进行同源性对比分析,同源性为99.93%~100%。同时,为了更深入的了解并解释14株菌株(L1-L14)的亲源关系,基于MEGA-X 软件采用最大似然法原理进行系统发育树分析,在Gen Bank 中选取了蜡样芽胞杆菌(Bacillus cereus)、海洋沉积物芽孢杆菌(Bacillus oceanisediminis)、地衣芽孢杆菌(Bacillus licheniformis)、高山芽孢杆菌?(Bacillus?altitudinis)、同温层芽孢杆菌(Bacillus stratosphericus)、沙福芽孢杆菌(Bacillus safensis)以及短小芽孢杆菌(Bacillus pumilus)的基因序列进行比对,并建立系统进化树(图4),并对分离菌株与参考菌株序列绘制了同源性表格图与同源性热图,更直观的展示分离的14 株菌株(L1~L14)的亲源关系(图5,同源性表格图;图6,同源性热图)。最终确认L1、L2 为蜡样芽胞杆菌;L3、L4 为沙福芽孢杆菌;L6,L7 为短小芽孢杆菌;L5 为海洋沉积物芽孢杆菌;L8、L9、L10、L11、L12 为地衣芽孢杆菌;L13 为高山芽孢杆菌;L14 为同温层芽孢杆菌,且14 株分离菌株与参考菌株序列同源性均为99.9%~100%,因此可以确定实验中分离菌株结果成立。
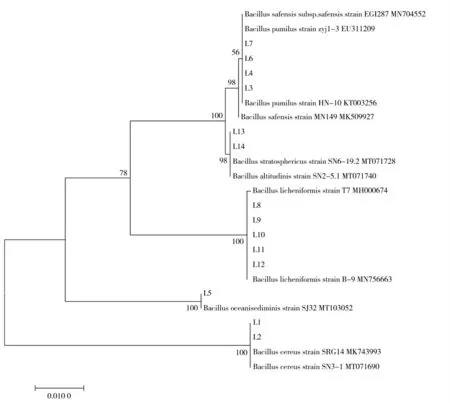
图4 分离的菌种H1-H14 进化树同源性比对Fig.4 Homology comparison of evolutionary trees of isolated strains L1-L14

图5 采用BLAST 软件与Gen Bank 中公布的参考菌株进行同源性对比分析结果Fig.5 Homology comparison between BLAST software and reference strains published in Gen Bank

图6 参考菌株与分离菌株同源性热图Fig.6 Homology heat map of reference strain and isolated strain
3 讨论
作为益生菌/功能菌代表菌属之一的芽孢杆菌,无论是畜牧行业或是医疗或食品行业都离不开他的身影。作为活菌制剂的代表之一,其无论是对动物或植物,效果都非常有效。一方面因其自身还生理功能的耐高温、耐高压、耐胆盐、产芽孢等特殊的生理特性,使其能在作为耐受菌进入宿主消化道内不被分解的同时可以继续繁衍定植,并分解生产营养物质,促进宿主代谢水平,产生有机酸,降低调节消化道PH 水平的同时也能消除抑制有害菌生长,即使进入极端环境,仍能以芽孢形态存活[12];同时,它也因其自身性质帮助宿主提高自身机体免疫力,促进宿主肠道消化,使宿主能耗的吸收消化以蛋白质为代表的营养物质。此外,芽孢杆菌还能产生多种维生素,为动物提供丰富的营养物质。因此,芽孢杆菌添加到饲料中有助于动物的生长,也可以保证动物产生疾病的几率极大减少。另外,芽孢杆菌分泌出的抗菌物质可以使动物体内的一些脏器长期稳定的处于高海拔应激状态,进而提高自身代谢水平增加宿主自身的免疫力。因此研究芽孢杆菌在动物营养与饲料中的应用前景十分广阔[13]。
目前,奶牛等反刍动物瘤胃微生物多样性研究主要利用宏基因组学新一代高通量测序技术(NGS)以特定环境下微生物群体基因组为研究对象,在分析微生物多样性、种群结构、进化关系的基础上,可进一步探究微生物群体功能特性、相互协作关系及与环境之间的关系,发掘潜在的生物学意义[14]。但是传统纯培养的方式也可进行胃肠道微生物中可培养的菌群物种,通过分析纯菌株的生理生化特征,进行后续研究论证;随着传统纯培养的方式发展,并利用培养技术分离纯化菌株,为未来相关奶牛领域研究提供基础。对于未来对奶牛疾病研究,奶牛免疫机制研究和奶牛微生态方向研究等相关领域开发都有重要的基础理论支持和数据支撑,对于养殖业的发展意义重大[15]。
对于养殖动物而言,对其的消化道微生物的分离和培养具有重要意义,尤其是在对其肠道功能菌群的分离鉴定及其生物特性检测上,这可以为日后加强对其肠道健康的研究及对其合理饲喂以及开发适应的微生态制剂产品做出巨大贡献。因为它为深入的生理学研究提供了参考菌株,拓宽了在微生物基础研究领域的视野,并为生产具有商业价值的代谢物提供了新的生物体[16-17]。此后的实验中应及时总结调整,对前人所做实验及实验应取其精华去其糟粕,应结合16S rRNA 基因测序方法,调整培养基配方及实验室条件,以此来达到增加可培养细菌数目的。并且应将生物信息技术与菌株培养合理的结合互补,使实验高效准确的进行。SSU rRNA 基因(也称为16S rRNA 基因)广泛用于微生物生态学研究中作为“条形码基因”来量化微生物群落结构和多样性。它作为微生物条形码基因的广泛采用受到基因的几个理想特性的驱动,包括它在细菌和古细菌中具有通用性的事实,它可以通过聚合酶一次性从多种分类群中轻易扩增。连锁反应(PCR),它具有系统发育信息,可用于基于16S rRNA 序列的广泛数据库鉴定和种系型序列及相关的分类学和系统发育信息[18-19]。
动物肠道微生物组的研究目前以菌株为单位的培养性研究是基础,同时其证明了在菌株层次水平的研究是一种必需方法对于动物微生物组方面,同时其也是一种必需方法从单纯细菌扩繁纯培养过渡到其他微生物的扩繁,是作为基础应用于生物信息分析优化[20]。菌株的分离纯培养也是微生物组转化的物质基础,更为研究奶牛的功能菌群、活菌药物库、诊断标准物质以及指导新微生态制剂或合成制剂的开发提供了基础数据。安全和效果是两个最重要的方面对于研发活菌药物,而培养及鉴定都与之密不可分[21-22]。
因为细菌种类繁多,由于其菌体内的代谢差异,对营养物质利用吸收及合成产物的不同方式,造成了用于鉴定细菌的种类可以应用不同的理化性质的生化试验。其中鉴定的最重要的一种,是检测菌的分解其吸收的营养物质方式的不同样及其代谢所产生的产物的不同而对细菌进行鉴定,包括蛋白质分解试验、氧化酶试验、糖分解产物试验等[23]。可以通过不同的生化鉴定方式组合去初步验证分离纯化的菌株是否所需,并结合分子生物学技术、16S rRNA 基因测序方法等方法更准确鉴定出需要的菌株,大大提高了试验准确性,排除分子生物学技术、16S rRNA 扩增子测序等方法的一些误差。
芽孢杆菌可产生某些重要的活性物质,其可抑制作用于对致病菌或条件致病菌导致的内源性感染;在促进厌氧益生菌的生长发育时芽孢杆菌也有促进作用,同时导致致病菌间接生长抑制;其也可以促进机体的免疫功能能力,使群体免疫力上升。对于代谢功能差异性大的放线菌来说,生物活性物质是其主要的表现之一,同时也是其作为微生物资源原因之一[24]。
通过这些研究说明功能菌在动物体内发挥着毋庸置疑的作用,然而,功能菌在疾病治疗中仍然存在一些问题需要解决,例如,是否可以在体内长期存在、是否占有固定的生态位、是否可以通过分离培养及鉴定的技术方法人为地将特定动物体内原有生态位上的功能菌进行大量繁殖,通过转化提高动物产品,以此用作动物的日常保健及疾病的治疗,这可能会成为未来科学化养殖的一个焦点[25-26]。
4 结论
在实验中分离所得14 株芽孢杆菌菌株,经过16S rRNA 测序、生物信息技术分析检测,结果显示分离所得14 株芽孢杆菌菌株共为6 种:2 株沙福芽孢杆菌,5 株地衣芽孢杆菌,2 株短小芽孢杆菌,1 株海洋沉积物芽孢杆菌,2 株高山芽孢杆菌;与Gen Bank中公布的株芽孢杆菌参考株进行同源性对比分析,同源性为99.93%~100%。系统发育树分析发现,分离菌株L1~L14 与8 株参考株亲缘关系较近,同源性均为99.9%。其中地衣芽孢杆菌和短小芽孢杆菌芽孢杆菌均属于可添加饲喂益生菌。这些分离得到的菌株会在后续开展的菌制剂等方面的研究中进行应用验证。
