CO2加氢制甲醇铜基催化剂:分散度调控选择性
2022-08-29崔晓静颜丽红王慧芳薛彦峰牛宇岚邓天昇
崔晓静, 颜丽红, 王慧芳, 杨 红, 薛彦峰, 张 颌, 牛宇岚, 邓天昇
CO2加氢制甲醇铜基催化剂:分散度调控选择性
崔晓静1, 颜丽红2, 王慧芳1, 杨 红1, 薛彦峰1, 张 颌1, 牛宇岚1, 邓天昇3
(1. 太原工业学院 化学与化工系 界面化学与工程研究所, 山西 太原 030008;2. 天通控股股份有限公司,浙江 海宁 314400; 3. 中国科学院 山西煤炭化学研究所,山西 太原 030001)
针对Cu/ZnO/Al2O3催化CO2加氢制甲醇反应中,一氧化碳(CO)选择性较高的问题,提出有效降低CO选择性的方法。将该催化剂分散到SiO2载体上,调控催化剂中CuO晶粒在SiO2上的分散度。结合高倍透射电镜(HRTEM)、高角环形暗场像-扫描透射电镜(HADDF-STEM)和X-射线光电子能谱(XPS)等,研究催化剂的形貌结构、表面元素化学状态及铜的分散度等,并评价催化剂性能。结果表明,只改变铜在SiO2上的分散度,就能显著调控CO2加氢的选择性。提高铜晶粒分散度能有效抑制CO的生成,将甲醇和二甲醚的选择性从43.4%提高至71.4%。
二氧化碳;加氢;甲醇;铜基催化剂;铜分散度
1 前言
将CO2绿色高效地转化为含碳化学品,对于实现我国“双碳”目标具有重要意义[1-3]。CO2可转化为CO[4]、烃类[5-6]和甲醇[7-8]等,其中甲醇在未来化工和能源产业中具有独特地位。甲醇可转化为汽油[5]、烯烃[6]、芳烃[9]、含氧化学品[10]等;它还是安全高效的储氢分子。因此,CO2加氢制甲醇技术具有广阔的应用前景。铜基体系是这一过程最常用的催化剂[4-5,7-8,11],但它在此过程中也催化逆水煤气变换反应(CO2+H2↔CO+H2O, reverse water-gas-shift reaction, RWGS),导致CO选择性(以摩尔分数计,下同)常在50%~80%[7, 12]。抑制铜基催化剂的RWGS活性,提高甲醇选择性,是这一过程的关键技术挑战之一。
多年来,研究者致力于铜基催化剂的选择性调控研究,取得了诸多突破性进展。Gao等[12]通过调控Cu/Zn/Zr/Al催化剂表面碱性位点数,可将甲醇选择性从41.7% 提高至54.5%。Arena等[13]将ZrO2引入Cu/ZnO,通过增大催化剂表面活性铜的量,将甲醇选择性从50% 提高至约75%。Larmier等[14]发现,Cu与ZrO2间的强相互作用有利于提高Cu基催化剂的甲醇选择性。Mao等[15]在Cu/ZrO2中引入La,将甲醇选择性从58% 提高到72%。Yao等[16]将In2O3引入Cu/ZrO2,可将甲醇选择性从32%显著提高至80%左右。Gao等[17]还在Cu/Zn/Al/Zr中引入F-,将甲醇选择性从46% 提高至53%。Chen等[18]采用CuBr2修饰Cu/Zn/Zr表面,可将甲醇选择性从52.6% 显著提高至97.1%。
为降低CO选择性,提高甲醇选择性,在铜基催化剂中常含ZrO2组分。而对于Cu/ZnO体系,其甲醇选择性不太理想,往往在20%~50%。Cu/ZnO体系价格比Cu/ZrO2低廉,也是合成气制甲醇的工业催化剂,有效降低CO选择性,更有利于CO2加氢制甲醇技术的应用。本研究通过多种工艺调控铜在载体上的分散度,结合高倍透射电镜(high-resolution transmission electron microscopy, HRTEM)、高角环形暗场像-扫描透射电镜像(high-angle annular dark field-scanning transmission electron microscopy, HAADF-STEM)和原位X-射线光电子能谱(X-ray photoelectron spectroscopy, XPS)等证明,调控铜在载体上的分散度能有效抑制RWGS活性,降低CO选择性,显著提高甲醇选择性。
2 实验(材料与方法)
2.1 实验材料与仪器
所用催化剂前驱体为工业Cu/ZnO/Al2O3催化剂(CZA),由中石化南化集团研究院提供,其Cu、Zn、Al和C的质量分数分别为46.2%、19.5%、4.8%和 2.7%;SiO2(M-5)购自Cabot公司;无水乙醇(分析纯) 购自国药集团化学试剂有限公司;去离子水为实验室自制。
2.2 催化剂制备
催化剂制备见图1。CZA-S制备:将6.0 g CZA与10.5 g ZSM-5晶种液混合(晶种:质量分数为5.0%),在室温下超声分散5 h,然后封装入30 mL不锈钢水热合成釜,在170 ℃下水热合成2 d,所得固体经去离子水洗涤、100 ℃干燥40 h(详见文献[7])。CZA/SiO2-(=1, 2)的质量比CZA/SiO2=1:2,制备如下:将2.0 g CZA和4.0 g SiO2加入1 167.0 g去离子水中,在室温下搅拌并分别超声3 h(=1)和8 h(=2)。CZA-S/SiO2-(=1, 2, 3)的CZA-S/SiO2=1:2,制备如下:将2.0 g CZA-S和4.0 g SiO2加入1 167.0 g去离子水中,在室温下搅拌、超声8 h(=1);将1.0 g(=2)、0.6 g(=3) CZA-S加入1 000 mL无水乙醇中,在室温下搅拌、超声8 h,再分别加入2.0 g(=2)、1.2 g(=3) SiO2,搅拌、超声2 h,再加入800.0 g去离子水,搅拌、超声5 h。所得混合物体系,经离心分离和旋转蒸发、80 ℃干燥过夜、330 ℃焙烧3 h,得到最终催化剂。
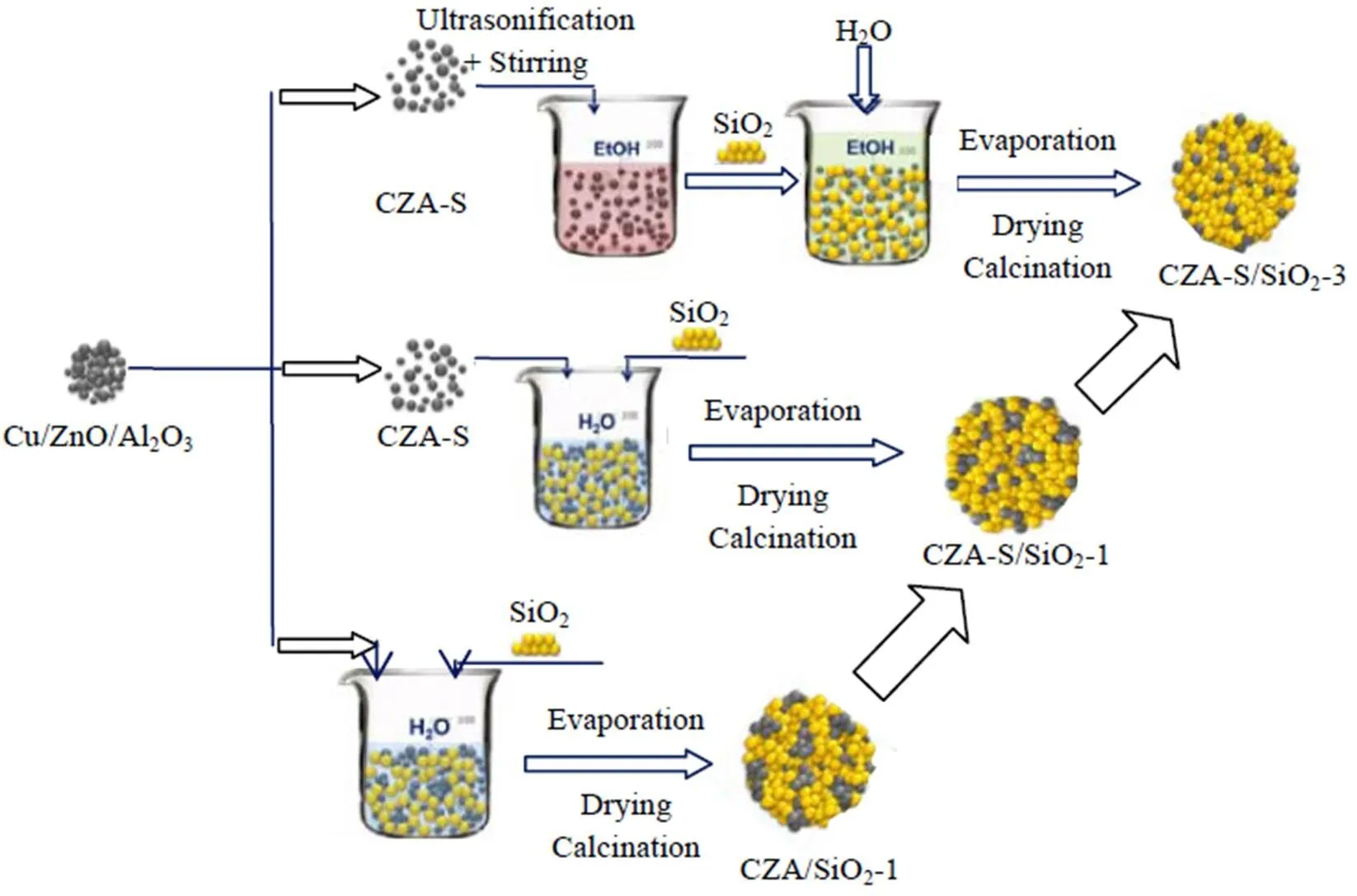
图1 催化剂的制备流程图
2.3 催化剂表征及反应
X-射线衍射(X-ray diffraction, XRD)在Rigaku的MiniFlex II型X射线衍仪(5o~80o, 4(o)×min-1)上测定,射线源为Cu Kα。HRTEM和HAADF-STEM在JEOL JEM-2100F高分辨透射电子显微镜上测得,工作电压是200 kV。XPS和俄歇电子谱(Auger electron spectroscopy, AES)在Kratos的AXIS ULTRA DLD上测定。以Al Kα靶为X射线辐射源,以表面污染碳的C 1s结合能校正其他元素的结合能。在原位XPS中,催化剂在测量前经体积比为10% 的H2/Ar混合气体流速为30 mL×min-1及250 ℃下还原2 h。反应性能采用固定床反应器评价。将0.86 g催化剂(粒径为0.43~0.85 mm)与石英砂混合,在常压、体积比为5.6% 的H2/Ar混合气体及250 ℃下还原10 h,标准状况下,每小时每克Cu上流过的气体体积为23.8 L;还原结束后,将温度降至180 ℃,采用原料气(H2、CO2体积比为5:1)对体系充压至3.4 MPa,再将温度升至210 ℃,在标准状况下,每小时每克Cu上流过的气体体积为10.7 L,反应开始。尾气采用在线气相色谱分析(7890A,Agilent),该色谱TCD的5A分子筛柱分析H2、CO2、CO和CH4等;其FID的GS-OxyPLOT柱分析CH3OH和CH3OCH3。液体产物中的CH3OH和CH3OCH3采用另一Agilent 7890A气相色谱仪分析。CO2转化率和产物碳选择性采用外标法计算。
3 实验结果与讨论
3.1 催化剂的制备和表征
以工业Cu/ZnO/Al2O3催化剂(CZA)为铜源制备CuO晶粒在SiO2上分散度不同的催化剂。所有催化剂的CuO都来源于CZA,因而能保证这些CuO晶粒的形貌、尺寸和化学性质都是相当的。通过调控溶剂种类、超声和搅拌时间等对CZA中的CuO晶粒进行分散。首先在H2O体系中,通过调控超声和搅拌时间(3 h和8 h),逐渐分散CZA,制得CZA/SiO2-1和CZA/SiO2-2;为了更好地分散CuO晶粒,利用ZSM-5晶种液对CZA预分散(CZA-S),再在H2O或乙醇/H2O中分散,制得CZA-S/SiO2-(=1, 2, 3)。
HRTEM和XRD结果显示,CZA中CuO晶粒分布均匀,尺寸约为5.8 nm(图2(a)、(b))。利用HRTEM考察CZA在不同条件下的分散度。结果显示,在水体系中改变超声和搅拌时间,当超声和搅拌的时间延长至 8 h时,CZA的微米团簇分散程度不高,所得团簇尺寸较大,在几百纳米,且团簇中的纳米晶粒彼此间结合较为紧密(图2(c))。在水体系中,利用ZSM-5晶种液对CZA预处理,CZA的纳米团簇进一步分散,尺寸变小,且其中的纳米颗粒彼此间开始变得松散,小部分纳米颗粒孤立分散(图2(d));以乙醇为溶剂时,CZA中绝大部分纳米晶粒彼此分散,以孤立或以亚纳米团簇形式存在(图2(e)、(f))。

图2 氧化态催化剂的TEM图
采用HAADF-STEM表征催化剂中纳米CuO晶粒的分散度,结果见图3。催化剂中CuO颗粒为结晶型,而载体SiO2颗粒为无定形,可被HAADF-STEM表征有效区分。图3(a)~(d)为HRTEM模式下的催化剂;图3(e)~(h)为HAADF-STEM模式下的催化剂,其中白色亮点为纳米CuO晶粒。在CZA/SiO2-1中,CuO晶粒在SiO2上的分散度较低,彼此团聚在一起,形成几百纳米的团簇(图3(e));在CZA-S/SiO2-1中,CuO晶粒在SiO2上的分散度有所提高,部分CuO晶粒彼此间分散(图3(f));在CZA-S/SiO2-2,CuO晶粒在SiO2上的分散度明显提高(图3(g));特别是CZA-S/SiO2-3,其CuO晶粒基本分散开,鲜有团簇存在(图3(h))。对图片中CuO晶粒间的距离进行统计和平均(图3(i))。随着CuO晶粒分散度的提高,CuO在SiO2上的平均距离从28.7 nm逐渐增大到66.5 nm。这些结果说明,调控制备条件,可有效调控CuO晶粒在SiO2上的分散度。进一步比较了催化剂中纳米CuO晶粒的形貌和尺寸。HRTEM和HAADF-STEM表征表明,纳米CuO晶粒的形貌和尺寸近似(图3);XRD结果也证实了这一点,系列催化剂中的CuO晶粒特征衍射峰[7-8]的位置相近、相对高度和半峰宽相似(图4(a))。

图3 催化剂的HRTEM和HAADF-STEM图以及CuO晶粒在SiO2上的平均距离
催化剂在反应前需经还原。CuO晶粒在SiO2上分散度不同时,其还原状态可能存在差异。为了排除这一可能,选取铜晶粒在SiO2上分散度相差最大的CZA/SiO2-1和CZA-S/SiO2-3,采用原位XPS表征两者在还原后表面各元素的化学状态。2个催化剂中Cu 2p3/2出峰位置分别在931.7和931.5 eV,峰值相差0.2 eV(图5(a)),该差值在XPS仪器测量误差范围内(±0.1 eV),可以认为2个催化剂的出峰位置接近;同时,在940~947 eV和961~966 eV没有卫星峰,说明还原后催化剂表面没有Cu2+物种[7]。由于Cu0和Cu+物种的Cu 2p XPS谱图难以区分,因此选择AES分析催化剂表面Cu0和Cu+分布。如图5(b)所示,2个催化剂在918.5和914.4 eV处出峰,分别对应Cu0和Cu+物种[7,10]。对比Cu0和Cu+峰的相对强度,可以看出2个催化剂中表面铜分布近似,主要为Cu0。此外,2个催化剂表面Zn和Al的XPS谱图也相似(图5(c)~5(d))。其中,Zn 2p3/2出峰位置十分接近(1 022.0、1 021.9 eV),对应Zn2+(ZnO)物种[7];Al 2p出峰位置也相差很小(74.6、74.7 eV),对应于Al3+(Al2O3)物种[8]。这些结果说明还原催化剂表面各元素的化学状态相当,没有明显区别。
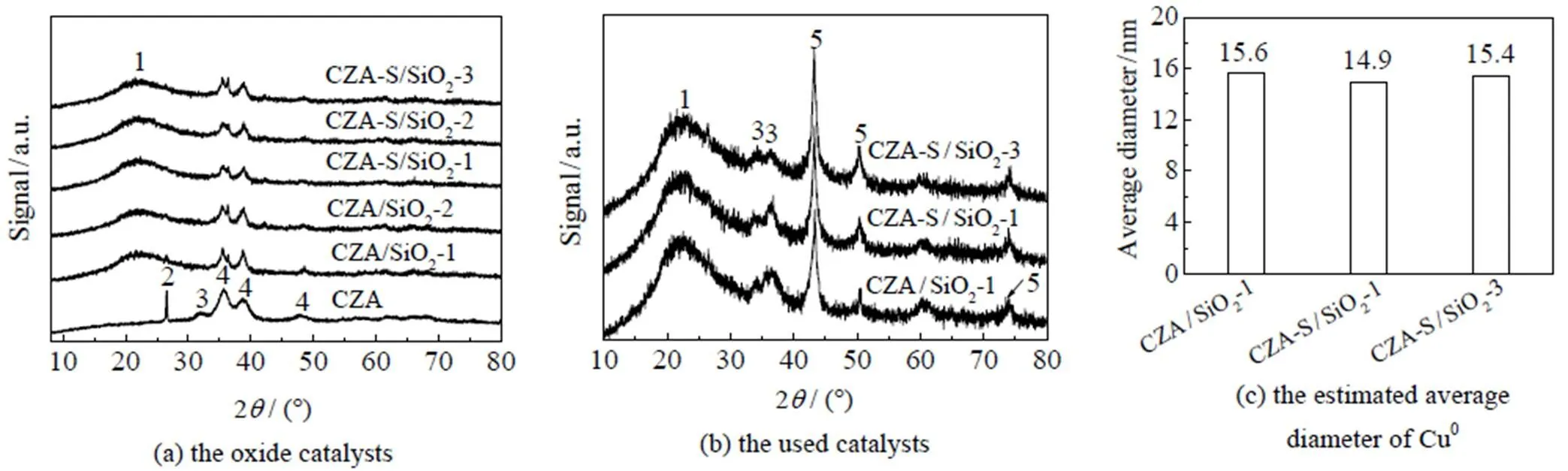
图4 催化剂的XRD谱图
1. SiO22. graphite 3. ZnO 4. CuO 5. metallic Cu (Cu0)
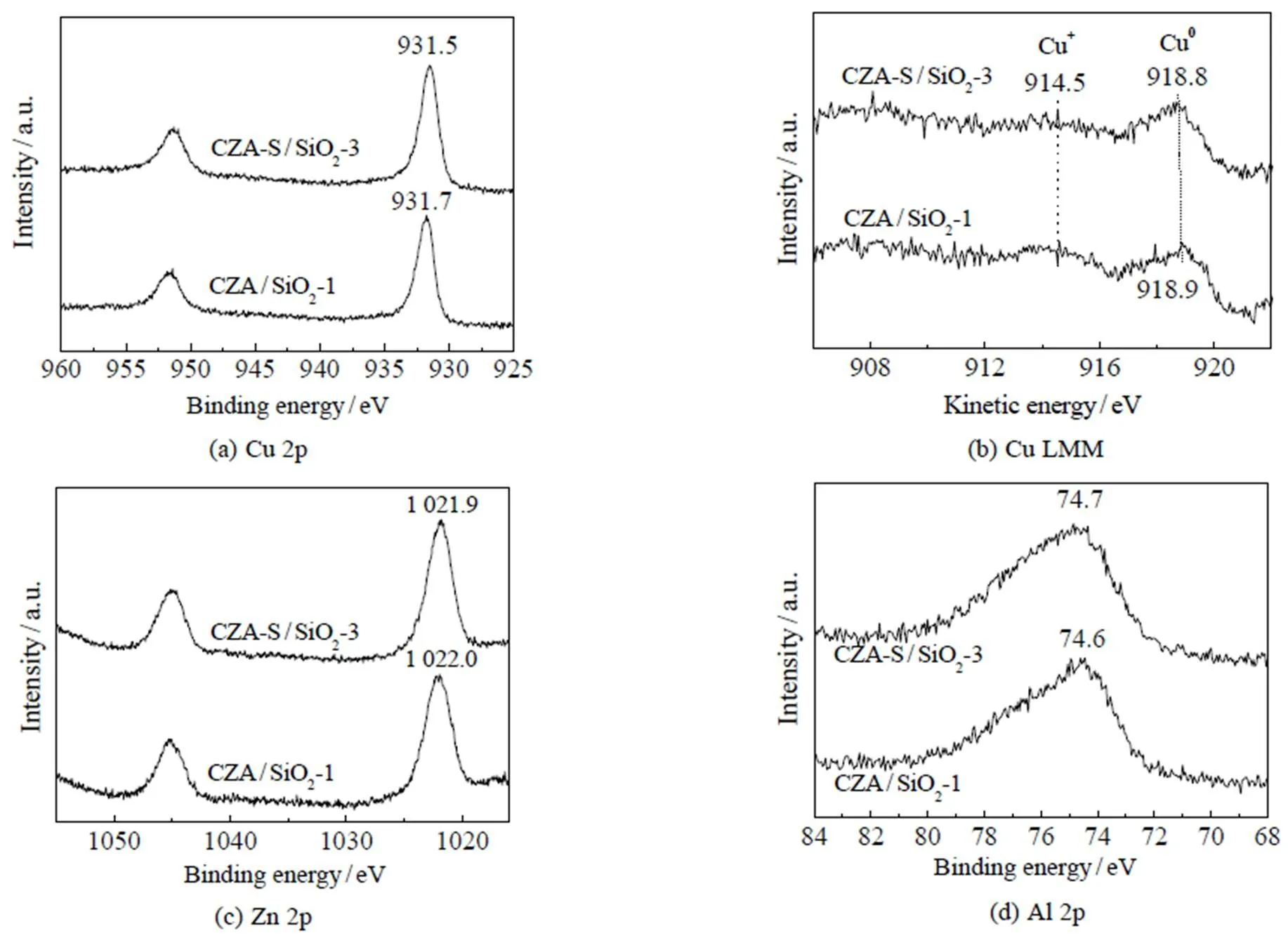
图5 还原催化剂的原位XPS谱图
3.2 催化剂评价
催化剂的CO2转化率和各产物碳选择性(以摩尔分数计)见图6和图7(a)。随着铜晶粒在SiO2上的分散度逐渐提高,CH3OH选择性M和CH3OCH3选择性D逐渐升高;由于CH3OCH3是CH3OH在催化剂上脱水而得,可将其与CH3OH加合,得到CH3OH和CH3OCH3的总选择性D+M。随着铜晶粒在SiO2上的分散度逐渐增大,D+M从43.4% 上升至71.4%;CO选择性CO从56.5% 降低至28.6%;同时,CO2转化率也从12.9% 逐渐降至7.7%。CO2转化率的高低可能影响选择性。为了排除这一因素的影响,选择选择性最高的CZA-S/SiO2-3,通过降低反应空速、提高反应的转化率,反应评价结果见图6的CZA-S/SiO2-3-LSV曲线。当反应空速降至原来的一半时,CO2转化率可提高至11.7%,与CZA/SiO2-1相近(12.9%),但其D+M达62.8%(M:48.0%;D:14.8%),明显高于CZA/SiO2-1的D+M(43.4%)。因此CO2转化率的高低不是造成选择性差异的主要原因。另外,由图7(b)可见,随着铜晶粒在SiO2上的分散度逐渐增大,生成CH3OH和CH3OCH3的总本征活性(TOFD+M)基本保持不变;而生成CO的RWGS反应本征活性(TOFCO)显著下降,降幅高达70% 左右,单位时间每摩尔Cu生成CO物质的量从370.7降低至112.4 mmol,最终导致CO选择性明显降低,CH3OH和CH3OCH3选择性显著提高。
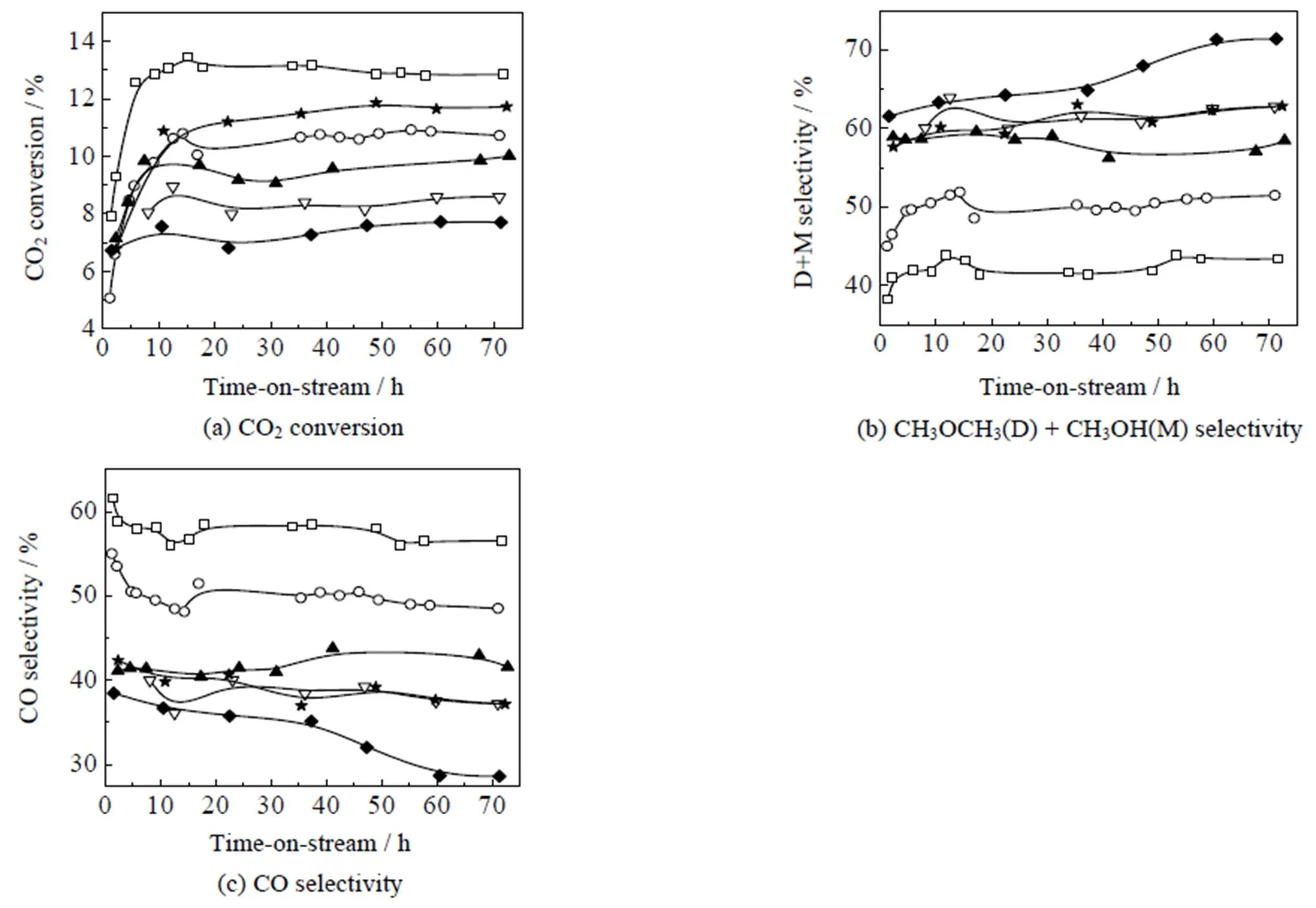
图6 催化剂的固定床反应性能

CZA-S/SiO2-2 CZA-S/SiO2-3 CZA-S/SiO2-3-LSV
3.3 反应后的催化剂表征
Cu0催化CO2加氢生成CH3OH[7-8]。反应过程中Cu0晶粒可能聚集长大,导致选择性的差异。对反应后催化剂中的活性Cu0进行XRD表征。由图4(b)可见,各催化剂都在2=43.2o处出现Cu0特征峰[7],且峰形近似,说明各催化剂中Cu0晶粒尺寸分布近似;采用谢乐公式计算Cu0晶粒的尺寸,结果见图4(c);各催化剂Cu0晶粒尺寸接近,在14.9~15.6 nm。因此催化剂选择性的差异不是由于Cu0晶粒大小不同导致的。XPS结果表明(图8),催化剂的Cu 2p3/2特征峰位于932.5~932.7 eV,电子结合能差值在XPS仪器误差范围内;Zn 2p3/2特征峰没有明显差异,位于1 021.6~1 021.9 eV,对应于Zn2+(ZnO)[7];同时Al 2p特征峰峰位相近、峰形相似,都位于76.1 eV附近,对应于Al3+物种(Al2O3)[8];Si 2p特征峰在103.3~103.6 eV,差值(0.3 eV)接近XPS仪器误差范围。这些说明反应后催化剂表面各元素化学状态近似,没有明显差别。因而催化剂表面元素的化学状态不是导致选择性差别显著的原因。由此,催化剂选择性的差异主要是由于铜晶粒在SiO2上分散度不同所致。
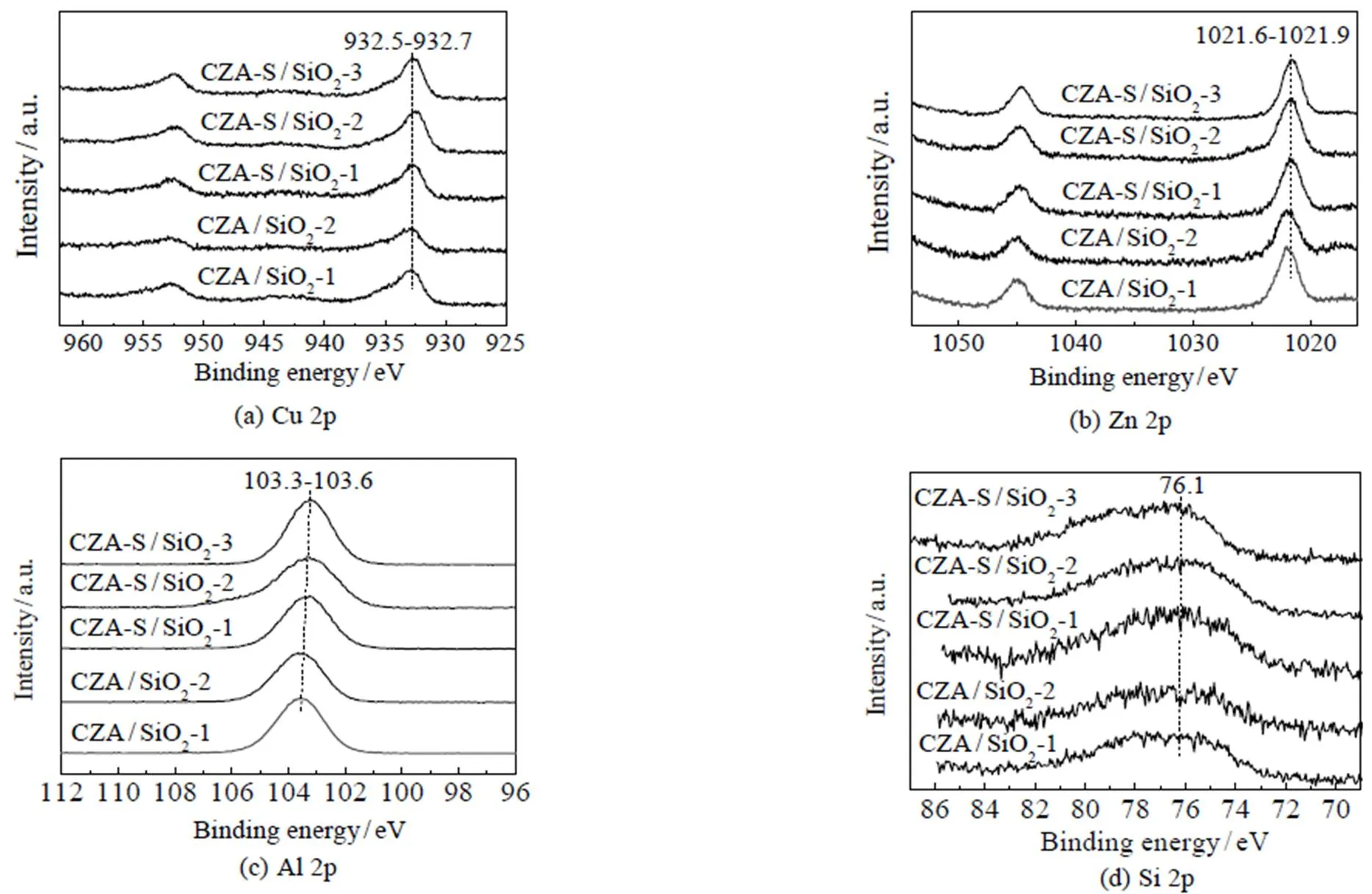
图8 反应后催化剂的XPS谱图
活性金属分散度影响加氢反应选择性的本质原因有以下几种:1)金属分散度高,有利于缓解金属的聚集和烧结[7,11];2)金属分散度调变金属-载体相互作用[3,7];3)金属分散度影响活性中间物种,特别是活性氢,在催化剂上的扩散,进而调变反应路径[3-4, 19]。本研究XRD结果表明,Cu分散度不同的催化剂在反应后,其Cu0晶粒尺寸都接近,而XPS结果显示,不同Cu分散度的催化剂,其Cu和Si的电子结合能都没有明显差别,说明Cu-SiO2相互作用是接近的;因此,活性铜金属的聚集烧结以及Cu-SiO2相互作用不是其选择性差异的本质原因。基于此本研究推测在不同Cu分散度的催化剂上,Cu0上产生的活性氢能溢流到载体SiO2上,而铜的分散度影响溢流氢在载体上的浓度,从而影响加氢反应路径,改变选择性。
4 结论
采用不同工艺将工业Cu/ZnO/Al2O3中的纳米CuO晶粒分散到SiO2载体上,制备纳米CuO晶粒分散度不同的催化剂;HRTEM、HADDF-STEM和原位XPS等证实,在所有催化剂中,除了铜晶粒在SiO2上分散度不同外,其他参数基本接近(催化剂物相结构、铜的形貌尺寸、表面元素化学状态等);固定床评价结果表明,铜晶粒在SiO2上的分散度能有效调控选择性。随着铜晶粒在SiO2上的分散度逐渐提高,生成CO的本征活性显著受到抑制,导致CH3OH和CH3OCH3选择性显著提高,CO选择性明显降低。
[1] 林春绵, 丁春晓, 张平, 等. 金属醋酸盐复配催化剂催化超临界CO2一步法合成碳酸二甲酯 [J]. 高校化学工程学报, 2012, 26(2): 320-325.
LIN C J, DING C X, ZHANG P,. One-pot synthesis of dimethyl carbonate from supercritical CO2catalyzed by using metal acetates formulation catalyst [J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(2): 320-325.
[2] 杜智美, 姚佩芳, 房鼎业, 等. 压力对甲醇合成本征反应速率常数的影响[J]. 高校化学工程学报, 1992, 6(1): 81-86.
DU Z M, YAO P F, FANG D Y,. Influence of pressures upon reaction rate constants of intrinsic reaction kinetics of methanol synthesis [J]. Journal of Chemical Engineering of Chinese Universities, 1992, 6(1): 81-86.
[3] 李聪明, 陈阔, 王晓月, 等. 探究Cu/ZnO相互作用对CO2加氢制甲醇反应性能的影响[J]. 物理化学学报, 2021, 37(5): 201-212.
LI C M, CHEN K, WANG X Y,, Understanding the role of Cu/ZnO interaction in CO2hydrogenation to methanol [J].Acta Physico-Chimica Sinica, 2021, 37(5): 201-212.
[4] WANG C T, GUAN E, WANG L,. Product selectivity controlled by nanoporous environments in zeolite crystals enveloping Rhodium nanoparticles catalysts for CO2hydrogenation [J]. Journal of the American Chemical Society, 2019, 141(21): 8482-8488.
[5] GAO P, LI S, BU X,. Direct conversion of CO2into liquid fuels with high selectivity over a bifunctional catalyst [J].Nature Chemistry, 2017, 9: 1019-1024.
[6] WANG S, ZHANG L, ZHANG W,. Selective conversion of CO2into propene and butene [J].Chem, 2020, 6(12): 3344-3363.
[7] CUI X, YAN W J, YANG H,. Preserving the active Cu-ZnO interface for selective hydrogenation of CO2to dimethyl ether and methanol [J].ACS Sustainable Chemistry & Engineering, 2021, 9(7): 2661-2672.
[8] CUI X, CHEN S, YANG H,. Improving methanol selectivity in CO2hydrogenation by tuning the distance of Cu on catalyst [J].Applied Catalysis B: Environmental, 2021, 298: 120590.
[9] NI Y, ZHEN Z, FU Y,. Selective conversion of CO2and H2into aromatics [J].Nature Communications, 2018, 9: 3457.
[10] YANG H, CHEN Y, CUI X,. A highly stable copper-based catalyst for clarifying the catalytic roles of Cu0and Cu+species in methanol dehydrogenation [J].Angewandte Chemie International Edition, 2018,130(7): 1854-1858.
[11] CHEN K, FANG H, WU S,. CO2hydrogenation to methanol over Cu catalysts supported on La-modified SBA-15: The crucial role of Cu-LaOinterfaces [J].Applied Catalysis B: Environmental, 2019, 251: 119-129.
[12] GAO P, LI F, ZHAN H,. Influence of Zr on the performance of Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2hydrogenation to methanol [J].Journal of Catalysis, 2013, 298: 51-60.
[13] ARENA F, BARBERA K, ITALIANO G,. Synthesis, characterization and activity pattern of Cu-ZnO/ZrO2catalysts in the hydrogenation of carbon dioxide to methanol [J].Journal of Catalysis, 2007, 249(2): 185-194.
[14] KIM L, WEI-CHIH L, SHOHEI T,. CO2-to-Methanol Hydrogenation on Zirconia-Supported Copper Nanoparticles: Reaction Intermediates and the Role of the Metal-Support Interface [J].Angewandte Chemie International Edition, 2017, 56(9): 2318-2323.
[15] GUO X, MAO D, LU G,. The influence of La doping on the catalytic behavior of Cu/ZrO2for methanol synthesis from CO2hydrogenation [J].Journal of Molecular Catalysis A: Chemical, 2011, 345(1/2): 60-68.
[16] YAO L, SHEN X, PAN Y,. Synergy between active sites of Cu-In-Zr-O catalyst in CO2hydrogenation to methanol [J].Journal of Catalysis, 2019, 372: 74-85.
[17] GAO P, LI F, ZHAN H,. Fluorine-modified Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2hydrogenation to methanol [J].Catalysis Communications, 2014, 50: 78-82.
[18] CHEN S, ZHANG J, SONG F,. Induced high selectivity methanol formation during CO2hydrogenation over a CuBr2- modified CuZnZr catalyst [J].Journal of Catalysis, 2020, 389: 47-59.
[19] 李剑, 何思达, 楚爽, 等. 纳米微晶纤维素辅助合成加氢脱芳催化剂 [J]. 高校化学工程学报, 2021, 35(4): 675-682.
LI J, HE S D, CHU S,. Synthesis of hydrodearomatization catalyst using nano-cellulose as the auxiliary template [J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(4): 675-682.
Improvement of methanol selectivity in CO2hydrogenation via tuning Cu dispersion on support
CUI Xiao-jing1, YAN Li-hong2, WANG Hui-fang1, YANG Hong1,XUE Yan-feng1, ZHANG He1, NIU Yu-lan1, DENG Tian-sheng3
(1. Institute of Interface Chemistry and Engineering, Department of Chemistry and Chemical Engineering,Taiyuan Institute of Technology, Taiyuan 030008, China;2. TDG Holding Company Limited, Haining 314400, China;3. Institute of Coal Chemistry, Chinese Academy of Sciences, Taiyuan 030001, China)
In order to reduce CO selectivity in CO2hydrogenation catalyzed by Cu/ZnO/Al2O3to produce methanol, an industrial Cu/ZnO/Al2O3catalyst was supported onto SiO2, and the dispersion of CuO nanoparticles on SiO2was regulated by the preparation procedures. Catalyst structure, covalent state of surface elements, and Cu dispersion on SiO2were explored by HRTEM, HADDF-STEM, and XPS. The results show that the dispersion of Cu on SiO2can tune CO selectivity. The intrinsic activity for CO formation is largely suppressed when Cu dispersion on SiO2is improved. As a result, the selectivity of methanol and dimethyl ether enhances from 43.4% to 71.4%.
carbon dioxide; hydrogenation; methanol; copper-based catalyst; copper dispersion
O643.38
A
10.3969/j.issn.1003-9015.2022.00.007
1003-9015(2022)04-0562-08
https://kns.cnki.net/kcms/detail/33.1141.TQ.20220519.1230.002.html
2021-09-29;
2021-12-23。
2022-05-19 17:15:35
国家自然科学基金(21972159,21303240,22072105);山西省应用基础研究计划 (201901D111321);山西省ʻ1331工程ʼ;山西省高等学校科技创新项目(2021L536);太原工业学院青年(后备)学科带头人支持计划。
崔晓静(1982-),女,安徽蚌埠人,太原工业学院副研究员,博士。
牛宇岚,E-mail:niuyulan@163.com
崔晓静, 颜丽红, 王慧芳, 杨红, 薛彦峰, 张郃, 牛宇岚, 邓天昇.CO2加氢制甲醇铜基催化剂:分散度调控选择性[J]. 高校化学工程学报, 2022, 36(4): 562-569.
:CUI Xiao-jing, YAN Li-hong, WANG Hui-fang, YANG Hong, XUE Yan-feng, ZHANG He, NIU Yu-lan, DENG Tian-sheng. Improving methanol selectivity in CO2hydrogenation via tuning Cu dispersion on support [J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(4): 562-569.
